湖南省长沙市雅礼集团(七校)2023-2024学年高一下学期期末考试化学试题(PDF版含答案)
文档属性
| 名称 | 湖南省长沙市雅礼集团(七校)2023-2024学年高一下学期期末考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 669.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-26 21:04:54 | ||
图片预览



文档简介
湖南省长沙市雅礼集团(七校)2023-2024学年高一下学期期末考试
化学试题
时量:75分钟 分值:100分
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32 Fe~56 Cu~64
一、选择题(本题共 14小题,每小题只有一个选项符合题意。每小题 3分,共 42分。)
1. 化学与生活、生产、科技、环境密不可分。下列说法错误的是
A. 重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可以观察到丁达尔效应
B. 长沙马王堆出土的“素纱禅衣”由蚕丝织成,其主要成分是蛋白质
C. 东北三省出土的金代六曲葵花婆金银盏属于硅酸盐材料
D. 安徽繁昌窑所产青白瓷是以黏土为原料高温烧结而成
2. 下列化学用语正确的是
A. 丙烷分子的球棍模型:
B. 乙醇的官能团:-COOH
C. 一氯甲烷的电子式:
D. CCl4空间填充模型:
3. 下列各种情况下,溶液中一定能大量存在的离子组是
A. 在常温pH 1 的溶液中:NH 、Fe2 4 、SO
2
3 、NO
3
B. 能使酚酞溶液变红的溶液中:Na 、Ba2 、Cl 、NO3
C. SO2 有 存在的溶液中:Na 、Mg2 、Ba2 、Br 4
D. 2 无色透明的水溶液中:K 、Fe3 、Cl 、SO4
4. 已知 NA阿伏加德罗常数的值,下列说法正确的是
A. 常温下,6.8gH2O2中的共价键数目为 0.8NA
B. 在标准状况下,1molSO3的体积为 22.4L
C. 20g质量分数为 46%的乙醇(C2H5OH )溶液中含有氧原子数为 0.8NA
D. 100mL18.4mol/L的硫酸与足量铜反应,生成的 SO2的物质的量为 0.92mol
5. 氮及其化合物的转化具有重要应用。下列说法不正确的是
A. Cu O实验室探究稀硝酸与铜反应的气态产物:HNO3 稀 NO 2 NO2
B. O H O工业制硝酸过程中的物质转化:N2 2 NO 2 HNO放电或高温 3
催化剂
C. 汽车尾气催化转化器中发生的主要反应: 2NO+2CO N2+2CO2
D. 实验室用浓氨水、生石灰制备少量氨气:NH3 H2O+CaO Ca OH +NH2 3
6. 一种利用磁铁矿(Fe3O4 )制备铁红的流程如下:
磁铁矿 稀 硫 酸 滤液A 试 剂 a,过滤 滤液B(FeSO ) N H4 HCO4 3 固体FeCO3
煅 烧 铁红
过滤 过滤
下列说法正确的是
A. 往滤液 A中滴加少量酸性KMnO4溶液,可观察到紫红色褪去
B. 可以用 KSCN溶液和氯水检验滤液 A中是否有Fe2
煅烧
C. FeCO3在空气中煅烧的反应方程式为 FeCO3 FeO CO2
D. 最终得到铁红中的 Fe 元素的质量小于原磁铁矿中的 Fe 元素的质量
7. 钠及其化合物的“价-类”二维图及部分转化关系如图所示,其中 B为钠的另一种氧化物。下列有关说法
正确的是
A. 物质 B为Na 2O,是碱性氧化物,A的物质类别为碱
B. 反应④通过加入还原剂实现转化
C. 钠放入硫酸铜溶液中可观察到红色固体析出
D. 可用澄清的石灰水鉴别Na 2CO3溶液和NaHCO3溶液
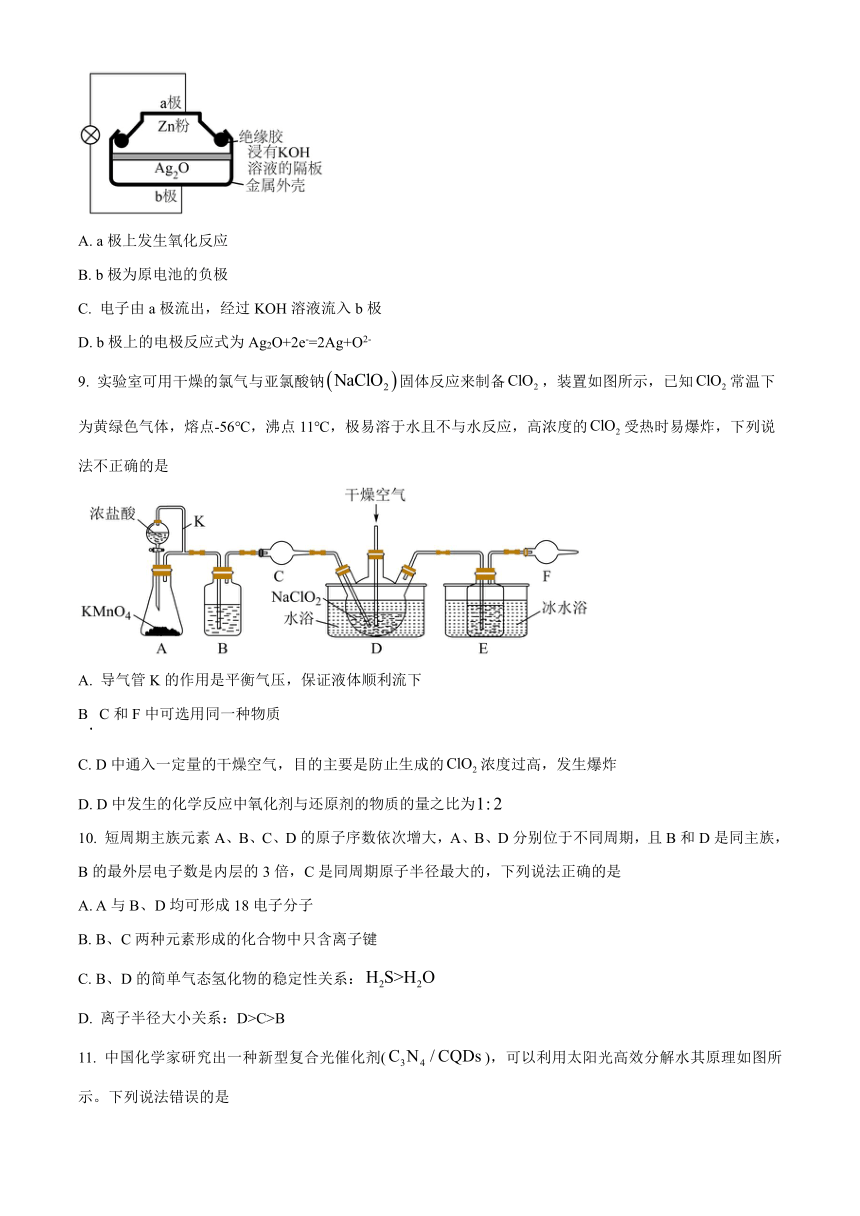
8. 锌银蓄电池具有性能稳定、体积小、质量轻等优点,其结构如图所示。工作时发生反应:
Ag2O+Zn=2Ag+ZnO。下列说法正确的是
A. a极上发生氧化反应
B. b极为原电池的负极
C. 电子由 a极流出,经过 KOH溶液流入 b极
D. b极上的电极反应式为 Ag2O+2e-=2Ag+O2-
9. 实验室可用干燥的氯气与亚氯酸钠 NaClO2 固体反应来制备ClO2 ,装置如图所示,已知ClO2 常温下
为黄绿色气体,熔点-56℃,沸点 11℃,极易溶于水且不与水反应,高浓度的ClO2 受热时易爆炸,下列说
法不正确的是
A. 导气管 K的作用是平衡气压,保证液体顺利流下
B. C和 F中可选用同一种物质
C. D中通入一定量的干燥空气,目的主要是防止生成的ClO2 浓度过高,发生爆炸
D. D中发生的化学反应中氧化剂与还原剂的物质的量之比为1: 2
10. 短周期主族元素 A、B、C、D的原子序数依次增大,A、B、D分别位于不同周期,且 B和 D是同主族,
B的最外层电子数是内层的 3倍,C是同周期原子半径最大的,下列说法正确的是
A. A与 B、D均可形成 18电子分子
B. B、C两种元素形成的化合物中只含离子键
C. B、D的简单气态氢化物的稳定性关系:H2S>H2O
D. 离子半径大小关系:D>C>B
11. 中国化学家研究出一种新型复合光催化剂(C3N4 / CQDs ),可以利用太阳光高效分解水其原理如图所
示。下列说法错误的是
A. 反应Ⅰ是放热反应
B. 反应Ⅰ涉及极性键的断裂与非极性键的形成
C. H2O2 是中间产物,CQDs能催化其分解
D. 整个过程实现了太阳能向化学能转化
12. 恒温恒容下,向密闭容器中按投料比 n(CO2):n(H2)=1:1通入气体,发生反应
CO2 g +3H2 g CH3OH g +H2O g ,下列能判断反应处于平衡状态的是
A. v逆 CO2 =3v正 H2
B. CO2浓度不再改变
C. 体系内气体密度保持不变
D. 断裂 3molH-H键的同时生成 3molH-O键
13. 从中药茯苓中提取的茯苓新酸 DM,其结构简式如图所示。下列有关茯苓新酸 DM的说法错误的是
A. 可使酸性 KMnO4溶液褪色
B. 可与足量金属钠反应产生 1.5molH2
C. 分子中含有 4种官能团
D. 可发生取代反应和加成反应
14. 海洋中蕴藏着大量的化学资源,海水的综合利用示意图如下,下列有关说法正确的是
A. 海水提溴工艺中“吹出”和“吸收”两个步骤的目的是富集溴
B. 工业电解饱和食盐水制备金属钠与氯气
C. 向海水中先通入NH3,再通入CO2来制备纯碱
D. 利用高分子反渗透膜可将海水淡化,但是用传统的蒸馏法淡化更加节能
二、非选择题(本题共 4个小题,共 58分)
15. 某科学小组为研究不同价态含硫物质的转化设计了如图实验,请回答有关问题。
(1)装置 A中发生反应的化学方程式为___________,该反应体现了浓硫酸的___________性。
a.酸性 b.脱水性 c.吸水性 d.强氧化性
(2)B处实验现象是___________,它的离子方程式是___________。
(3)C处观察到蘸有Na 2S溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是
___________。
(4)工业制硫酸过程中,常用 98.3%的浓硫酸来吸收SO3,其原因是___________。
16. 硅单质及其化合物应用广泛。请回答下列问题:
(1)硅元素在元素周期表的位置是___________,它的氧化物属于___________氧化物。
a.酸性 b.碱性 c.中性
(2)硅单质可作为硅半导体材料。三氯甲硅烷(SiHCl3 )还原法是当前制备高纯硅的主要方法,生产过程如
图:
写出步骤①涉及的化学方程式:___________,该生产过程中可以循环使用的物质是___________。
(3)新型陶瓷材料氮化硅(Si3N4 )可应用于原子反应堆,一种制备氮化硅的反应如下:
高温
3SiO2+6C+2N2 Si3N4+6CO,若消耗 24gC时,反应过程中转移的电子为___________mol。
(4)实验室装氢氧化钠溶液的玻璃试剂瓶,不选择玻璃塞,请用化学方程式表明原因:___________。
17. 有机化合物的组成、结构、性质及转化是学习有机化学的必备知识。
I.CH4与 Cl2混合在光照条件下发生化学反应,生成多种氯代烃。
(1)写出有机产物中具有正四面体构型的的结构式:___________,其主要形成的化学键是___________(极
性共价键/非极性共价键)。
(2)写出反应生成CH3Cl的化学方程式:___________,其反应类型是___________(取代反应/加成反应)。
(3)CH4与 Cl2反应生成 CH3Cl的反应过程、中间态物质的能量关系如图所示(Cl 、 CH3 表示带有单电子的
原子或原子团)。
①Cl 是由(Cl2在光照下化学键断裂生成的,该过程___________(填“放出”或“吸收”)能量。
②该反应过程可能会生成一种副产物烃,该烃的结构简式为___________。
Ⅱ 催化剂.酸和醇反应是合成酯的一种重要方法,例如:CH3COOH+C2H5OH CH3COOC H +H O,丙烯△ 2 5 2
酸乙酯(CH2=CHCOOC2H5 )是一种食品用合成香料。以石油化工产品乙烯、丙烯等为原料合成该化合物
的路线如下:
回答下列问题:
(4)乙烯和丙烯互为___________。
(5)丙烯酸乙酯分子中的官能团名称为___________。
(6)有机物 X的结构简式为___________。
(7)丙烯酸乙酯有两种官能团,它能发生的化学反应类型为___________ (填标号)。
a.加成反应 b.水解反应 c.置换反应
18. 回答下列问题。
(1)恒温下,在体积为 1密闭容器中充入 3molCO2(g)和 9molH2(g),发生反应
2CO2 g +6H2 g CH3OCH3 g +3H2O g ,测得 CO2(g)、CH3OCH3 (g)的物质的量随时间变化如图
所示。
①a点的正反应速率___________(填>、<或=)b点的逆反应速率。
②反应达到平衡状态时,此时的压强与起始的压强之比为___________。
③上述反应体系达到平衡状态的判断依据是___________。
A.容器内 CO2和 H2的物质的量之比不变
B.体系压强不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
(2)工业上合成氨气时需使用催化剂降低能耗,我国科学家提出使用M-LiH复合催化剂。相同条件下,不
同催化剂的催化效果如图 1所示,氨气的产率随时间变化如图 2所示,350℃用 Cr-LiH 作催化剂对应的曲
线是___________(填“a”、“b”或“c”)
(3)已知:25℃、101kPa时,
①Mn s +O2 g =MnO2 s ΔH 520kJ/mol
②S s +O2 g =SO2 g ΔH 297 kJ/mol
③Mn s +S s +2O2 g =MnSO4 s ΔH 1065 kJ/mol
则MnO2 s +SO2 g =MnSO4 s ΔH ___________
(4)“乙醇燃料电池”的工作原理为C2H5OH+3O2 2CO2+3H2O ,装置如图所示:
参考答案
1. C 2. A 3. B 4. C 5. B
6. A 7. A 8. A 9. B 10. A
11. A 12. B 13. B 14. A
Δ
15. (1)①. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②. ad
(2)①. 蘸有酸性高锰酸钾溶液的棉花紫色褪去 ②. 5SO2+2MnO -4 +2H2O=5SO
2- 2+
4 +2Mn +4H+
(3)SO2中硫元素由+4降低为 0,Na2S中硫元素由—2升高为 0
(4)用水或稀硫酸作吸收剂时容易形成酸雾,吸收速度慢,不利于吸收 SO3
16. (1)①. 第三周期ⅣA族 ②. a
高温
(2)①. SiO2+2C 2CO↑+Si ②. HCl、H2
(3)4 (4)SiO2+2NaOH= Na2SiO3+H2O
17. (1)①. ②. 极性共价键
(2)①. CH4+Cl 光照2 CH3Cl+HCl ②. 取代反应
(3)①. 吸收 ②. CH3CH3
(4)同系物
(5)碳碳双键和酯基
(6)CH2=CHCOOH
(7)ab
18. (1)①. > ②. 7∶12 ③. ABD
(2)b (3)—248kJ/mol
(4)①. A到 B ②. C2H5OH—12e—+3H2O=2CO2↑+12H+
化学试题
时量:75分钟 分值:100分
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32 Fe~56 Cu~64
一、选择题(本题共 14小题,每小题只有一个选项符合题意。每小题 3分,共 42分。)
1. 化学与生活、生产、科技、环境密不可分。下列说法错误的是
A. 重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可以观察到丁达尔效应
B. 长沙马王堆出土的“素纱禅衣”由蚕丝织成,其主要成分是蛋白质
C. 东北三省出土的金代六曲葵花婆金银盏属于硅酸盐材料
D. 安徽繁昌窑所产青白瓷是以黏土为原料高温烧结而成
2. 下列化学用语正确的是
A. 丙烷分子的球棍模型:
B. 乙醇的官能团:-COOH
C. 一氯甲烷的电子式:
D. CCl4空间填充模型:
3. 下列各种情况下,溶液中一定能大量存在的离子组是
A. 在常温pH 1 的溶液中:NH 、Fe2 4 、SO
2
3 、NO
3
B. 能使酚酞溶液变红的溶液中:Na 、Ba2 、Cl 、NO3
C. SO2 有 存在的溶液中:Na 、Mg2 、Ba2 、Br 4
D. 2 无色透明的水溶液中:K 、Fe3 、Cl 、SO4
4. 已知 NA阿伏加德罗常数的值,下列说法正确的是
A. 常温下,6.8gH2O2中的共价键数目为 0.8NA
B. 在标准状况下,1molSO3的体积为 22.4L
C. 20g质量分数为 46%的乙醇(C2H5OH )溶液中含有氧原子数为 0.8NA
D. 100mL18.4mol/L的硫酸与足量铜反应,生成的 SO2的物质的量为 0.92mol
5. 氮及其化合物的转化具有重要应用。下列说法不正确的是
A. Cu O实验室探究稀硝酸与铜反应的气态产物:HNO3 稀 NO 2 NO2
B. O H O工业制硝酸过程中的物质转化:N2 2 NO 2 HNO放电或高温 3
催化剂
C. 汽车尾气催化转化器中发生的主要反应: 2NO+2CO N2+2CO2
D. 实验室用浓氨水、生石灰制备少量氨气:NH3 H2O+CaO Ca OH +NH2 3
6. 一种利用磁铁矿(Fe3O4 )制备铁红的流程如下:
磁铁矿 稀 硫 酸 滤液A 试 剂 a,过滤 滤液B(FeSO ) N H4 HCO4 3 固体FeCO3
煅 烧 铁红
过滤 过滤
下列说法正确的是
A. 往滤液 A中滴加少量酸性KMnO4溶液,可观察到紫红色褪去
B. 可以用 KSCN溶液和氯水检验滤液 A中是否有Fe2
煅烧
C. FeCO3在空气中煅烧的反应方程式为 FeCO3 FeO CO2
D. 最终得到铁红中的 Fe 元素的质量小于原磁铁矿中的 Fe 元素的质量
7. 钠及其化合物的“价-类”二维图及部分转化关系如图所示,其中 B为钠的另一种氧化物。下列有关说法
正确的是
A. 物质 B为Na 2O,是碱性氧化物,A的物质类别为碱
B. 反应④通过加入还原剂实现转化
C. 钠放入硫酸铜溶液中可观察到红色固体析出
D. 可用澄清的石灰水鉴别Na 2CO3溶液和NaHCO3溶液
8. 锌银蓄电池具有性能稳定、体积小、质量轻等优点,其结构如图所示。工作时发生反应:
Ag2O+Zn=2Ag+ZnO。下列说法正确的是
A. a极上发生氧化反应
B. b极为原电池的负极
C. 电子由 a极流出,经过 KOH溶液流入 b极
D. b极上的电极反应式为 Ag2O+2e-=2Ag+O2-
9. 实验室可用干燥的氯气与亚氯酸钠 NaClO2 固体反应来制备ClO2 ,装置如图所示,已知ClO2 常温下
为黄绿色气体,熔点-56℃,沸点 11℃,极易溶于水且不与水反应,高浓度的ClO2 受热时易爆炸,下列说
法不正确的是
A. 导气管 K的作用是平衡气压,保证液体顺利流下
B. C和 F中可选用同一种物质
C. D中通入一定量的干燥空气,目的主要是防止生成的ClO2 浓度过高,发生爆炸
D. D中发生的化学反应中氧化剂与还原剂的物质的量之比为1: 2
10. 短周期主族元素 A、B、C、D的原子序数依次增大,A、B、D分别位于不同周期,且 B和 D是同主族,
B的最外层电子数是内层的 3倍,C是同周期原子半径最大的,下列说法正确的是
A. A与 B、D均可形成 18电子分子
B. B、C两种元素形成的化合物中只含离子键
C. B、D的简单气态氢化物的稳定性关系:H2S>H2O
D. 离子半径大小关系:D>C>B
11. 中国化学家研究出一种新型复合光催化剂(C3N4 / CQDs ),可以利用太阳光高效分解水其原理如图所
示。下列说法错误的是
A. 反应Ⅰ是放热反应
B. 反应Ⅰ涉及极性键的断裂与非极性键的形成
C. H2O2 是中间产物,CQDs能催化其分解
D. 整个过程实现了太阳能向化学能转化
12. 恒温恒容下,向密闭容器中按投料比 n(CO2):n(H2)=1:1通入气体,发生反应
CO2 g +3H2 g CH3OH g +H2O g ,下列能判断反应处于平衡状态的是
A. v逆 CO2 =3v正 H2
B. CO2浓度不再改变
C. 体系内气体密度保持不变
D. 断裂 3molH-H键的同时生成 3molH-O键
13. 从中药茯苓中提取的茯苓新酸 DM,其结构简式如图所示。下列有关茯苓新酸 DM的说法错误的是
A. 可使酸性 KMnO4溶液褪色
B. 可与足量金属钠反应产生 1.5molH2
C. 分子中含有 4种官能团
D. 可发生取代反应和加成反应
14. 海洋中蕴藏着大量的化学资源,海水的综合利用示意图如下,下列有关说法正确的是
A. 海水提溴工艺中“吹出”和“吸收”两个步骤的目的是富集溴
B. 工业电解饱和食盐水制备金属钠与氯气
C. 向海水中先通入NH3,再通入CO2来制备纯碱
D. 利用高分子反渗透膜可将海水淡化,但是用传统的蒸馏法淡化更加节能
二、非选择题(本题共 4个小题,共 58分)
15. 某科学小组为研究不同价态含硫物质的转化设计了如图实验,请回答有关问题。
(1)装置 A中发生反应的化学方程式为___________,该反应体现了浓硫酸的___________性。
a.酸性 b.脱水性 c.吸水性 d.强氧化性
(2)B处实验现象是___________,它的离子方程式是___________。
(3)C处观察到蘸有Na 2S溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是
___________。
(4)工业制硫酸过程中,常用 98.3%的浓硫酸来吸收SO3,其原因是___________。
16. 硅单质及其化合物应用广泛。请回答下列问题:
(1)硅元素在元素周期表的位置是___________,它的氧化物属于___________氧化物。
a.酸性 b.碱性 c.中性
(2)硅单质可作为硅半导体材料。三氯甲硅烷(SiHCl3 )还原法是当前制备高纯硅的主要方法,生产过程如
图:
写出步骤①涉及的化学方程式:___________,该生产过程中可以循环使用的物质是___________。
(3)新型陶瓷材料氮化硅(Si3N4 )可应用于原子反应堆,一种制备氮化硅的反应如下:
高温
3SiO2+6C+2N2 Si3N4+6CO,若消耗 24gC时,反应过程中转移的电子为___________mol。
(4)实验室装氢氧化钠溶液的玻璃试剂瓶,不选择玻璃塞,请用化学方程式表明原因:___________。
17. 有机化合物的组成、结构、性质及转化是学习有机化学的必备知识。
I.CH4与 Cl2混合在光照条件下发生化学反应,生成多种氯代烃。
(1)写出有机产物中具有正四面体构型的的结构式:___________,其主要形成的化学键是___________(极
性共价键/非极性共价键)。
(2)写出反应生成CH3Cl的化学方程式:___________,其反应类型是___________(取代反应/加成反应)。
(3)CH4与 Cl2反应生成 CH3Cl的反应过程、中间态物质的能量关系如图所示(Cl 、 CH3 表示带有单电子的
原子或原子团)。
①Cl 是由(Cl2在光照下化学键断裂生成的,该过程___________(填“放出”或“吸收”)能量。
②该反应过程可能会生成一种副产物烃,该烃的结构简式为___________。
Ⅱ 催化剂.酸和醇反应是合成酯的一种重要方法,例如:CH3COOH+C2H5OH CH3COOC H +H O,丙烯△ 2 5 2
酸乙酯(CH2=CHCOOC2H5 )是一种食品用合成香料。以石油化工产品乙烯、丙烯等为原料合成该化合物
的路线如下:
回答下列问题:
(4)乙烯和丙烯互为___________。
(5)丙烯酸乙酯分子中的官能团名称为___________。
(6)有机物 X的结构简式为___________。
(7)丙烯酸乙酯有两种官能团,它能发生的化学反应类型为___________ (填标号)。
a.加成反应 b.水解反应 c.置换反应
18. 回答下列问题。
(1)恒温下,在体积为 1密闭容器中充入 3molCO2(g)和 9molH2(g),发生反应
2CO2 g +6H2 g CH3OCH3 g +3H2O g ,测得 CO2(g)、CH3OCH3 (g)的物质的量随时间变化如图
所示。
①a点的正反应速率___________(填>、<或=)b点的逆反应速率。
②反应达到平衡状态时,此时的压强与起始的压强之比为___________。
③上述反应体系达到平衡状态的判断依据是___________。
A.容器内 CO2和 H2的物质的量之比不变
B.体系压强不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
(2)工业上合成氨气时需使用催化剂降低能耗,我国科学家提出使用M-LiH复合催化剂。相同条件下,不
同催化剂的催化效果如图 1所示,氨气的产率随时间变化如图 2所示,350℃用 Cr-LiH 作催化剂对应的曲
线是___________(填“a”、“b”或“c”)
(3)已知:25℃、101kPa时,
①Mn s +O2 g =MnO2 s ΔH 520kJ/mol
②S s +O2 g =SO2 g ΔH 297 kJ/mol
③Mn s +S s +2O2 g =MnSO4 s ΔH 1065 kJ/mol
则MnO2 s +SO2 g =MnSO4 s ΔH ___________
(4)“乙醇燃料电池”的工作原理为C2H5OH+3O2 2CO2+3H2O ,装置如图所示:
参考答案
1. C 2. A 3. B 4. C 5. B
6. A 7. A 8. A 9. B 10. A
11. A 12. B 13. B 14. A
Δ
15. (1)①. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②. ad
(2)①. 蘸有酸性高锰酸钾溶液的棉花紫色褪去 ②. 5SO2+2MnO -4 +2H2O=5SO
2- 2+
4 +2Mn +4H+
(3)SO2中硫元素由+4降低为 0,Na2S中硫元素由—2升高为 0
(4)用水或稀硫酸作吸收剂时容易形成酸雾,吸收速度慢,不利于吸收 SO3
16. (1)①. 第三周期ⅣA族 ②. a
高温
(2)①. SiO2+2C 2CO↑+Si ②. HCl、H2
(3)4 (4)SiO2+2NaOH= Na2SiO3+H2O
17. (1)①. ②. 极性共价键
(2)①. CH4+Cl 光照2 CH3Cl+HCl ②. 取代反应
(3)①. 吸收 ②. CH3CH3
(4)同系物
(5)碳碳双键和酯基
(6)CH2=CHCOOH
(7)ab
18. (1)①. > ②. 7∶12 ③. ABD
(2)b (3)—248kJ/mol
(4)①. A到 B ②. C2H5OH—12e—+3H2O=2CO2↑+12H+
同课章节目录
