湖南省长沙市雅礼中学2023-2024学年高一下学期期末考试化学试题(含答案)
文档属性
| 名称 | 湖南省长沙市雅礼中学2023-2024学年高一下学期期末考试化学试题(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 968.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-27 00:00:00 | ||
图片预览



文档简介
湖南省长沙市雅礼中学2023-2024学年高一下学期期末考试
化学试题
时量:75分钟 分值:100分
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32 Fe~56 Cu~64
一、选择题(本题共14小题,每小题只有一个选项符合题意。每小题3分,共42分。)
1. 化学与生活、生产、科技、环境密不可分。下列说法错误的是
A. 重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可以观察到丁达尔效应
B. 长沙马王堆出土的“素纱禅衣”由蚕丝织成,其主要成分是蛋白质
C. 东北三省出土的金代六曲葵花婆金银盏属于硅酸盐材料
D. 安徽繁昌窑所产青白瓷是以黏土为原料高温烧结而成
2. 下列化学用语正确的是
A. 丙烷分子的球棍模型:
B. 乙醇的官能团:-COOH
C. 一氯甲烷的电子式:
D. CCl4空间填充模型:
3. 下列各种情况下,溶液中一定能大量存在的离子组是
A. 在常温的溶液中:、、、
B. 能使酚酞溶液变红溶液中:、、、
C. 有存在的溶液中:、、、
D. 无色透明的水溶液中:、、、
4. 已知NA阿伏加德罗常数的值,下列说法正确的是
A. 常温下,6.8gH2O2中的共价键数目为0.8NA
B. 在标准状况下,1molSO3的体积为22.4L
C. 20g质量分数为46%的乙醇()溶液中含有氧原子数为0.8NA
D. 100mL18.4mol/L的硫酸与足量铜反应,生成的SO2的物质的量为0.92mol
5. 氮及其化合物的转化具有重要应用。下列说法不正确的是
A. 实验室探究稀硝酸与铜反应的气态产物:
B. 工业制硝酸过程中的物质转化:
C. 汽车尾气催化转化器中发生的主要反应:
D. 实验室用浓氨水、生石灰制备少量氨气:
6. 一种利用磁铁矿()制备铁红的流程如下:
下列说法正确的是
A. 往滤液A中滴加少量酸性溶液,可观察到紫红色褪去
B. 可以用KSCN溶液和氯水检验滤液A中是否有
C. 在空气中煅烧反应方程式为
D. 最终得到铁红中的Fe元素的质量小于原磁铁矿中的Fe元素的质量
7. 钠及其化合物的“价-类”二维图及部分转化关系如图所示,其中B为钠的另一种氧化物。下列有关说法正确的是
A. 物质B为,是碱性氧化物,A的物质类别为碱
B. 反应④通过加入还原剂实现转化
C. 钠放入硫酸铜溶液中可观察到红色固体析出
D. 可用澄清的石灰水鉴别溶液和溶液
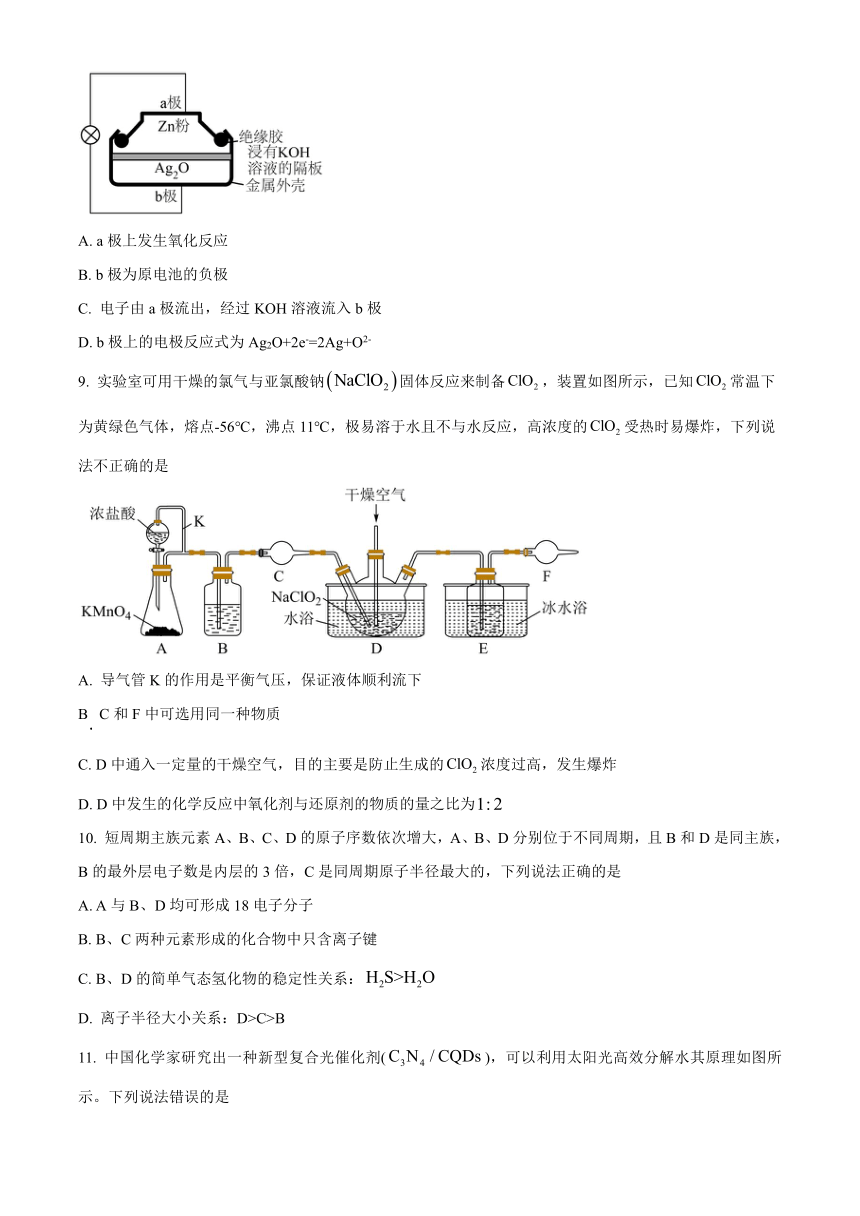
8. 锌银蓄电池具有性能稳定、体积小、质量轻等优点,其结构如图所示。工作时发生反应:Ag2O+Zn=2Ag+ZnO。下列说法正确的是
A. a极上发生氧化反应
B. b极为原电池的负极
C. 电子由a极流出,经过KOH溶液流入b极
D. b极上的电极反应式为Ag2O+2e-=2Ag+O2-
9. 实验室可用干燥的氯气与亚氯酸钠固体反应来制备,装置如图所示,已知常温下为黄绿色气体,熔点-56℃,沸点11℃,极易溶于水且不与水反应,高浓度的受热时易爆炸,下列说法不正确的是
A. 导气管K的作用是平衡气压,保证液体顺利流下
B C和F中可选用同一种物质
C. D中通入一定量的干燥空气,目的主要是防止生成的浓度过高,发生爆炸
D. D中发生的化学反应中氧化剂与还原剂的物质的量之比为
10. 短周期主族元素A、B、C、D的原子序数依次增大,A、B、D分别位于不同周期,且B和D是同主族,B的最外层电子数是内层的3倍,C是同周期原子半径最大的,下列说法正确的是
A. A与B、D均可形成18电子分子
B. B、C两种元素形成的化合物中只含离子键
C. B、D的简单气态氢化物的稳定性关系:
D. 离子半径大小关系:D>C>B
11. 中国化学家研究出一种新型复合光催化剂(),可以利用太阳光高效分解水其原理如图所示。下列说法错误的是
A. 反应Ⅰ是放热反应
B. 反应Ⅰ涉及极性键的断裂与非极性键的形成
C. 是中间产物,能催化其分解
D. 整个过程实现了太阳能向化学能转化
12. 恒温恒容下,向密闭容器中按投料比n(CO2):n(H2)=1:1通入气体,发生反应,下列能判断反应处于平衡状态的是
A
B. CO2浓度不再改变
C. 体系内气体密度保持不变
D. 断裂3molH-H键的同时生成3molH-O键
13. 从中药茯苓中提取的茯苓新酸DM,其结构简式如图所示。下列有关茯苓新酸DM的说法错误的是
A. 可使酸性KMnO4溶液褪色
B. 可与足量金属钠反应产生1.5molH2
C. 分子中含有4种官能团
D. 可发生取代反应和加成反应
14. 海洋中蕴藏着大量的化学资源,海水的综合利用示意图如下,下列有关说法正确的是
A. 海水提溴工艺中“吹出”和“吸收”两个步骤的目的是富集溴
B. 工业电解饱和食盐水制备金属钠与氯气
C. 向海水中先通入,再通入来制备纯碱
D. 利用高分子反渗透膜可将海水淡化,但是用传统的蒸馏法淡化更加节能
二、非选择题(本题共4个小题,共58分)
15. 某科学小组为研究不同价态含硫物质的转化设计了如图实验,请回答有关问题。
(1)装置A中发生反应的化学方程式为___________,该反应体现了浓硫酸的___________性。
a.酸性 b.脱水性 c.吸水性 d.强氧化性
(2)B处实验现象是___________,它的离子方程式是___________。
(3)C处观察到蘸有溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是___________。
(4)工业制硫酸过程中,常用98.3%的浓硫酸来吸收,其原因是___________。
16. 硅单质及其化合物应用广泛。请回答下列问题:
(1)硅元素在元素周期表位置是___________,它的氧化物属于___________氧化物。
a.酸性 b.碱性 c.中性
(2)硅单质可作为硅半导体材料。三氯甲硅烷()还原法是当前制备高纯硅的主要方法,生产过程如图:
写出步骤①涉及的化学方程式:___________,该生产过程中可以循环使用的物质是___________。
(3)新型陶瓷材料氮化硅()可应用于原子反应堆,一种制备氮化硅的反应如下:,若消耗24gC时,反应过程中转移的电子为___________mol。
(4)实验室装氢氧化钠溶液的玻璃试剂瓶,不选择玻璃塞,请用化学方程式表明原因:___________。
17. 有机化合物的组成、结构、性质及转化是学习有机化学的必备知识。
I.CH4与Cl2混合在光照条件下发生化学反应,生成多种氯代烃。
(1)写出有机产物中具有正四面体构型的的结构式:___________,其主要形成的化学键是___________(极性共价键/非极性共价键)。
(2)写出反应生成的化学方程式:___________,其反应类型是___________(取代反应/加成反应)。
(3)CH4与Cl2反应生成CH3Cl的反应过程、中间态物质的能量关系如图所示(表示带有单电子的原子或原子团)。
①是由(Cl2在光照下化学键断裂生成的,该过程___________(填“放出”或“吸收”)能量。
②该反应过程可能会生成一种副产物烃,该烃的结构简式为___________。
Ⅱ.酸和醇反应是合成酯的一种重要方法,例如:,丙烯酸乙酯()是一种食品用合成香料。以石油化工产品乙烯、丙烯等为原料合成该化合物的路线如下:
回答下列问题:
(4)乙烯和丙烯互为___________。
(5)丙烯酸乙酯分子中的官能团名称为___________。
(6)有机物X的结构简式为___________。
(7)丙烯酸乙酯有两种官能团,它能发生的化学反应类型为___________ (填标号)。
a.加成反应 b.水解反应 c.置换反应
18. 回答下列问题。
(1)恒温下,在体积为1密闭容器中充入3molCO2(g)和9molH2(g),发生反应,测得CO2(g)、(g)的物质的量随时间变化如图所示。
①a点的正反应速率___________(填>、<或=)b点的逆反应速率。
②反应达到平衡状态时,此时的压强与起始的压强之比为___________。
③上述反应体系达到平衡状态的判断依据是___________。
A.容器内CO2和H2的物质的量之比不变
B.体系压强不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
(2)工业上合成氨气时需使用催化剂降低能耗,我国科学家提出使用M-LiH复合催化剂。相同条件下,不同催化剂的催化效果如图1所示,氨气的产率随时间变化如图2所示,350℃用Cr-LiH作催化剂对应的曲线是___________(填“a”、“b”或“c”)
(3)已知:25℃、101kPa时,
①kJ/mol
②kJ/mol
③kJ/mol
则___________
(4)“乙醇燃料电池”的工作原理为,装置如图所示:
参考答案
1. C 2. A 3. B 4. C 5. B
6. A 7. A 8. A 9. B 10. A
11. A 12. B 13. B 14. A
15. (1)①. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②. ad
(2)①. 蘸有酸性高锰酸钾溶液的棉花紫色褪去 ②. 5SO2+2MnO+2H2O=5SO+2Mn2++4H+
(3)SO2中硫元素由+4降低为0,Na2S中硫元素由—2升高为0
(4)用水或稀硫酸作吸收剂时容易形成酸雾,吸收速度慢,不利于吸收SO3
16. (1)①. 第三周期ⅣA族 ②. a
(2)①. SiO2+2C 2CO↑+Si ②. HCl、H2
(3)4 (4)SiO2+2NaOH= Na2SiO3+H2O
17. (1)①. ②. 极性共价键
(2)①. CH4+Cl2CH3Cl+HCl ②. 取代反应
(3)①. 吸收 ②. CH3CH3
(4)同系物
(5)碳碳双键和酯基
(6)CH2=CHCOOH
(7)ab
18. (1)①. > ②. 7∶12 ③. ABD
(2)b (3)—248kJ/mol
(4)①. A到B ②. C2H5OH—12e—+3H2O=2CO2↑+12H+
化学试题
时量:75分钟 分值:100分
可能用到的相对原子质量:H~1 C~12 N~14 O~16 Na~23 S~32 Fe~56 Cu~64
一、选择题(本题共14小题,每小题只有一个选项符合题意。每小题3分,共42分。)
1. 化学与生活、生产、科技、环境密不可分。下列说法错误的是
A. 重庆素有雾都之称,雾是一种气溶胶,光束透过大雾可以观察到丁达尔效应
B. 长沙马王堆出土的“素纱禅衣”由蚕丝织成,其主要成分是蛋白质
C. 东北三省出土的金代六曲葵花婆金银盏属于硅酸盐材料
D. 安徽繁昌窑所产青白瓷是以黏土为原料高温烧结而成
2. 下列化学用语正确的是
A. 丙烷分子的球棍模型:
B. 乙醇的官能团:-COOH
C. 一氯甲烷的电子式:
D. CCl4空间填充模型:
3. 下列各种情况下,溶液中一定能大量存在的离子组是
A. 在常温的溶液中:、、、
B. 能使酚酞溶液变红溶液中:、、、
C. 有存在的溶液中:、、、
D. 无色透明的水溶液中:、、、
4. 已知NA阿伏加德罗常数的值,下列说法正确的是
A. 常温下,6.8gH2O2中的共价键数目为0.8NA
B. 在标准状况下,1molSO3的体积为22.4L
C. 20g质量分数为46%的乙醇()溶液中含有氧原子数为0.8NA
D. 100mL18.4mol/L的硫酸与足量铜反应,生成的SO2的物质的量为0.92mol
5. 氮及其化合物的转化具有重要应用。下列说法不正确的是
A. 实验室探究稀硝酸与铜反应的气态产物:
B. 工业制硝酸过程中的物质转化:
C. 汽车尾气催化转化器中发生的主要反应:
D. 实验室用浓氨水、生石灰制备少量氨气:
6. 一种利用磁铁矿()制备铁红的流程如下:
下列说法正确的是
A. 往滤液A中滴加少量酸性溶液,可观察到紫红色褪去
B. 可以用KSCN溶液和氯水检验滤液A中是否有
C. 在空气中煅烧反应方程式为
D. 最终得到铁红中的Fe元素的质量小于原磁铁矿中的Fe元素的质量
7. 钠及其化合物的“价-类”二维图及部分转化关系如图所示,其中B为钠的另一种氧化物。下列有关说法正确的是
A. 物质B为,是碱性氧化物,A的物质类别为碱
B. 反应④通过加入还原剂实现转化
C. 钠放入硫酸铜溶液中可观察到红色固体析出
D. 可用澄清的石灰水鉴别溶液和溶液
8. 锌银蓄电池具有性能稳定、体积小、质量轻等优点,其结构如图所示。工作时发生反应:Ag2O+Zn=2Ag+ZnO。下列说法正确的是
A. a极上发生氧化反应
B. b极为原电池的负极
C. 电子由a极流出,经过KOH溶液流入b极
D. b极上的电极反应式为Ag2O+2e-=2Ag+O2-
9. 实验室可用干燥的氯气与亚氯酸钠固体反应来制备,装置如图所示,已知常温下为黄绿色气体,熔点-56℃,沸点11℃,极易溶于水且不与水反应,高浓度的受热时易爆炸,下列说法不正确的是
A. 导气管K的作用是平衡气压,保证液体顺利流下
B C和F中可选用同一种物质
C. D中通入一定量的干燥空气,目的主要是防止生成的浓度过高,发生爆炸
D. D中发生的化学反应中氧化剂与还原剂的物质的量之比为
10. 短周期主族元素A、B、C、D的原子序数依次增大,A、B、D分别位于不同周期,且B和D是同主族,B的最外层电子数是内层的3倍,C是同周期原子半径最大的,下列说法正确的是
A. A与B、D均可形成18电子分子
B. B、C两种元素形成的化合物中只含离子键
C. B、D的简单气态氢化物的稳定性关系:
D. 离子半径大小关系:D>C>B
11. 中国化学家研究出一种新型复合光催化剂(),可以利用太阳光高效分解水其原理如图所示。下列说法错误的是
A. 反应Ⅰ是放热反应
B. 反应Ⅰ涉及极性键的断裂与非极性键的形成
C. 是中间产物,能催化其分解
D. 整个过程实现了太阳能向化学能转化
12. 恒温恒容下,向密闭容器中按投料比n(CO2):n(H2)=1:1通入气体,发生反应,下列能判断反应处于平衡状态的是
A
B. CO2浓度不再改变
C. 体系内气体密度保持不变
D. 断裂3molH-H键的同时生成3molH-O键
13. 从中药茯苓中提取的茯苓新酸DM,其结构简式如图所示。下列有关茯苓新酸DM的说法错误的是
A. 可使酸性KMnO4溶液褪色
B. 可与足量金属钠反应产生1.5molH2
C. 分子中含有4种官能团
D. 可发生取代反应和加成反应
14. 海洋中蕴藏着大量的化学资源,海水的综合利用示意图如下,下列有关说法正确的是
A. 海水提溴工艺中“吹出”和“吸收”两个步骤的目的是富集溴
B. 工业电解饱和食盐水制备金属钠与氯气
C. 向海水中先通入,再通入来制备纯碱
D. 利用高分子反渗透膜可将海水淡化,但是用传统的蒸馏法淡化更加节能
二、非选择题(本题共4个小题,共58分)
15. 某科学小组为研究不同价态含硫物质的转化设计了如图实验,请回答有关问题。
(1)装置A中发生反应的化学方程式为___________,该反应体现了浓硫酸的___________性。
a.酸性 b.脱水性 c.吸水性 d.强氧化性
(2)B处实验现象是___________,它的离子方程式是___________。
(3)C处观察到蘸有溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是___________。
(4)工业制硫酸过程中,常用98.3%的浓硫酸来吸收,其原因是___________。
16. 硅单质及其化合物应用广泛。请回答下列问题:
(1)硅元素在元素周期表位置是___________,它的氧化物属于___________氧化物。
a.酸性 b.碱性 c.中性
(2)硅单质可作为硅半导体材料。三氯甲硅烷()还原法是当前制备高纯硅的主要方法,生产过程如图:
写出步骤①涉及的化学方程式:___________,该生产过程中可以循环使用的物质是___________。
(3)新型陶瓷材料氮化硅()可应用于原子反应堆,一种制备氮化硅的反应如下:,若消耗24gC时,反应过程中转移的电子为___________mol。
(4)实验室装氢氧化钠溶液的玻璃试剂瓶,不选择玻璃塞,请用化学方程式表明原因:___________。
17. 有机化合物的组成、结构、性质及转化是学习有机化学的必备知识。
I.CH4与Cl2混合在光照条件下发生化学反应,生成多种氯代烃。
(1)写出有机产物中具有正四面体构型的的结构式:___________,其主要形成的化学键是___________(极性共价键/非极性共价键)。
(2)写出反应生成的化学方程式:___________,其反应类型是___________(取代反应/加成反应)。
(3)CH4与Cl2反应生成CH3Cl的反应过程、中间态物质的能量关系如图所示(表示带有单电子的原子或原子团)。
①是由(Cl2在光照下化学键断裂生成的,该过程___________(填“放出”或“吸收”)能量。
②该反应过程可能会生成一种副产物烃,该烃的结构简式为___________。
Ⅱ.酸和醇反应是合成酯的一种重要方法,例如:,丙烯酸乙酯()是一种食品用合成香料。以石油化工产品乙烯、丙烯等为原料合成该化合物的路线如下:
回答下列问题:
(4)乙烯和丙烯互为___________。
(5)丙烯酸乙酯分子中的官能团名称为___________。
(6)有机物X的结构简式为___________。
(7)丙烯酸乙酯有两种官能团,它能发生的化学反应类型为___________ (填标号)。
a.加成反应 b.水解反应 c.置换反应
18. 回答下列问题。
(1)恒温下,在体积为1密闭容器中充入3molCO2(g)和9molH2(g),发生反应,测得CO2(g)、(g)的物质的量随时间变化如图所示。
①a点的正反应速率___________(填>、<或=)b点的逆反应速率。
②反应达到平衡状态时,此时的压强与起始的压强之比为___________。
③上述反应体系达到平衡状态的判断依据是___________。
A.容器内CO2和H2的物质的量之比不变
B.体系压强不变
C.容器内气体的密度不变
D.容器内气体的平均相对分子质量不变
(2)工业上合成氨气时需使用催化剂降低能耗,我国科学家提出使用M-LiH复合催化剂。相同条件下,不同催化剂的催化效果如图1所示,氨气的产率随时间变化如图2所示,350℃用Cr-LiH作催化剂对应的曲线是___________(填“a”、“b”或“c”)
(3)已知:25℃、101kPa时,
①kJ/mol
②kJ/mol
③kJ/mol
则___________
(4)“乙醇燃料电池”的工作原理为,装置如图所示:
参考答案
1. C 2. A 3. B 4. C 5. B
6. A 7. A 8. A 9. B 10. A
11. A 12. B 13. B 14. A
15. (1)①. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②. ad
(2)①. 蘸有酸性高锰酸钾溶液的棉花紫色褪去 ②. 5SO2+2MnO+2H2O=5SO+2Mn2++4H+
(3)SO2中硫元素由+4降低为0,Na2S中硫元素由—2升高为0
(4)用水或稀硫酸作吸收剂时容易形成酸雾,吸收速度慢,不利于吸收SO3
16. (1)①. 第三周期ⅣA族 ②. a
(2)①. SiO2+2C 2CO↑+Si ②. HCl、H2
(3)4 (4)SiO2+2NaOH= Na2SiO3+H2O
17. (1)①. ②. 极性共价键
(2)①. CH4+Cl2CH3Cl+HCl ②. 取代反应
(3)①. 吸收 ②. CH3CH3
(4)同系物
(5)碳碳双键和酯基
(6)CH2=CHCOOH
(7)ab
18. (1)①. > ②. 7∶12 ③. ABD
(2)b (3)—248kJ/mol
(4)①. A到B ②. C2H5OH—12e—+3H2O=2CO2↑+12H+
同课章节目录
