共价键 高中化学人教版(2019)选择性必修二(共29张PPT)
文档属性
| 名称 | 共价键 高中化学人教版(2019)选择性必修二(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 341.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-28 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
第二章分子的结构与性质
第一节共价键
2.1.1共价键
教学目标
1、从原子轨道重叠的视角认识共价键的本质,知道共价键 具有饱和性和方向性,
2、能用模型、图像和符号等正确表征H 、Cl 、HCI等简单分 子中原子轨道的重叠方式。
3、知道σ键和π键的区别和特征,能说明C H 、C H 和 C H 等分子的成键类型。
问题反馈
1.乙烯分子中的π键是如何形成的
2.N (N=N) 原子轨道重叠过程是怎样的
共价键 原子间通过共用电子对形成的化学键。
离子键 使阴、阳离子结合成化合物的静电作用。
金属键
所有物质中都含有化学键吗
一 、化学键
1、概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用。
2、分 类 :
用电子式表示 H 的形成过程
H ·十 ·H →H:H
二、共价键
1.定义: 原子间通过共用电子对所形成的的化学键。
2. 成键微粒:一般为非金属原子 吸引电子能力相同、相近
或电负性相差不大的原子
3. 共价键的存在:
非金属单质、共价化合物、离子化合物
4. 共价键的类型:
极性键 成键原子为不同种元素
(1)
非极性键成键原子为同种元素
H—H 的s-sσ键的形成
H 个 入 H
原子轨道相互重叠,形成共价键。 1s 1s
H 中的共价键称为σ键。σ键的特征是轴对称。可以绕 轴旋 转。
H 中的σ键是由两个s轨道重叠形成的,称为 s-s σ键 。
H H H H H H
从电子云重叠角度来认识共价键
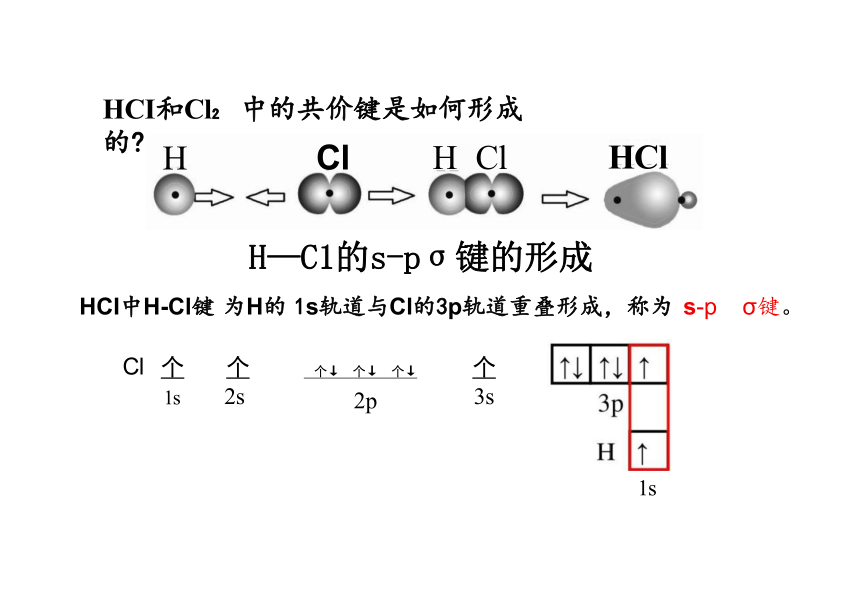
H—C1的s-pσ键的形成
HCI中H-Cl键 为H的 1s轨道与Cl的3p轨道重叠形成,称为 s-p σ键。
H Cl H Cl HCl
HCI和Cl 中的共价键是如何形成的
个↓ 个↓ 个↓
2p
个
2s
个
1s
个
3s
Cl
1s
HCI和Cl 中的共价键是如何形成的
C1 Cl C1 Cl Cl
Cl—Cl的p-pσ键的形成
Cl 中CI-Cl 键为两个Cl的未成对3p轨道重叠形成,称为 p-p σ键。
Cl 个↓ 个↓ 个↓ 个↓ 个↓ 个↓ 个↓ 个↓
1s 2s 2p 3s
3p
Cl 个↓ 个↓ 个 个↓ 个↓ 个↓
个↓ 个↓ 个
1s 2s 2p 3s
3p
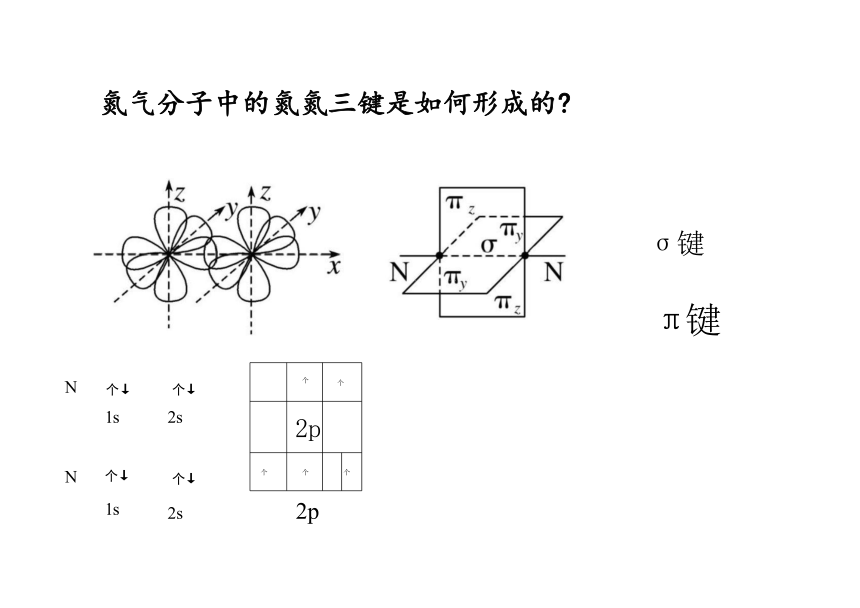
氮气分子中的氮氮三键是如何形成的
个 个
2p
个 个
个
σ键
π键
个↓
1s
个↓ 1s
2s 2p
个↓
2s
个↓
N
N
π,
πy
8..
π
N 分子形成
πy
p轨道和p轨道除能头碰头形成σ键外,还能肩并肩形成π键
p-pπ键的形成
N 中除一根p-p σ键外,还有两根p-p π键。π键的特征是镜面对称。
问题:σ键和π键哪个稳定 π键可以旋转吗
π键与σ键的强度不同。π键电子云重叠程度比σ键小,一般情况下π 键不如σ键牢固,较容易断裂。如乙烯的π键容易断裂。
H—H的s-s σ键的形成
C1 Cl Cl
Cl—Cl的p-pσ 键的形成
H Cl
H—Cl的s-pσ 键的形成
(2)π键
镜面对称
p-p π键
5.共价键的类型
(1)σ键
①s-s
②s-p ③p-p
σ键
σ键 σ键
不能旋转
可以旋转
轴对称
HCl
6.共价键的特征
自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的化
学键。
①共价键具有饱和性
一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。 H · 十 ·H—→ H:H
所以只能有H 、HCI、Cl 而不可能有H 、H CI、Cl 。
②共价键具有方向性(是不是所有的共价键都具有方向性 ) 共价键的方向性决定了共价化合物的空间构型。
7. σ键、π键的判断
①s-s 电 子 、s-p 电子只能形成σ键; p-p 电子既能形成σ键,又能 形成π键;且 p-p电子先形成σ键,后形成π键。
②共价单键是σ键;共价双键中一个σ键,另一个π键;共价三
键由一个σ键和两个π键。
H-H 1个σ键 COCl 3个σ键,1个π键 问题:π键能单独存在吗 0=0 N三N
1个σ键,1个π键
1个σ键,2个π键
键型 项目 σ 键
π 键
成键方式 “ 头碰头 ”
“ 肩并肩 ”
特 征 轴对称
镜面对称
牢固程度 重叠程度大 不容易断裂
重叠程度较小
容易断裂
成键规律 共价单键是σ 键 共价双键一个是σ 键,另一个是π 键 共价三键一个是σ键,另两个为π 键
试判断下列物质中成键情况。
N 、0 、HCI 、F 、NH 、C H 、C H 、C H 、C H
σ键
π 键
单键 双键 叁键
乙 烷 乙烯 乙 炔
·①乙烷中含有1个C-C键和6个C-H 键,所以乙烷中含有7个σ键;
·②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键; ·③乙炔中含有1个C=C键和2个C-H键.即含有3个σ键和2个π键:
· 【问题和预测】(1)观察乙烷、乙烯和乙炔的分子结构,它们
的分子中的共价键分别由几个σ键和几个π键构成
· (2)解释乙烯分子中π键是如何形成的
·预测乙炔分子中π键是如何形成的 乙烯 乙炔
·乙烯分子:每个碳原子s 轨道、2个p 轨道 (sp 杂化轨道)分别与2个氢 原子、另一个碳原子形成3个σ键,共5个σ键;每个碳原子p轨道均有 一个未成对电子,两个p轨道以“肩并肩”相互重叠,形成π键。
·乙炔分子:每个碳原子s轨道、1个p轨道 (sp 杂化轨道)分别与1个氢 原子、另一个碳原子形成2个σ键,共3个σ键;碳原子中另外两个p轨 道与碳原子中的两个p轨道以“肩并肩”相互重叠,形成两个π键。
· 【绘制图示】模仿图2-3所示,绘制乙炔分子中π键。 (提示:
两个碳原子各自用2个p轨道形成π键。)
元素 Na CI H CI
C 0
电负性 0.9 3.0 2.1 3.0
2.5 3.5
电负性之差 (绝对值) 2.1 0.9
1.0
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共 用,形成的将是离子 键;而共价 键是电负性相差不大的原子之间 形成的化学键。
· 【问题与讨论】钠和氯通过得失电子同样是形成电子对,为什么
这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗
苯分子中的σ键 苯分子中碳原子的2p 轨道 苯分子中的π键
图2-2-9苯分子中的化学键
1、下列说法正确的是 ( B )
A、有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物 D、只有非金属原子间才能形成共价键
2、关于乙醇分子的说法正确的是 ( c ) A、分子中共含有8个极性键
B、分子中不含非极性键
C、分子中只含σ键
D、分子中含有1个π键
某有机物的结构式如下:
H H
C=C
H C
C
H
则分子中有 个σ键, 3 个π键。
4、下列分子中含有非极性键的共价化合物是 ( B )
A、F B、C H C、Na O D、NH
5、相距很远的两个H原子相互逐渐接近,在这一过程中体系能量将
A、先变大后变小 B、先变小后变大
C、逐渐变小 D、逐渐增大
( B )
6、下列微粒中的各原子均满足8电子稳定结构的是( C )
A.PCI B.NH C CO D.BF
7. 下列说法正确的是( c )。
A. π键是由两个p轨道“头碰头”重叠形成的
B. σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称 的
C.一般σ键比π键重叠程度大,形成的共价键强
D.气体单质中, 一定有σ键,可能有π键
·8.已知碳的氧化物可以制备尿素、乙烯脲等,其中乙烯脲可用于
制备树脂、增塑剂、喷漆、胶黏剂等。
· (1)乙烯脲分子中含σ键与π键的数目之比
·(2)尿素分子中含σ键与π键的数目之比为
HN
0
NH
乙烯脲
尿素
·9.P 元素的价电子排布为3s 3p ,P 与Cl形成的化合物有PCl 、
PCI , 对此判断正确的是( )
·A. 磷原子最外层有三个未成对电子,故只能结合三个氯原子形 成PCI
·B.PCI 分子中的P—Cl键含有π键
·C.PCI 分子中的P—Cl键都是π键
·D.磷原子最外层有三个未成对电子,但是能形成PCI , 说明传 统的价键理论存在缺陷
·10..二氯化二硫 (S Cl ) 是广泛用于橡胶工业的硫化剂,其分
子结构如图所示。常温下 S Cl 是种橙黄色的液体,遇水易水解, 并产生能使品红褪色的气体。下列说法错误的是(C )。
·A. 电负性: CI>S
·B.S Cl 为含有极性键和非极性键的分子
·C.S Br S Cl 结构相似,都含有σ键和π
·D.S Cl 与 H O反应的化学方程式可能为
·2S Cl +2H O=SO 个 + 3S↓+4HCI
小结
1.概念
本质:共用电子对,原子轨道重叠
2.类型
σ键轴对称 可以旋转
π键镜面对称 不能旋转
3.特征
①饱和性②方向性
第二章分子的结构与性质
第一节共价键
2.1.1共价键
教学目标
1、从原子轨道重叠的视角认识共价键的本质,知道共价键 具有饱和性和方向性,
2、能用模型、图像和符号等正确表征H 、Cl 、HCI等简单分 子中原子轨道的重叠方式。
3、知道σ键和π键的区别和特征,能说明C H 、C H 和 C H 等分子的成键类型。
问题反馈
1.乙烯分子中的π键是如何形成的
2.N (N=N) 原子轨道重叠过程是怎样的
共价键 原子间通过共用电子对形成的化学键。
离子键 使阴、阳离子结合成化合物的静电作用。
金属键
所有物质中都含有化学键吗
一 、化学键
1、概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用。
2、分 类 :
用电子式表示 H 的形成过程
H ·十 ·H →H:H
二、共价键
1.定义: 原子间通过共用电子对所形成的的化学键。
2. 成键微粒:一般为非金属原子 吸引电子能力相同、相近
或电负性相差不大的原子
3. 共价键的存在:
非金属单质、共价化合物、离子化合物
4. 共价键的类型:
极性键 成键原子为不同种元素
(1)
非极性键成键原子为同种元素
H—H 的s-sσ键的形成
H 个 入 H
原子轨道相互重叠,形成共价键。 1s 1s
H 中的共价键称为σ键。σ键的特征是轴对称。可以绕 轴旋 转。
H 中的σ键是由两个s轨道重叠形成的,称为 s-s σ键 。
H H H H H H
从电子云重叠角度来认识共价键
H—C1的s-pσ键的形成
HCI中H-Cl键 为H的 1s轨道与Cl的3p轨道重叠形成,称为 s-p σ键。
H Cl H Cl HCl
HCI和Cl 中的共价键是如何形成的
个↓ 个↓ 个↓
2p
个
2s
个
1s
个
3s
Cl
1s
HCI和Cl 中的共价键是如何形成的
C1 Cl C1 Cl Cl
Cl—Cl的p-pσ键的形成
Cl 中CI-Cl 键为两个Cl的未成对3p轨道重叠形成,称为 p-p σ键。
Cl 个↓ 个↓ 个↓ 个↓ 个↓ 个↓ 个↓ 个↓
1s 2s 2p 3s
3p
Cl 个↓ 个↓ 个 个↓ 个↓ 个↓
个↓ 个↓ 个
1s 2s 2p 3s
3p
氮气分子中的氮氮三键是如何形成的
个 个
2p
个 个
个
σ键
π键
个↓
1s
个↓ 1s
2s 2p
个↓
2s
个↓
N
N
π,
πy
8..
π
N 分子形成
πy
p轨道和p轨道除能头碰头形成σ键外,还能肩并肩形成π键
p-pπ键的形成
N 中除一根p-p σ键外,还有两根p-p π键。π键的特征是镜面对称。
问题:σ键和π键哪个稳定 π键可以旋转吗
π键与σ键的强度不同。π键电子云重叠程度比σ键小,一般情况下π 键不如σ键牢固,较容易断裂。如乙烯的π键容易断裂。
H—H的s-s σ键的形成
C1 Cl Cl
H Cl
H—Cl的s-pσ 键的形成
(2)π键
镜面对称
p-p π键
5.共价键的类型
(1)σ键
①s-s
②s-p ③p-p
σ键
σ键 σ键
不能旋转
可以旋转
轴对称
HCl
6.共价键的特征
自旋相反的成单电子相互接近时,核间电子密度较大,可形成稳定的化
学键。
①共价键具有饱和性
一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。 H · 十 ·H—→ H:H
所以只能有H 、HCI、Cl 而不可能有H 、H CI、Cl 。
②共价键具有方向性(是不是所有的共价键都具有方向性 ) 共价键的方向性决定了共价化合物的空间构型。
7. σ键、π键的判断
①s-s 电 子 、s-p 电子只能形成σ键; p-p 电子既能形成σ键,又能 形成π键;且 p-p电子先形成σ键,后形成π键。
②共价单键是σ键;共价双键中一个σ键,另一个π键;共价三
键由一个σ键和两个π键。
H-H 1个σ键 COCl 3个σ键,1个π键 问题:π键能单独存在吗 0=0 N三N
1个σ键,1个π键
1个σ键,2个π键
键型 项目 σ 键
π 键
成键方式 “ 头碰头 ”
“ 肩并肩 ”
特 征 轴对称
镜面对称
牢固程度 重叠程度大 不容易断裂
重叠程度较小
容易断裂
成键规律 共价单键是σ 键 共价双键一个是σ 键,另一个是π 键 共价三键一个是σ键,另两个为π 键
试判断下列物质中成键情况。
N 、0 、HCI 、F 、NH 、C H 、C H 、C H 、C H
σ键
π 键
单键 双键 叁键
乙 烷 乙烯 乙 炔
·①乙烷中含有1个C-C键和6个C-H 键,所以乙烷中含有7个σ键;
·②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键; ·③乙炔中含有1个C=C键和2个C-H键.即含有3个σ键和2个π键:
· 【问题和预测】(1)观察乙烷、乙烯和乙炔的分子结构,它们
的分子中的共价键分别由几个σ键和几个π键构成
· (2)解释乙烯分子中π键是如何形成的
·预测乙炔分子中π键是如何形成的 乙烯 乙炔
·乙烯分子:每个碳原子s 轨道、2个p 轨道 (sp 杂化轨道)分别与2个氢 原子、另一个碳原子形成3个σ键,共5个σ键;每个碳原子p轨道均有 一个未成对电子,两个p轨道以“肩并肩”相互重叠,形成π键。
·乙炔分子:每个碳原子s轨道、1个p轨道 (sp 杂化轨道)分别与1个氢 原子、另一个碳原子形成2个σ键,共3个σ键;碳原子中另外两个p轨 道与碳原子中的两个p轨道以“肩并肩”相互重叠,形成两个π键。
· 【绘制图示】模仿图2-3所示,绘制乙炔分子中π键。 (提示:
两个碳原子各自用2个p轨道形成π键。)
元素 Na CI H CI
C 0
电负性 0.9 3.0 2.1 3.0
2.5 3.5
电负性之差 (绝对值) 2.1 0.9
1.0
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共 用,形成的将是离子 键;而共价 键是电负性相差不大的原子之间 形成的化学键。
· 【问题与讨论】钠和氯通过得失电子同样是形成电子对,为什么
这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗
苯分子中的σ键 苯分子中碳原子的2p 轨道 苯分子中的π键
图2-2-9苯分子中的化学键
1、下列说法正确的是 ( B )
A、有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、由共价键形成的分子一定是共价化合物 D、只有非金属原子间才能形成共价键
2、关于乙醇分子的说法正确的是 ( c ) A、分子中共含有8个极性键
B、分子中不含非极性键
C、分子中只含σ键
D、分子中含有1个π键
某有机物的结构式如下:
H H
C=C
H C
C
H
则分子中有 个σ键, 3 个π键。
4、下列分子中含有非极性键的共价化合物是 ( B )
A、F B、C H C、Na O D、NH
5、相距很远的两个H原子相互逐渐接近,在这一过程中体系能量将
A、先变大后变小 B、先变小后变大
C、逐渐变小 D、逐渐增大
( B )
6、下列微粒中的各原子均满足8电子稳定结构的是( C )
A.PCI B.NH C CO D.BF
7. 下列说法正确的是( c )。
A. π键是由两个p轨道“头碰头”重叠形成的
B. σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称 的
C.一般σ键比π键重叠程度大,形成的共价键强
D.气体单质中, 一定有σ键,可能有π键
·8.已知碳的氧化物可以制备尿素、乙烯脲等,其中乙烯脲可用于
制备树脂、增塑剂、喷漆、胶黏剂等。
· (1)乙烯脲分子中含σ键与π键的数目之比
·(2)尿素分子中含σ键与π键的数目之比为
HN
0
NH
乙烯脲
尿素
·9.P 元素的价电子排布为3s 3p ,P 与Cl形成的化合物有PCl 、
PCI , 对此判断正确的是( )
·A. 磷原子最外层有三个未成对电子,故只能结合三个氯原子形 成PCI
·B.PCI 分子中的P—Cl键含有π键
·C.PCI 分子中的P—Cl键都是π键
·D.磷原子最外层有三个未成对电子,但是能形成PCI , 说明传 统的价键理论存在缺陷
·10..二氯化二硫 (S Cl ) 是广泛用于橡胶工业的硫化剂,其分
子结构如图所示。常温下 S Cl 是种橙黄色的液体,遇水易水解, 并产生能使品红褪色的气体。下列说法错误的是(C )。
·A. 电负性: CI>S
·B.S Cl 为含有极性键和非极性键的分子
·C.S Br S Cl 结构相似,都含有σ键和π
·D.S Cl 与 H O反应的化学方程式可能为
·2S Cl +2H O=SO 个 + 3S↓+4HCI
小结
1.概念
本质:共用电子对,原子轨道重叠
2.类型
σ键轴对称 可以旋转
π键镜面对称 不能旋转
3.特征
①饱和性②方向性
