5.2.2氨(教学课件)高中化学人教版(2019)必修二(共13张PPT)
文档属性
| 名称 | 5.2.2氨(教学课件)高中化学人教版(2019)必修二(共13张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-28 20:51:51 | ||
图片预览




文档简介
(共13张PPT)
第五章化工生产中的重要非金属元素
第二节氮及其化合物
(第二课时)氨
学习目标
1. 了解氨气与水、与酸或氧气反应 等化学性质;
2.知道氨的催化氧化反应是工业上 制取硝酸的基础,
颜色、状态 气味 密度 特性
溶解性
无色体 刺激性 气味 小于 空气 易液化 (-33.5℃)
极易容于水,1体积水
能 溶 解 体积 的氨
气
氨气易液化,液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷
一、氨气的物理性质
(液氨用在电冰箱中作制冷剂)
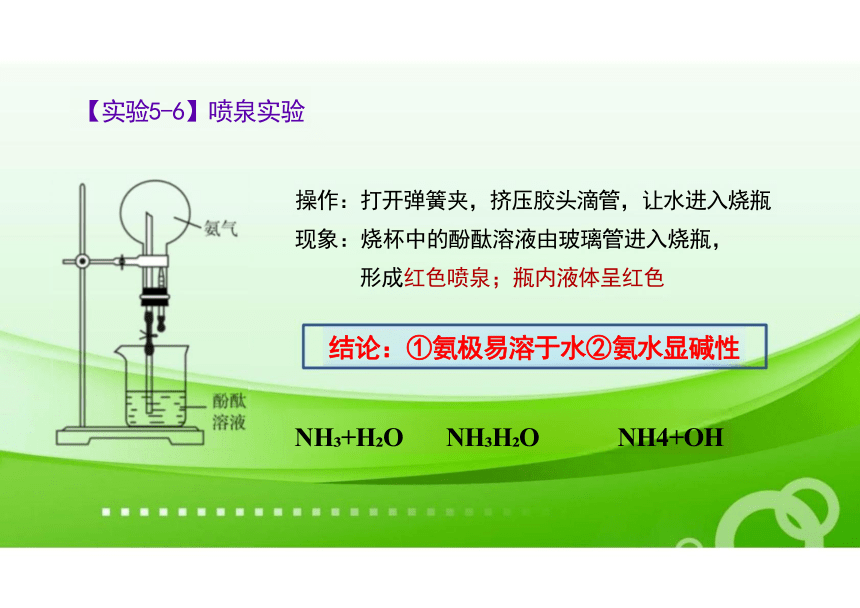
操作:打开弹簧夹,挤压胶头滴管,让水进入烧瓶
现象:烧杯中的酚酞溶液由玻璃管进入烧瓶, 形成红色喷泉;瓶内液体呈红色
结论:①氨极易溶于水②氨水显碱性
NH +H O NH H O NH4+OH
【实验5-6】喷泉实验
挤压胶头滴管,滴管里少量的水进入烧瓶,氨几乎全部溶于水中,使烧瓶内压
强急剧减小,烧瓶内外形成较大压强差;大气压将水压入烧瓶,形成喷泉;
由于NH 溶于水的溶液呈碱性,导致酚酞溶液显红色。
形成原理:容器内外产生较大的压强差
思考:烧瓶内为什么会形成喷泉 溶液为什么变成红色
【实验5-6】喷泉实验
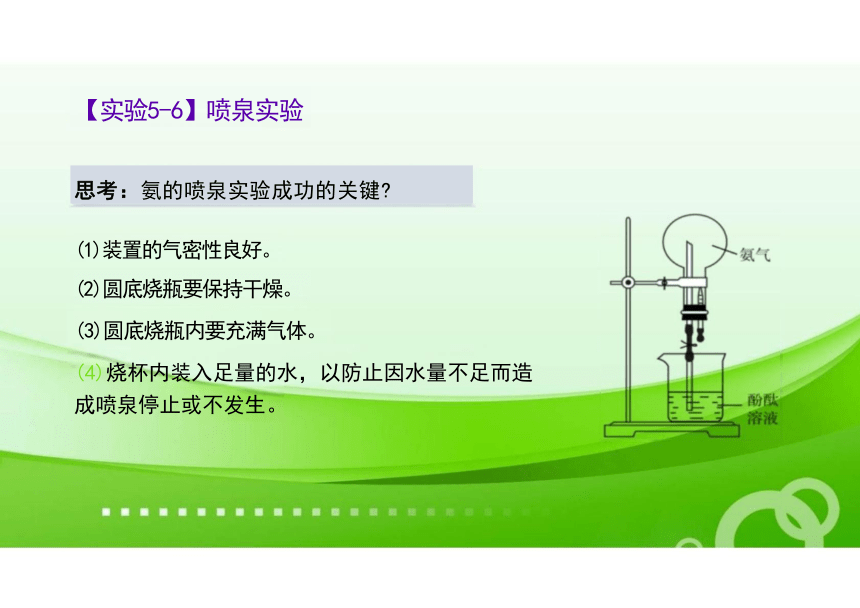
(1)装置的气密性良好。
(2)圆底烧瓶要保持干燥。
(3)圆底烧瓶内要充满气体。
(4)烧杯内装入足量的水,以防止因水量不足而造 成喷泉停止或不发生。
思考:氨的喷泉实验成功的关键
【实验5-6】喷泉实验
氨的化学性质
(1)与水反应 NH +H O= NH H O (一水合氨)
①NH H O 为可溶性一元弱碱,能使酚酞溶液变红或使红色石蕊试纸变蓝。 部分电离:NH H O NH *+OH-
实验室用过量氨水与可溶性铝盐(如AICl 溶液)反应来制备Al(OH) 。 Al ++3NH ·H O===Al(OH) ↓+3NH4
②NH H O不稳定,易分解。N N+0
(思考)氨水的主要成份有哪些 氨水与的夜态氨有间逐别
液氨 一水合氨 (NH H O)
氨水
物质 类别 纯净物 氢化物 非电解质 纯净物 一元弱碱 电解质
混合物
氨的水溶液
粒子 种类 NH NH H O
三分子:NH ·H O、NH 、H O
三离子:OH 一、H+、OH-
主要 性质 挥发时吸热, 常做制冷剂 受热易分解: NH H O=NH 个+H O
呈弱碱性,易挥
发,应密封保存
氨水成分
氨的化学性质
(2)与酸的反应
①原理:NH +HCI=NH Cl
现象:有大量白烟产生
原因:氨与氯化氢相遇迅速反应生成固体小颗粒
浓硫酸没有挥发性,浓硝酸有挥发性
挥发性酸(HCl、HNO 等)遇氨气均有白烟生成;
难挥发性酸H SO 、H PO 无此现象。
①浓氨水遇浓硫酸、浓硝酸也会产生白烟吗
NH +HNO ===NH NO
NH +CO +H O===NH HCO
氨的化学性质
(2)与酸的反应
② 氨与其他酸的反应:
管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生
白烟,原理是什么 (已知2NH +3Cl =N +6HCl)
提示:若氯气管道漏气,发生反应:
2NH +3Cl =N +6HCl
NH +HCl=NH Cl
产生的白烟是固体NH Cl。
检验氨气的方法:1、湿润的石蕊试纸变蓝
2、湿润的酚酞试纸变证
3、蘸有浓盐酸的玻璃棒靠近,产生自 烟 。
氨的化学性质
氨的化学性质
3、氨气的催化氧化
4NH +50 =====4NO+6H O
工业制硝酸
1.无色的混合气体甲,可能含NO、CO 、NO 、NH 、O 、N 中的几
种,将100mL 甲气体经过如图实验的处理,结果得到酸性溶液,而几 乎无气体剩余,则甲气体的组成为( B )
甲 → = 余气
80mL 足量Na O 棕色 H O
A.NH 、NO、O B.NH 、NO、CO
C.NH 、NO 、CO D.NO、CO 、N
SO
量
H
足
红
体
显
气
第五章化工生产中的重要非金属元素
第二节氮及其化合物
(第二课时)氨
学习目标
1. 了解氨气与水、与酸或氧气反应 等化学性质;
2.知道氨的催化氧化反应是工业上 制取硝酸的基础,
颜色、状态 气味 密度 特性
溶解性
无色体 刺激性 气味 小于 空气 易液化 (-33.5℃)
极易容于水,1体积水
能 溶 解 体积 的氨
气
氨气易液化,液态氨汽化时要吸收周围的热量,使周围的空气迅速变冷
一、氨气的物理性质
(液氨用在电冰箱中作制冷剂)
操作:打开弹簧夹,挤压胶头滴管,让水进入烧瓶
现象:烧杯中的酚酞溶液由玻璃管进入烧瓶, 形成红色喷泉;瓶内液体呈红色
结论:①氨极易溶于水②氨水显碱性
NH +H O NH H O NH4+OH
【实验5-6】喷泉实验
挤压胶头滴管,滴管里少量的水进入烧瓶,氨几乎全部溶于水中,使烧瓶内压
强急剧减小,烧瓶内外形成较大压强差;大气压将水压入烧瓶,形成喷泉;
由于NH 溶于水的溶液呈碱性,导致酚酞溶液显红色。
形成原理:容器内外产生较大的压强差
思考:烧瓶内为什么会形成喷泉 溶液为什么变成红色
【实验5-6】喷泉实验
(1)装置的气密性良好。
(2)圆底烧瓶要保持干燥。
(3)圆底烧瓶内要充满气体。
(4)烧杯内装入足量的水,以防止因水量不足而造 成喷泉停止或不发生。
思考:氨的喷泉实验成功的关键
【实验5-6】喷泉实验
氨的化学性质
(1)与水反应 NH +H O= NH H O (一水合氨)
①NH H O 为可溶性一元弱碱,能使酚酞溶液变红或使红色石蕊试纸变蓝。 部分电离:NH H O NH *+OH-
实验室用过量氨水与可溶性铝盐(如AICl 溶液)反应来制备Al(OH) 。 Al ++3NH ·H O===Al(OH) ↓+3NH4
②NH H O不稳定,易分解。N N+0
(思考)氨水的主要成份有哪些 氨水与的夜态氨有间逐别
液氨 一水合氨 (NH H O)
氨水
物质 类别 纯净物 氢化物 非电解质 纯净物 一元弱碱 电解质
混合物
氨的水溶液
粒子 种类 NH NH H O
三分子:NH ·H O、NH 、H O
三离子:OH 一、H+、OH-
主要 性质 挥发时吸热, 常做制冷剂 受热易分解: NH H O=NH 个+H O
呈弱碱性,易挥
发,应密封保存
氨水成分
氨的化学性质
(2)与酸的反应
①原理:NH +HCI=NH Cl
现象:有大量白烟产生
原因:氨与氯化氢相遇迅速反应生成固体小颗粒
浓硫酸没有挥发性,浓硝酸有挥发性
挥发性酸(HCl、HNO 等)遇氨气均有白烟生成;
难挥发性酸H SO 、H PO 无此现象。
①浓氨水遇浓硫酸、浓硝酸也会产生白烟吗
NH +HNO ===NH NO
NH +CO +H O===NH HCO
氨的化学性质
(2)与酸的反应
② 氨与其他酸的反应:
管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生
白烟,原理是什么 (已知2NH +3Cl =N +6HCl)
提示:若氯气管道漏气,发生反应:
2NH +3Cl =N +6HCl
NH +HCl=NH Cl
产生的白烟是固体NH Cl。
检验氨气的方法:1、湿润的石蕊试纸变蓝
2、湿润的酚酞试纸变证
3、蘸有浓盐酸的玻璃棒靠近,产生自 烟 。
氨的化学性质
氨的化学性质
3、氨气的催化氧化
4NH +50 =====4NO+6H O
工业制硝酸
1.无色的混合气体甲,可能含NO、CO 、NO 、NH 、O 、N 中的几
种,将100mL 甲气体经过如图实验的处理,结果得到酸性溶液,而几 乎无气体剩余,则甲气体的组成为( B )
甲 → = 余气
80mL 足量Na O 棕色 H O
A.NH 、NO、O B.NH 、NO、CO
C.NH 、NO 、CO D.NO、CO 、N
SO
量
H
足
红
体
显
气
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
