第三章 水溶液中的离子反应与平衡 单元检测 (含答案)高中化学人教版(2019)必修第二册
文档属性
| 名称 | 第三章 水溶液中的离子反应与平衡 单元检测 (含答案)高中化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 630.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-28 18:05:47 | ||
图片预览



文档简介
第三章 水溶液中的离子反应与平衡
2024-2025学年高二上学期化学人教版(2019)必修第二册
一、单选题
1.化学与生产、生活密切相关,下列说法正确的是( )
A.直接加热蒸干纯碱的水溶液无法得到纯碱固体
B.冬季空气中的水蒸气凝结成冰霜的过程是自发的,该过程的熵减小
C.草木灰和铵态氮肥混合施用,可促进植物对化肥的吸收和综合利用
D.工业合成氨选用的温度越低越好,压强越大越好
2.根据下表信息,判断0.10 mol/L的下列各溶液pH最大的是( )
酸 电离常数(常温下)
CH3COOH Ka=1.8×10-5
H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11
H2S Ka1=9.1×10-8,Ka2=1.1×10-12
A.CH3COONa B.Na2CO3 C.NaHCO3 D.Na2S
3.下列溶液一定呈中性的是
A.非电解质溶于水得到的溶液
B.c(H+)=c(OH-)的溶液
C.pH=7的溶液
D.由强酸、强碱等物质的量反应得到的溶液
4.下列物质中,既能导电又属于强电解质的是( )
A.熔融 B.液氨 C.硅 D.盐酸
5.常温下,下列有关pH说法正确的是(混合溶液忽略体积的变化)( )
A.0.1mol·L-1的H2SO4溶液pH为1
B.用广泛pH试纸测得某盐酸的pH=2.3
C.将pH=5的硫酸与pH=9的NaOH溶液等体积混合pH为7
D.1mLpH=8的NaOH溶液加水至100mL,pH为6
6.室温下,某浓度的H2C2O4,溶液在不同pH下,测得pc(H2C2O4)、pc(HC2O)、pc(C2O)的变化如图所示。下列说法正确的是( )
已知:pc(H2C2O4)=-lgc(H2C2O4),其它类似。
A.曲线①表示pc(C2O)随pH的变化
B.H2C2O4的pKa1=3.82
C.b点对应的pH约为2.54
D.1.25<3.82,c(H2C2O4)+c(HC2O)+c(C2O)先减小后增大
7.常温下向100mL0.2mol L-1的氨水中逐滴加入0.2mol L-1的盐酸,所得溶液的pH、溶液中和NH3 H2O的物质的量分数与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是( )
A.表示NH3 H2O物质的量分数变化的曲线是B
B.pH=9.26时溶液中,NH3 H2O的电离程度小于的水解程度
C.常温下NH3 H2O的电离常数为1.8×10-5 mol L-1 (已知lg1.8=0.26)
D.当加入盐酸体积为50mL时,溶液中c()-c(NH3 H2O)=2×(10-5+10-9)mol L-1
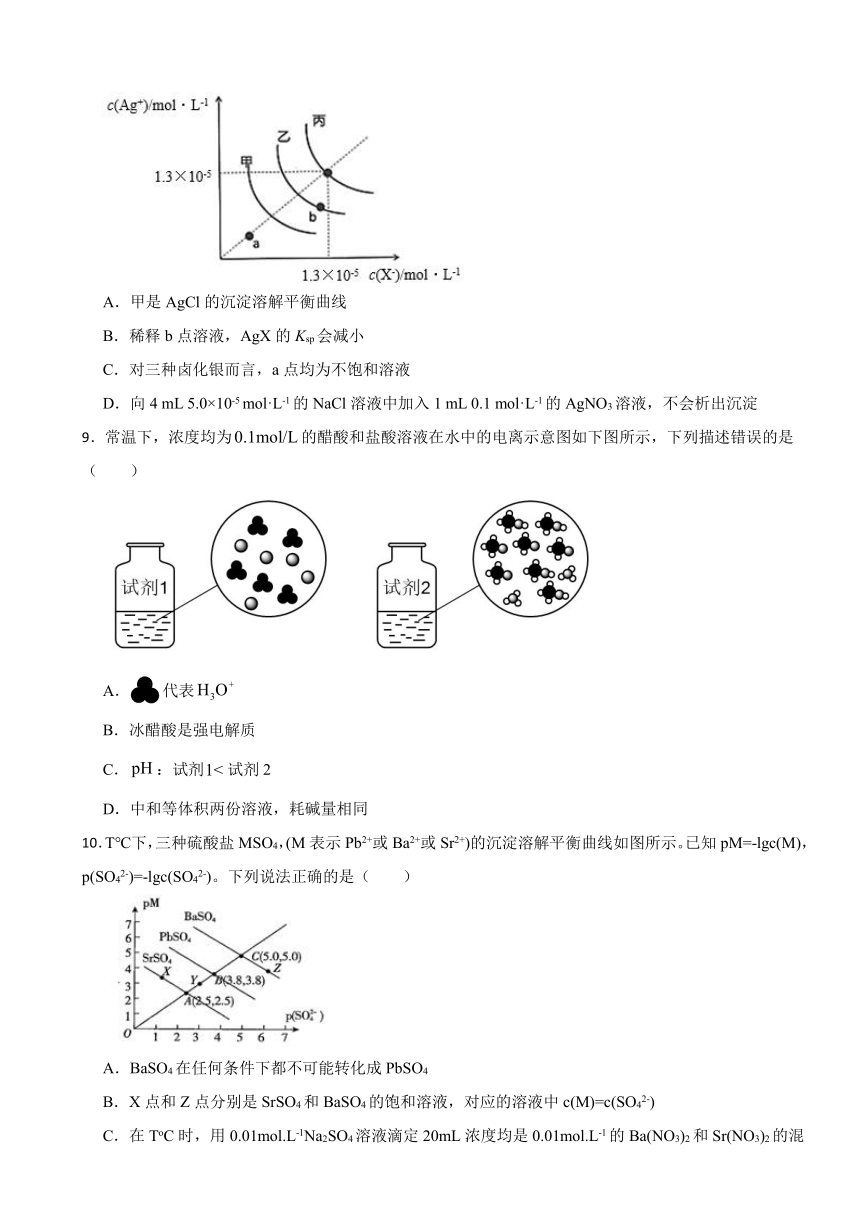
8.一定温度下,三种卤化银AgX(X=Cl、Br、I)D的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.甲是AgCl的沉淀溶解平衡曲线
B.稀释b点溶液,AgX的Ksp会减小
C.对三种卤化银而言,a点均为不饱和溶液
D.向4 mL 5.0×10-5 mol·L-1的NaCl溶液中加入1 mL 0.1 mol·L-1的AgNO3溶液,不会析出沉淀
9.常温下,浓度均为的醋酸和盐酸溶液在水中的电离示意图如下图所示,下列描述错误的是( )
A.代表
B.冰醋酸是强电解质
C.:试剂试剂2
D.中和等体积两份溶液,耗碱量相同
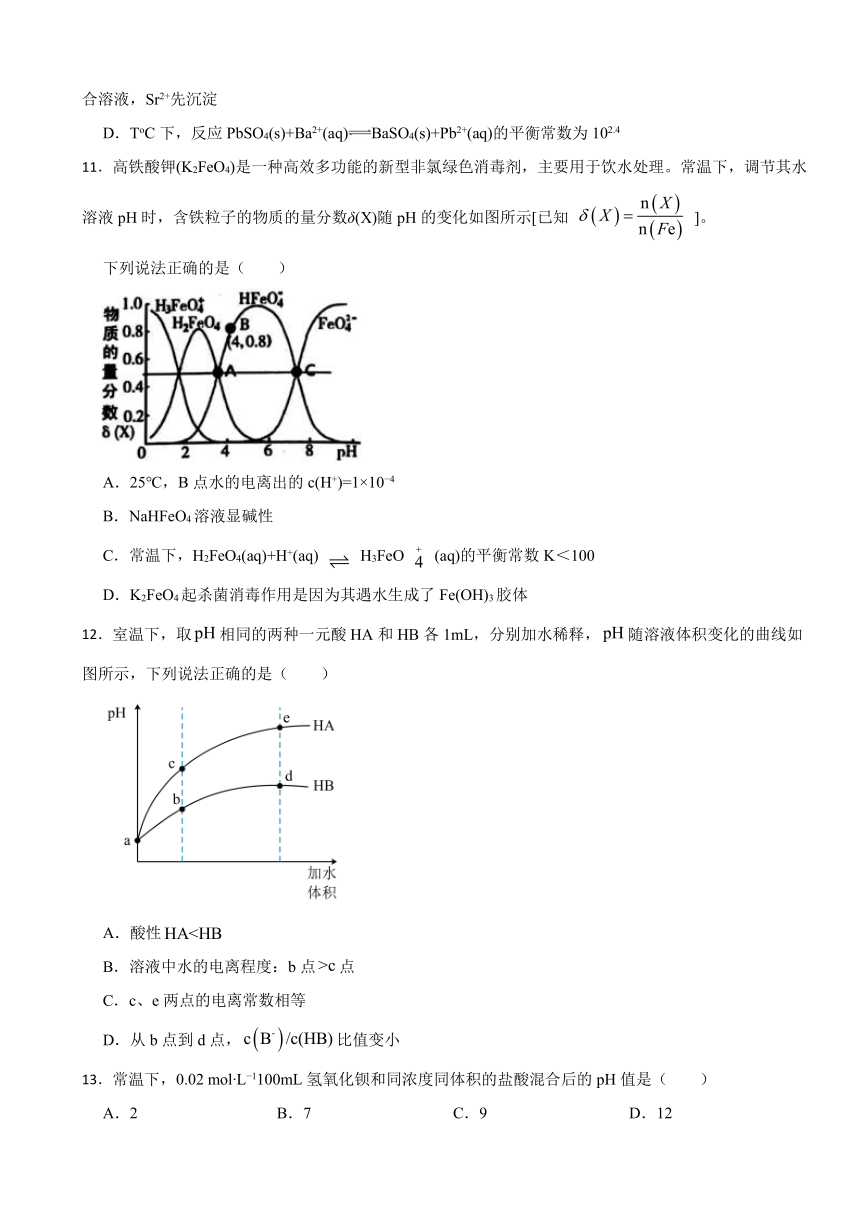
10.T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)BaSO4(s)+Pb2+(aq)的平衡常数为102.4
11.高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。常温下,调节其水溶液pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知 ]。
下列说法正确的是( )
A.25℃,B点水的电离出的c(H+)=1×10 4
B.NaHFeO4溶液显碱性
C.常温下,H2FeO4(aq)+H+(aq) H3FeO (aq)的平衡常数K<100
D.K2FeO4起杀菌消毒作用是因为其遇水生成了Fe(OH)3胶体
12.室温下,取相同的两种一元酸HA和HB各1mL,分别加水稀释,随溶液体积变化的曲线如图所示,下列说法正确的是( )
A.酸性
B.溶液中水的电离程度:b点点
C.c、e两点的电离常数相等
D.从b点到d点,比值变小
13.常温下,0.02 mol L 1100mL氢氧化钡和同浓度同体积的盐酸混合后的pH值是( )
A.2 B.7 C.9 D.12
14.某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入AgNO3可以使溶液由c点变到d点
B.加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C.d点有AgCl沉淀生成
D.a点对应的Ksp小于b点对应的Ksp
15.为阿伏加德罗常数的值,下列说法正确的是
A.6.0gSiO2晶体中含有的共价键数目为0.2NA
B.标准状况下,1.12L HF所含分子数目为0.05NA
C.25℃,1.0L pH=12的澄清石灰水中的数目为0.02NA
D.1.0L0.1mol/L的MgSO4溶液中Mg2+的数目小于0.1NA
16.常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
A.Ksp(Ag2S)=10-29.2
B.向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp (CuS)减小
C.若Z点为Ag2S的分散系,ν(沉淀)>ν(溶解)
D.CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全
17.一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示。下列说法不正确的是( )
A.加水前导电能力为零的原因是冰醋酸中不存在自由移动的离子
B.a、b、c三点对应溶液的
C.a、b、c三点对应溶液的电离程度:
D.加入少量固体,可使点增大、减小
18.下列说法正确的是( )
A.将0.585 g氯化钠固体加入到100mL水中溶解,得到的氯化钠溶液浓度为0.1 mol/L
B.向NaOH溶液中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体
C.氯化钠溶液在电流的作用下能电离产生Na+、Cl-
D.CO32-的摩尔质量为60 g/mol
19.常温下,用0.2mol·L-1NaOH溶液分别滴定相同浓度的一元酸HA溶液和HB溶液,溶液的pH随离子浓度的变化关系如图所示。已知电离常数Ka(HA) < Ka(HB),下列说法错误的是
A.曲线M代表HA溶液
B.常温下,0.1 mol·L-1NaB溶液的pH约为8.15
C.pH和体积均相同的两种酸溶液中水的电离程度:HA> HB
D.将0.1 mol·L-1 HA溶液加水稀释10倍后,溶液中保持不变
20.以下说法中正确的是( )
A.常温下pH=4的H2C2O4溶液稀释100倍,pH约为5,则H2C2O4是弱电解质
B.增大压强,活化分子百分数增大,单位时间内有效碰撞次数增多,化学反应速率加快
C.工业合成氨反应是一个熵增加的过程
D.等物质的量浓度①NaHSO4和②NaHCO3溶液中水的电离程度①>②
二、综合题
21.常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
(1)该温度时NH3·H2O的电离常数K约为 。
(2)比较b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为 。
(3)滴定时,由b点到c点的过程中,忽略溶液温度的变化,下列各选项中数值逐渐减小的是____(填字母)。
A.c(H+)·c(OH-) B.
C.c(NH)·c(OH- ) D.
(4)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为 。
(5)常温下反应NH3·H2O(aq)+H+(aq) NH (aq)+H2O(l)的平衡常数K= 。
(6)d点溶液中溶质的电子式 。
22.
(1)Ⅰ、某小组同学用下列试剂研究将转化为。(已知:,)
实验操作:所用试剂:溶液,溶液,溶液;向盛有溶液的试管中滴加2滴溶液,充分振荡后, (将操作补充完整)。
(2)实验现象:上述实验中,沉淀由白色变为 色现象可证明转化为。
(3)分析及讨论
①该沉淀转化反应的离子方程式是 。
②定量分析。由上述沉淀转化反应的化学平衡常数表达式可推导: (列式即可,不必计算结果)。
③同学们结合②中的分析方法,认为教材中的表述:“一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现”,可进一步表述为对于组成形式相同的沉淀, (填“小”或者“大”)的沉淀转化为 (填“更小”或者“更大”)的沉淀容易实现。
(4)Ⅱ、某同学设计如图实验装置研究溶液和溶液间的反应(a、b均为石墨)。
当K闭合后,发现电流计指针偏转,b极附近溶液变蓝。
①b极发生的是 (填“氧化”或“还原”)反应。
②a极上的电极反应式是 。
(5)事实证明:溶液与的溶液混合只能得到沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因是与之间发生沉淀反应比氧化还原反应的速率或限度 (填“小”或者“大”)。
23.碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2,少量Cr、FeS等)来制备,其工艺流程如下:
回答下列问题:
(1)“碱浸”时,发生反应的离子反应方程式① ,② 。
(2)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH 完全沉淀的pH
Ni2+ 6.2 8.6
Fe2+ 7.6 9.1
Fe3+ 2.3 3.3
Cr3+ 4.5 5.6
“调pH 1”时,主要除去的离子是 ,溶液pH范围 。
(3)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式 。
(4)在酸性溶液中CrO 可以转化成Cr2O ,用离子方程式表示该转化反应 ,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO 沉淀完全(c(CrO )≤1×10-5mol·L-1),溶液中钡离子浓度至少为 mol·L-1。
24.是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
(1)已知:①
②
③
则的 。
(2)恒温恒容条件下,向密闭容器中充入1和2合成,下列叙述正确的是_______(填字母)。
A.气体压强不随时间变化时达到平衡状态
B.平衡时的最大体积分数为50%
C.平衡后及时移走,平衡常数增大
D.平衡后再充入,的平衡转化率增大
(3)一定温度下,保持总压强为2.0,向密闭容器中充入1和1.6,发生反应:、。反应达到平衡时的转化率为50%,的选择性为80%(已知:甲酸的选择性。该温度下,的平衡常数 。
(4)常温下,向溶液中滴加溶液。溶液的与的关系如图所示。
则 ,n点溶液中离子浓度由大到小的排序为 。
(5)常温下,已知一元酸HCOOH(甲酸)溶液中。
①的 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是 (填序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的
C.稀释后甲酸的电离度会增大
(6)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如图。则d电极是 (填“正极”或“负极”),c电极的电极反应式为 。
25.常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液时,当氢氧化钠溶液的体积从19.98mL变为20.02mL时,溶液的pH发生突变,请回答下列问题:(已知lg2=0.3,lg5=0.7)
(1)pH突跃范围是: ;
(2)请写出上述结果的计算过程: 。
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】B
4.【答案】A
5.【答案】C
6.【答案】C
7.【答案】C
8.【答案】C
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】C
13.【答案】D
14.【答案】C
15.【答案】D
16.【答案】D
17.【答案】B
18.【答案】D
19.【答案】C
20.【答案】A
21.【答案】(1)1.0×10-5
(2)d>c>b
(3)C
(4)1;
(5)1.0×109
(6)
22.【答案】(1)再向其中加入4滴0.1mo/LKI溶液
(2)黄
(3)AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);;小;更小
(4)氧化;Ag-+e-=Ag
(5)Ag+与 I-之间发生沉淀反应比氧化还原反应的速率或限度大
23.【答案】(1)2Al+2OH-+2H2O=2AlO +3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑);SiO2 + 2OH-=SiO +H2O
(2)Fe3+、Cr3+;5.6~6.2(或5.6≤pH<6.2)
(3)4Ni(OH)2+O2 4NiOOH+2H2O
(4)2CrO +2H+ Cr2O +H2O;1.2×10-5
24.【答案】(1)-31.4
(2)
(3)
(4);
(5)3;C
(6)正极;C2H5OH-12e-+3H2O=2CO2↑+12H+
25.【答案】(1)4.3-9.7
(2)19.98mL时,盐酸剩余,;20.02mL时,NaOH过量,,则pH=14-4.3=9.7。
2024-2025学年高二上学期化学人教版(2019)必修第二册
一、单选题
1.化学与生产、生活密切相关,下列说法正确的是( )
A.直接加热蒸干纯碱的水溶液无法得到纯碱固体
B.冬季空气中的水蒸气凝结成冰霜的过程是自发的,该过程的熵减小
C.草木灰和铵态氮肥混合施用,可促进植物对化肥的吸收和综合利用
D.工业合成氨选用的温度越低越好,压强越大越好
2.根据下表信息,判断0.10 mol/L的下列各溶液pH最大的是( )
酸 电离常数(常温下)
CH3COOH Ka=1.8×10-5
H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11
H2S Ka1=9.1×10-8,Ka2=1.1×10-12
A.CH3COONa B.Na2CO3 C.NaHCO3 D.Na2S
3.下列溶液一定呈中性的是
A.非电解质溶于水得到的溶液
B.c(H+)=c(OH-)的溶液
C.pH=7的溶液
D.由强酸、强碱等物质的量反应得到的溶液
4.下列物质中,既能导电又属于强电解质的是( )
A.熔融 B.液氨 C.硅 D.盐酸
5.常温下,下列有关pH说法正确的是(混合溶液忽略体积的变化)( )
A.0.1mol·L-1的H2SO4溶液pH为1
B.用广泛pH试纸测得某盐酸的pH=2.3
C.将pH=5的硫酸与pH=9的NaOH溶液等体积混合pH为7
D.1mLpH=8的NaOH溶液加水至100mL,pH为6
6.室温下,某浓度的H2C2O4,溶液在不同pH下,测得pc(H2C2O4)、pc(HC2O)、pc(C2O)的变化如图所示。下列说法正确的是( )
已知:pc(H2C2O4)=-lgc(H2C2O4),其它类似。
A.曲线①表示pc(C2O)随pH的变化
B.H2C2O4的pKa1=3.82
C.b点对应的pH约为2.54
D.1.25<3.82,c(H2C2O4)+c(HC2O)+c(C2O)先减小后增大
7.常温下向100mL0.2mol L-1的氨水中逐滴加入0.2mol L-1的盐酸,所得溶液的pH、溶液中和NH3 H2O的物质的量分数与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是( )
A.表示NH3 H2O物质的量分数变化的曲线是B
B.pH=9.26时溶液中,NH3 H2O的电离程度小于的水解程度
C.常温下NH3 H2O的电离常数为1.8×10-5 mol L-1 (已知lg1.8=0.26)
D.当加入盐酸体积为50mL时,溶液中c()-c(NH3 H2O)=2×(10-5+10-9)mol L-1
8.一定温度下,三种卤化银AgX(X=Cl、Br、I)D的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.甲是AgCl的沉淀溶解平衡曲线
B.稀释b点溶液,AgX的Ksp会减小
C.对三种卤化银而言,a点均为不饱和溶液
D.向4 mL 5.0×10-5 mol·L-1的NaCl溶液中加入1 mL 0.1 mol·L-1的AgNO3溶液,不会析出沉淀
9.常温下,浓度均为的醋酸和盐酸溶液在水中的电离示意图如下图所示,下列描述错误的是( )
A.代表
B.冰醋酸是强电解质
C.:试剂试剂2
D.中和等体积两份溶液,耗碱量相同
10.T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)BaSO4(s)+Pb2+(aq)的平衡常数为102.4
11.高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。常温下,调节其水溶液pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知 ]。
下列说法正确的是( )
A.25℃,B点水的电离出的c(H+)=1×10 4
B.NaHFeO4溶液显碱性
C.常温下,H2FeO4(aq)+H+(aq) H3FeO (aq)的平衡常数K<100
D.K2FeO4起杀菌消毒作用是因为其遇水生成了Fe(OH)3胶体
12.室温下,取相同的两种一元酸HA和HB各1mL,分别加水稀释,随溶液体积变化的曲线如图所示,下列说法正确的是( )
A.酸性
B.溶液中水的电离程度:b点点
C.c、e两点的电离常数相等
D.从b点到d点,比值变小
13.常温下,0.02 mol L 1100mL氢氧化钡和同浓度同体积的盐酸混合后的pH值是( )
A.2 B.7 C.9 D.12
14.某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入AgNO3可以使溶液由c点变到d点
B.加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C.d点有AgCl沉淀生成
D.a点对应的Ksp小于b点对应的Ksp
15.为阿伏加德罗常数的值,下列说法正确的是
A.6.0gSiO2晶体中含有的共价键数目为0.2NA
B.标准状况下,1.12L HF所含分子数目为0.05NA
C.25℃,1.0L pH=12的澄清石灰水中的数目为0.02NA
D.1.0L0.1mol/L的MgSO4溶液中Mg2+的数目小于0.1NA
16.常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
A.Ksp(Ag2S)=10-29.2
B.向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp (CuS)减小
C.若Z点为Ag2S的分散系,ν(沉淀)>ν(溶解)
D.CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数很大,反应趋于完全
17.一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示。下列说法不正确的是( )
A.加水前导电能力为零的原因是冰醋酸中不存在自由移动的离子
B.a、b、c三点对应溶液的
C.a、b、c三点对应溶液的电离程度:
D.加入少量固体,可使点增大、减小
18.下列说法正确的是( )
A.将0.585 g氯化钠固体加入到100mL水中溶解,得到的氯化钠溶液浓度为0.1 mol/L
B.向NaOH溶液中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体
C.氯化钠溶液在电流的作用下能电离产生Na+、Cl-
D.CO32-的摩尔质量为60 g/mol
19.常温下,用0.2mol·L-1NaOH溶液分别滴定相同浓度的一元酸HA溶液和HB溶液,溶液的pH随离子浓度的变化关系如图所示。已知电离常数Ka(HA) < Ka(HB),下列说法错误的是
A.曲线M代表HA溶液
B.常温下,0.1 mol·L-1NaB溶液的pH约为8.15
C.pH和体积均相同的两种酸溶液中水的电离程度:HA> HB
D.将0.1 mol·L-1 HA溶液加水稀释10倍后,溶液中保持不变
20.以下说法中正确的是( )
A.常温下pH=4的H2C2O4溶液稀释100倍,pH约为5,则H2C2O4是弱电解质
B.增大压强,活化分子百分数增大,单位时间内有效碰撞次数增多,化学反应速率加快
C.工业合成氨反应是一个熵增加的过程
D.等物质的量浓度①NaHSO4和②NaHCO3溶液中水的电离程度①>②
二、综合题
21.常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
(1)该温度时NH3·H2O的电离常数K约为 。
(2)比较b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为 。
(3)滴定时,由b点到c点的过程中,忽略溶液温度的变化,下列各选项中数值逐渐减小的是____(填字母)。
A.c(H+)·c(OH-) B.
C.c(NH)·c(OH- ) D.
(4)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为 。
(5)常温下反应NH3·H2O(aq)+H+(aq) NH (aq)+H2O(l)的平衡常数K= 。
(6)d点溶液中溶质的电子式 。
22.
(1)Ⅰ、某小组同学用下列试剂研究将转化为。(已知:,)
实验操作:所用试剂:溶液,溶液,溶液;向盛有溶液的试管中滴加2滴溶液,充分振荡后, (将操作补充完整)。
(2)实验现象:上述实验中,沉淀由白色变为 色现象可证明转化为。
(3)分析及讨论
①该沉淀转化反应的离子方程式是 。
②定量分析。由上述沉淀转化反应的化学平衡常数表达式可推导: (列式即可,不必计算结果)。
③同学们结合②中的分析方法,认为教材中的表述:“一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现”,可进一步表述为对于组成形式相同的沉淀, (填“小”或者“大”)的沉淀转化为 (填“更小”或者“更大”)的沉淀容易实现。
(4)Ⅱ、某同学设计如图实验装置研究溶液和溶液间的反应(a、b均为石墨)。
当K闭合后,发现电流计指针偏转,b极附近溶液变蓝。
①b极发生的是 (填“氧化”或“还原”)反应。
②a极上的电极反应式是 。
(5)事实证明:溶液与的溶液混合只能得到沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因是与之间发生沉淀反应比氧化还原反应的速率或限度 (填“小”或者“大”)。
23.碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2,少量Cr、FeS等)来制备,其工艺流程如下:
回答下列问题:
(1)“碱浸”时,发生反应的离子反应方程式① ,② 。
(2)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH 完全沉淀的pH
Ni2+ 6.2 8.6
Fe2+ 7.6 9.1
Fe3+ 2.3 3.3
Cr3+ 4.5 5.6
“调pH 1”时,主要除去的离子是 ,溶液pH范围 。
(3)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式 。
(4)在酸性溶液中CrO 可以转化成Cr2O ,用离子方程式表示该转化反应 ,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO 沉淀完全(c(CrO )≤1×10-5mol·L-1),溶液中钡离子浓度至少为 mol·L-1。
24.是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
(1)已知:①
②
③
则的 。
(2)恒温恒容条件下,向密闭容器中充入1和2合成,下列叙述正确的是_______(填字母)。
A.气体压强不随时间变化时达到平衡状态
B.平衡时的最大体积分数为50%
C.平衡后及时移走,平衡常数增大
D.平衡后再充入,的平衡转化率增大
(3)一定温度下,保持总压强为2.0,向密闭容器中充入1和1.6,发生反应:、。反应达到平衡时的转化率为50%,的选择性为80%(已知:甲酸的选择性。该温度下,的平衡常数 。
(4)常温下,向溶液中滴加溶液。溶液的与的关系如图所示。
则 ,n点溶液中离子浓度由大到小的排序为 。
(5)常温下,已知一元酸HCOOH(甲酸)溶液中。
①的 。
②取10mL0.1mol/L的HCOOH溶液稀释100倍,有关说法正确的是 (填序号)
A.所有离子的浓度在稀释过程中都会减少
B.稀释后溶液的
C.稀释后甲酸的电离度会增大
(6)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如图。则d电极是 (填“正极”或“负极”),c电极的电极反应式为 。
25.常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHCl溶液时,当氢氧化钠溶液的体积从19.98mL变为20.02mL时,溶液的pH发生突变,请回答下列问题:(已知lg2=0.3,lg5=0.7)
(1)pH突跃范围是: ;
(2)请写出上述结果的计算过程: 。
答案解析部分
1.【答案】B
2.【答案】D
3.【答案】B
4.【答案】A
5.【答案】C
6.【答案】C
7.【答案】C
8.【答案】C
9.【答案】B
10.【答案】D
11.【答案】C
12.【答案】C
13.【答案】D
14.【答案】C
15.【答案】D
16.【答案】D
17.【答案】B
18.【答案】D
19.【答案】C
20.【答案】A
21.【答案】(1)1.0×10-5
(2)d>c>b
(3)C
(4)1;
(5)1.0×109
(6)
22.【答案】(1)再向其中加入4滴0.1mo/LKI溶液
(2)黄
(3)AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);;小;更小
(4)氧化;Ag-+e-=Ag
(5)Ag+与 I-之间发生沉淀反应比氧化还原反应的速率或限度大
23.【答案】(1)2Al+2OH-+2H2O=2AlO +3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑);SiO2 + 2OH-=SiO +H2O
(2)Fe3+、Cr3+;5.6~6.2(或5.6≤pH<6.2)
(3)4Ni(OH)2+O2 4NiOOH+2H2O
(4)2CrO +2H+ Cr2O +H2O;1.2×10-5
24.【答案】(1)-31.4
(2)
(3)
(4);
(5)3;C
(6)正极;C2H5OH-12e-+3H2O=2CO2↑+12H+
25.【答案】(1)4.3-9.7
(2)19.98mL时,盐酸剩余,;20.02mL时,NaOH过量,,则pH=14-4.3=9.7。
