2024年甘肃卷高考真题化学试题(含答案)
文档属性
| 名称 | 2024年甘肃卷高考真题化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-28 23:52:52 | ||
图片预览

文档简介
机密★启用前
2024年甘肃省普通高校招生统一考试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号框。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列成语涉及金属材料的是
A. 洛阳纸贵 B. 聚沙成塔 C. 金戈铁马 D. 甘之若饴
2. 下列化学用语表述错误的是
A. 和的最外层电子排布图均为
B. 和的电子式分别为和
C. 的分子结构模型为
D. 、和互为同位素
3. 化学与生活息息相关,下列对应关系错误的是
物质 性质 用途
A 次氯酸钠 氧化性 衣物漂白
B 氢气 可燃性 制作燃料电池
C 聚乳酸 生物可降解性 制作一次性餐具
D 活性炭 吸附性 分解室内甲醛
A. A B. B C. C D. D
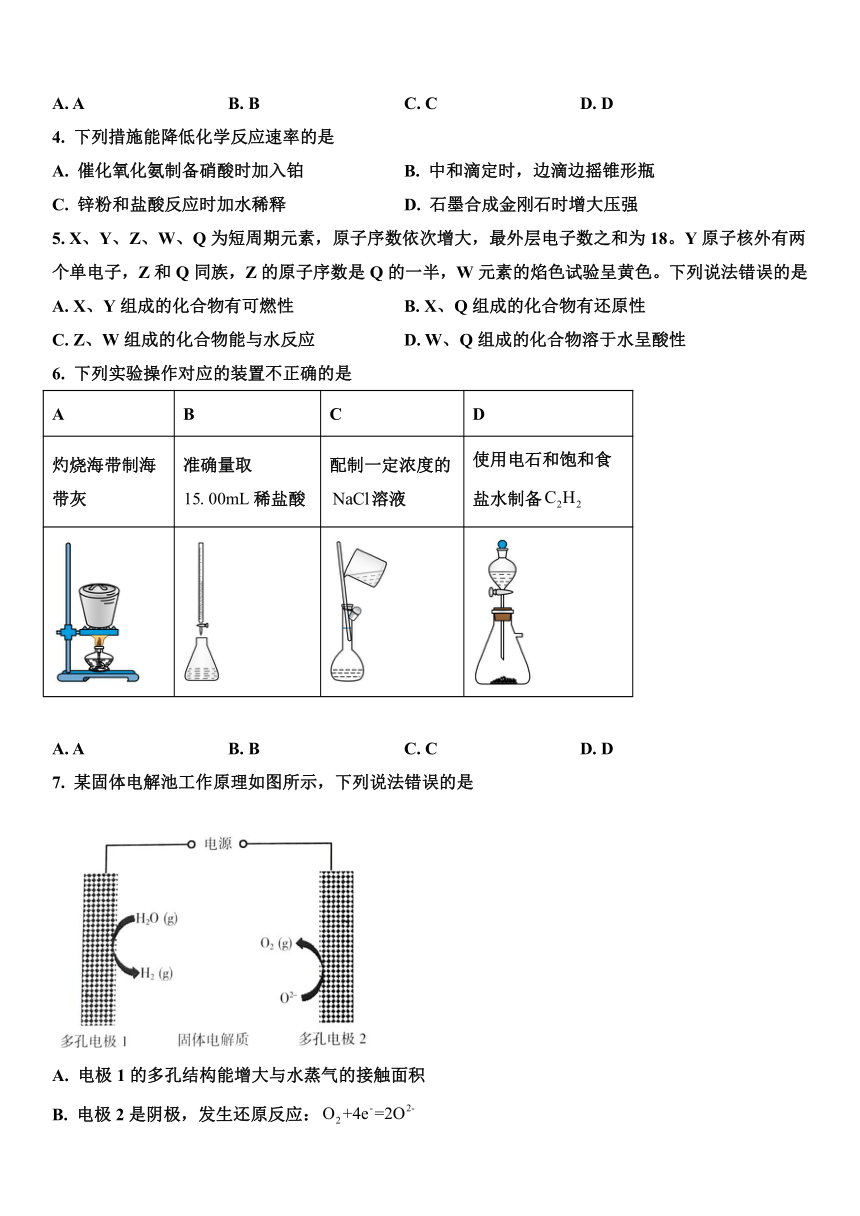
4. 下列措施能降低化学反应速率的是
A. 催化氧化氨制备硝酸时加入铂 B. 中和滴定时,边滴边摇锥形瓶
C. 锌粉和盐酸反应时加水稀释 D. 石墨合成金刚石时增大压强
5. X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子核外有两个单电子,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄色。下列说法错误的是
A. X、Y组成的化合物有可燃性 B. X、Q组成的化合物有还原性
C. Z、W组成的化合物能与水反应 D. W、Q组成的化合物溶于水呈酸性
6. 下列实验操作对应的装置不正确的是
A B C D
灼烧海带制海带灰 准确量取稀盐酸 配制一定浓度的溶液 使用电石和饱和食盐水制备
A. A B. B C. C D. D
7. 某固体电解池工作原理如图所示,下列说法错误的是
A. 电极1的多孔结构能增大与水蒸气的接触面积
B. 电极2是阴极,发生还原反应:
C. 工作时从多孔电极1迁移到多孔电极2
D. 理论上电源提供能分解
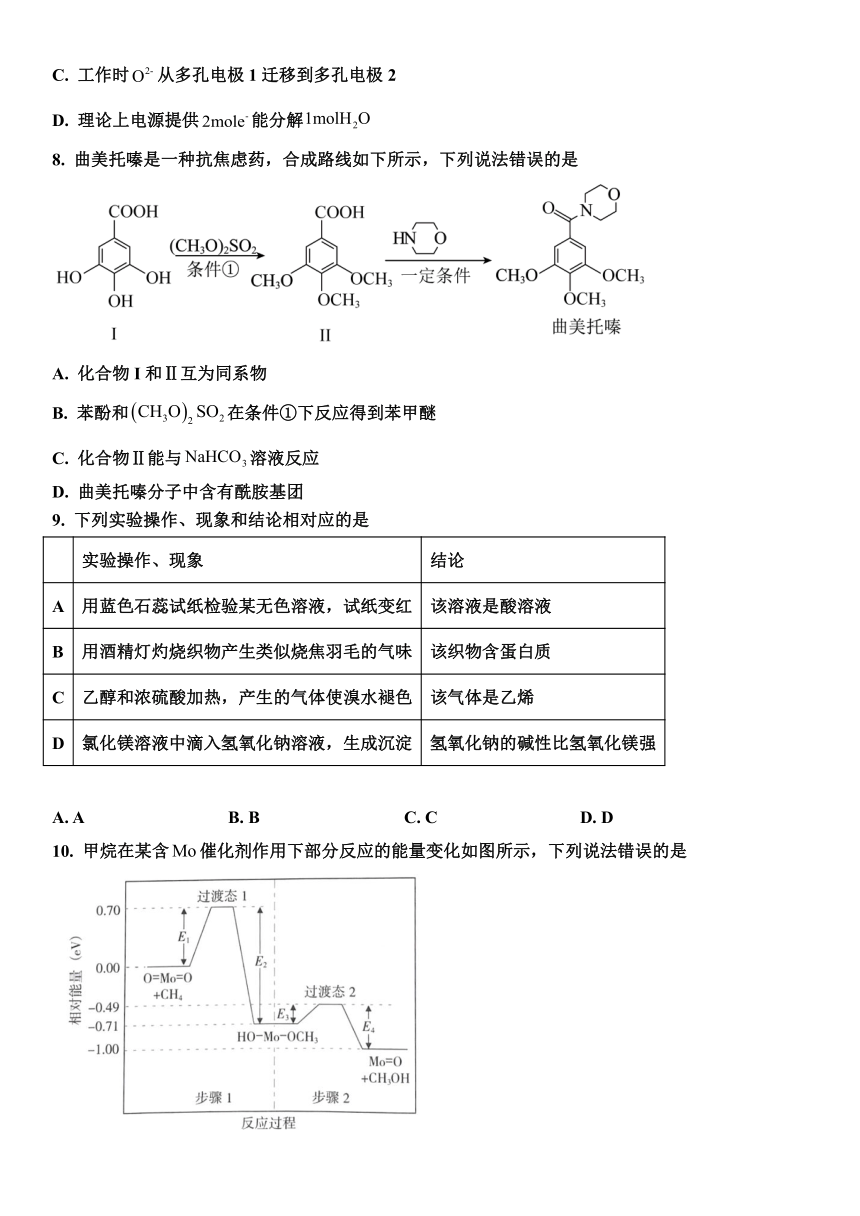
8. 曲美托嗪是一种抗焦虑药,合成路线如下所示,下列说法错误的是
A. 化合物I和Ⅱ互为同系物
B. 苯酚和在条件①下反应得到苯甲醚
C. 化合物Ⅱ能与溶液反应
D. 曲美托嗪分子中含有酰胺基团
9. 下列实验操作、现象和结论相对应的是
实验操作、现象 结论
A 用蓝色石蕊试纸检验某无色溶液,试纸变红 该溶液是酸溶液
B 用酒精灯灼烧织物产生类似烧焦羽毛的气味 该织物含蛋白质
C 乙醇和浓硫酸加热,产生的气体使溴水褪色 该气体是乙烯
D 氯化镁溶液中滴入氢氧化钠溶液,生成沉淀 氢氧化钠的碱性比氢氧化镁强
A. A B. B C. C D. D
10. 甲烷在某含催化剂作用下部分反应的能量变化如图所示,下列说法错误的是
A. B. 步骤2逆向反应的
C. 步骤1的反应比步骤2快 D. 该过程实现了甲烷的氧化
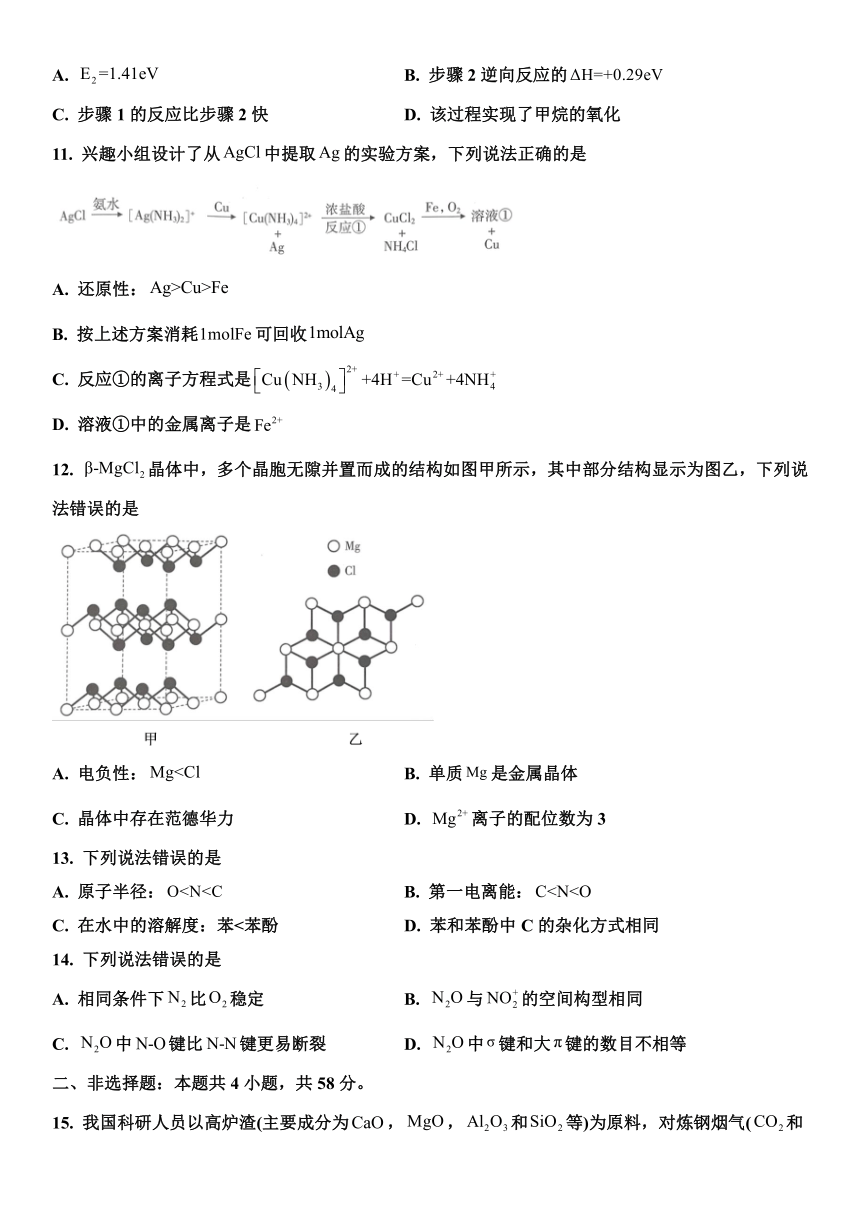
11. 兴趣小组设计了从中提取的实验方案,下列说法正确的是
A. 还原性:
B. 按上述方案消耗可回收
C. 反应①的离子方程式是
D. 溶液①中的金属离子是
12. 晶体中,多个晶胞无隙并置而成的结构如图甲所示,其中部分结构显示为图乙,下列说法错误的是
A. 电负性: B. 单质是金属晶体
C. 晶体中存在范德华力 D. 离子的配位数为3
13. 下列说法错误的是
A. 原子半径: B. 第一电离能:
C. 在水中的溶解度:苯<苯酚 D. 苯和苯酚中C的杂化方式相同
14. 下列说法错误的是
A. 相同条件下比稳定 B. 与的空间构型相同
C. 中键比键更易断裂 D. 中键和大键的数目不相等
二、非选择题:本题共4小题,共58分。
15. 我国科研人员以高炉渣(主要成分为,,和等)为原料,对炼钢烟气(和水蒸气)进行回收利用,有效减少了环境污染,主要流程如图所示:
已知:
(1)高炉渣与经焙烧产生的“气体”是_______。
(2)“滤渣”的主要成分是和_______。
(3)“水浸2”时主要反应的化学方程式为_______,该反应能进行的原因是_______。
(4)铝产品可用于_______。
(5)某含钙化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数。图丙中与N的距离为_______;化合物的化学式是_______,其摩尔质量为,阿伏加德罗常数的值是,则晶体的密度为_______(列出计算表达式)。
16. 某兴趣小组设计了利用和生成,再与反应制备的方案:
(1)采用下图所示装置制备,仪器a的名称为_______;步骤I中采用冰水浴是为了_______;
(2)步骤Ⅱ应分数次加入,原因是_______;
(3)步骤Ⅲ滴加饱和溶液的目的是_______;
(4)步骤Ⅳ生成沉淀,判断已沉淀完全的操作是_______;
(5)将步骤Ⅴ中正确操作或现象的标号填入相应括号中_______。
A.蒸发皿中出现少量晶体
B.使用漏斗趁热过滤
C.利用蒸发皿余热使溶液蒸干
D.用玻璃棒不断搅拌
E.等待蒸发皿冷却
17. 是制备半导体材料硅的重要原料,可由不同途径制备。
(1)由制备:
已知
时,由制备硅_______(填“吸”或“放”)热_______。升高温度有利于制备硅的原因是_______。
(2)在催化剂作用下由粗硅制备:。,密闭容器中,经不同方式处理的粗硅和催化剂混合物与和气体反应,转化率随时间的变化如下图所示:
①,经方式_______处理后的反应速率最快;在此期间,经方式丙处理后的平均反应速率_______。
②当反应达平衡时,的浓度为_______,平衡常数K的计算式为_______。
③增大容器体积,反应平衡向_______移动。
18. 山药素-1是从山药根茎中提取的具有抗菌消炎活性的物质,它的一种合成方法如下图:
(1)化合物I的结构简式为_______。由化合物I制备化合物Ⅱ的反应与以下反应_______的反应类型相同。
A. B.
C. D.
(2)化合物Ⅲ的同分异构体中,同时满足下列条件的有_______种。
①含有苯环且苯环上的一溴代物只有一种;
②能与新制反应,生成砖红色沉淀;
③核磁共振氢谱显示有4组峰,峰面积之比为。
(3)化合物IV的含氧官能团名称为_______。
(4)由化合物V制备VI时,生成的气体是_______。
(5)从官能团转化的角度解释化合物Ⅷ转化为山药素-1的过程中,先加碱后加酸的原因_______。
参考答案
选择题
1-5.CBDCD 6-10.ABABC 11-14.CDBD
二、非选择题
15.
(1)NH3 (2)SiO2
(3) ①. ②. ,微溶的硫酸钙转化为更难溶的碳酸钙
(4)净水 (5) ①. ②. Ca3N3B ③.
16.
(1) ①. 恒压滴液漏斗 ②. 增大SO2的溶解度、增大H2SO3的浓度,同时为步骤Ⅱ提供低温
(2)防止过多的MnO2与H2SO3反应生成MnSO4,同时防止反应太快、放热太多、不利于控制温度低于10℃
(3)除去过量的SO2(或H2SO3)
(4)静置,向上层清液中继续滴加几滴饱和Na2CO3溶液,若不再产生沉淀,说明Mn2+已沉淀完全
(5)D、A、E
17.
(1) ①. 吸 ②. 587.02 ③. 该反应为吸热反应,升高温度,反应正向移动,有利于制备硅
(2) ① 甲 ②. ③. 0.1952 ④. ⑤. 逆反应方向
18.
①. ②. AD
(2)6
(3)酚羟基、醚键、醛基
(4)CO2
(5)提高化合物Ⅷ的转化率
2024年甘肃省普通高校招生统一考试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号框。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列成语涉及金属材料的是
A. 洛阳纸贵 B. 聚沙成塔 C. 金戈铁马 D. 甘之若饴
2. 下列化学用语表述错误的是
A. 和的最外层电子排布图均为
B. 和的电子式分别为和
C. 的分子结构模型为
D. 、和互为同位素
3. 化学与生活息息相关,下列对应关系错误的是
物质 性质 用途
A 次氯酸钠 氧化性 衣物漂白
B 氢气 可燃性 制作燃料电池
C 聚乳酸 生物可降解性 制作一次性餐具
D 活性炭 吸附性 分解室内甲醛
A. A B. B C. C D. D
4. 下列措施能降低化学反应速率的是
A. 催化氧化氨制备硝酸时加入铂 B. 中和滴定时,边滴边摇锥形瓶
C. 锌粉和盐酸反应时加水稀释 D. 石墨合成金刚石时增大压强
5. X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子核外有两个单电子,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄色。下列说法错误的是
A. X、Y组成的化合物有可燃性 B. X、Q组成的化合物有还原性
C. Z、W组成的化合物能与水反应 D. W、Q组成的化合物溶于水呈酸性
6. 下列实验操作对应的装置不正确的是
A B C D
灼烧海带制海带灰 准确量取稀盐酸 配制一定浓度的溶液 使用电石和饱和食盐水制备
A. A B. B C. C D. D
7. 某固体电解池工作原理如图所示,下列说法错误的是
A. 电极1的多孔结构能增大与水蒸气的接触面积
B. 电极2是阴极,发生还原反应:
C. 工作时从多孔电极1迁移到多孔电极2
D. 理论上电源提供能分解
8. 曲美托嗪是一种抗焦虑药,合成路线如下所示,下列说法错误的是
A. 化合物I和Ⅱ互为同系物
B. 苯酚和在条件①下反应得到苯甲醚
C. 化合物Ⅱ能与溶液反应
D. 曲美托嗪分子中含有酰胺基团
9. 下列实验操作、现象和结论相对应的是
实验操作、现象 结论
A 用蓝色石蕊试纸检验某无色溶液,试纸变红 该溶液是酸溶液
B 用酒精灯灼烧织物产生类似烧焦羽毛的气味 该织物含蛋白质
C 乙醇和浓硫酸加热,产生的气体使溴水褪色 该气体是乙烯
D 氯化镁溶液中滴入氢氧化钠溶液,生成沉淀 氢氧化钠的碱性比氢氧化镁强
A. A B. B C. C D. D
10. 甲烷在某含催化剂作用下部分反应的能量变化如图所示,下列说法错误的是
A. B. 步骤2逆向反应的
C. 步骤1的反应比步骤2快 D. 该过程实现了甲烷的氧化
11. 兴趣小组设计了从中提取的实验方案,下列说法正确的是
A. 还原性:
B. 按上述方案消耗可回收
C. 反应①的离子方程式是
D. 溶液①中的金属离子是
12. 晶体中,多个晶胞无隙并置而成的结构如图甲所示,其中部分结构显示为图乙,下列说法错误的是
A. 电负性: B. 单质是金属晶体
C. 晶体中存在范德华力 D. 离子的配位数为3
13. 下列说法错误的是
A. 原子半径: B. 第一电离能:
C. 在水中的溶解度:苯<苯酚 D. 苯和苯酚中C的杂化方式相同
14. 下列说法错误的是
A. 相同条件下比稳定 B. 与的空间构型相同
C. 中键比键更易断裂 D. 中键和大键的数目不相等
二、非选择题:本题共4小题,共58分。
15. 我国科研人员以高炉渣(主要成分为,,和等)为原料,对炼钢烟气(和水蒸气)进行回收利用,有效减少了环境污染,主要流程如图所示:
已知:
(1)高炉渣与经焙烧产生的“气体”是_______。
(2)“滤渣”的主要成分是和_______。
(3)“水浸2”时主要反应的化学方程式为_______,该反应能进行的原因是_______。
(4)铝产品可用于_______。
(5)某含钙化合物的晶胞结构如图甲所示,沿x轴方向的投影为图乙,晶胞底面显示为图丙,晶胞参数。图丙中与N的距离为_______;化合物的化学式是_______,其摩尔质量为,阿伏加德罗常数的值是,则晶体的密度为_______(列出计算表达式)。
16. 某兴趣小组设计了利用和生成,再与反应制备的方案:
(1)采用下图所示装置制备,仪器a的名称为_______;步骤I中采用冰水浴是为了_______;
(2)步骤Ⅱ应分数次加入,原因是_______;
(3)步骤Ⅲ滴加饱和溶液的目的是_______;
(4)步骤Ⅳ生成沉淀,判断已沉淀完全的操作是_______;
(5)将步骤Ⅴ中正确操作或现象的标号填入相应括号中_______。
A.蒸发皿中出现少量晶体
B.使用漏斗趁热过滤
C.利用蒸发皿余热使溶液蒸干
D.用玻璃棒不断搅拌
E.等待蒸发皿冷却
17. 是制备半导体材料硅的重要原料,可由不同途径制备。
(1)由制备:
已知
时,由制备硅_______(填“吸”或“放”)热_______。升高温度有利于制备硅的原因是_______。
(2)在催化剂作用下由粗硅制备:。,密闭容器中,经不同方式处理的粗硅和催化剂混合物与和气体反应,转化率随时间的变化如下图所示:
①,经方式_______处理后的反应速率最快;在此期间,经方式丙处理后的平均反应速率_______。
②当反应达平衡时,的浓度为_______,平衡常数K的计算式为_______。
③增大容器体积,反应平衡向_______移动。
18. 山药素-1是从山药根茎中提取的具有抗菌消炎活性的物质,它的一种合成方法如下图:
(1)化合物I的结构简式为_______。由化合物I制备化合物Ⅱ的反应与以下反应_______的反应类型相同。
A. B.
C. D.
(2)化合物Ⅲ的同分异构体中,同时满足下列条件的有_______种。
①含有苯环且苯环上的一溴代物只有一种;
②能与新制反应,生成砖红色沉淀;
③核磁共振氢谱显示有4组峰,峰面积之比为。
(3)化合物IV的含氧官能团名称为_______。
(4)由化合物V制备VI时,生成的气体是_______。
(5)从官能团转化的角度解释化合物Ⅷ转化为山药素-1的过程中,先加碱后加酸的原因_______。
参考答案
选择题
1-5.CBDCD 6-10.ABABC 11-14.CDBD
二、非选择题
15.
(1)NH3 (2)SiO2
(3) ①. ②. ,微溶的硫酸钙转化为更难溶的碳酸钙
(4)净水 (5) ①. ②. Ca3N3B ③.
16.
(1) ①. 恒压滴液漏斗 ②. 增大SO2的溶解度、增大H2SO3的浓度,同时为步骤Ⅱ提供低温
(2)防止过多的MnO2与H2SO3反应生成MnSO4,同时防止反应太快、放热太多、不利于控制温度低于10℃
(3)除去过量的SO2(或H2SO3)
(4)静置,向上层清液中继续滴加几滴饱和Na2CO3溶液,若不再产生沉淀,说明Mn2+已沉淀完全
(5)D、A、E
17.
(1) ①. 吸 ②. 587.02 ③. 该反应为吸热反应,升高温度,反应正向移动,有利于制备硅
(2) ① 甲 ②. ③. 0.1952 ④. ⑤. 逆反应方向
18.
①. ②. AD
(2)6
(3)酚羟基、醚键、醛基
(4)CO2
(5)提高化合物Ⅷ的转化率
同课章节目录
