1.1.1反应热、焓变(共19张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1反应热、焓变(共19张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-30 10:07:03 | ||
图片预览





文档简介
(共19张PPT)
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热与焓变
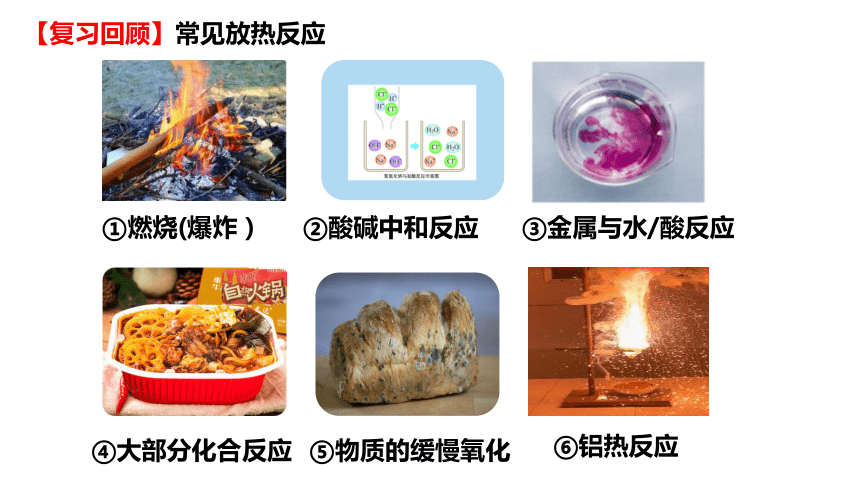
【复习回顾】常见放热反应
②酸碱中和反应
①燃烧(爆炸)
④大部分化合反应
③金属与水/酸反应
⑥铝热反应
⑤物质的缓慢氧化
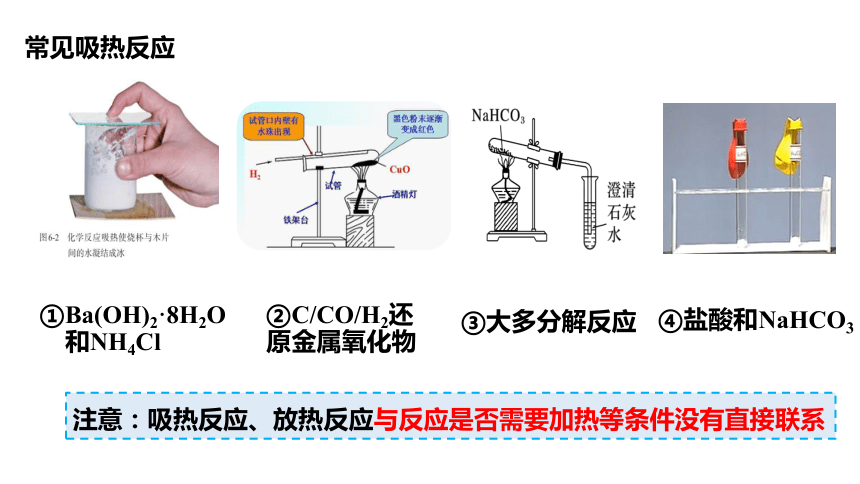
常见吸热反应
①Ba(OH)2·8H2O
和NH4Cl
②C/CO/H2还
原金属氧化物
③大多分解反应
④盐酸和NaHCO3
注意:吸热反应、放热反应与反应是否需要加热等条件没有直接联系
1.判断正误,正确的画“√”,错误的画“×”。
(1)所有的化学反应都伴随着能量的变化,伴有能量变化的一定是
化学反应( )
(2)化学反应的过程中能量转化形式都是化学能与热能的转化( )
(3)热量的释放和吸收是化学反应中能量变化的常见形式( )
(4)氢气在氧气中的燃烧是放热反应( )
2.(双选)下列属于放热反应的是( )
A.水沸腾 B.甲烷的燃烧反应
C.生石灰与水的反应 D.所有的化合反应
【课堂练习】
×
×
√
√
BC
3.下列反应的能量变化与其他三个不相同的是( )
A.铝粉与氧化铁反应 B.氯化铵与消石灰反应
C.锌片与稀硫酸反应 D.钠与冷水反应
4.下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C.放热反应都不需要加热就能发生
D.吸热反应在一定条件(如常温、不加热等)下也能发生
B
C
如何定量描述化学反应中释放或者吸收的热量
体系(系统):试管中的溶液及发生的反应等。(包括反应物、生成物、发生的反应)
环境:与体系相互影响的其它部分(如试管、空气等)
热量 : 指因为温度不同而在体系与环境之间交换
或传递等能量。
一、反应热
1.定义:在等温条件下,化学反应过程中释放或吸收的热量
2.符号:Q
3.单位:kJ/mol 或 kJ.mol-1
体系
环境
二、焓变
1.内能(U):体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。 2.焓与焓变
①焓:与内能有关的物理量 符号:H
②焓变:等压条件下,反应热也可称为焓变 符号:△H 单位:kJ/mol
3.规定
反应体系的能量降低(即放热反应),则△H为“-”
反应体系的能量升高(即吸热反应),则△H为“+”
规定:当△H为“-”(△H < 0)时,为放热反应
当△H为“+”(△H > 0)时,为吸热反应
【课堂练习】
1. 1.0L 1.0mol/L H2SO4溶液与2.00L 1.0mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的反应热为△H= ________ 。
2. 1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H=_____________ 。
-114.6kJ/mol
+131.5kJ/mol
放热反应
反应物具有的总能量高
生成物具有的总能量低
化学
反应
向环境
释放能量
化学反应为什么产生反应热
①宏观分析:能量变化的角度
吸热反应
反应物具有的总能量低
生成物具有的总能量高
化学
反应
从环境
吸收能量
微观:从化学反应实质(化学键)的角度分析
H=反应物的总键能-生成物的总键能
=436 + 243-431×2
=-183 kJ/mol
ΔH<0 放热反应
1.(双选)已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
A.该反应为吸热反应,ΔH>0
B.该反应吸收的能量为E1-E2
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
【课堂练习】
AB
2.(双选)下列说法正确的是( ) A.焓变单位中的kJ·mol-1是指1 mol物质参加反应时的能量变化 B.反应放热时ΔH<0,反应吸热时ΔH>0 C.一个化学反应中,当反应物的总能量大于生成物的总能量时,
反应放热,ΔH为“-” D.—个化学反应中,生成物化学键形成释放的总能量大于反应物
化学键断裂吸收的总能量时,反应吸热,ΔH为“+”
BC
3.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列说法正确的是( )
A.每生成2分子AB吸收b kJ热量B.该反应热ΔH=+(a-b) kJ·mol-1C.该反应中反应物的总能量高于生成物的总能量D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
B
4.△H的计算公式
(1)宏观:△H=E总(生成物)- E总(反应物)
(2)微观:△H=E总(反应物断键吸收)- E总(生成物成键放出)
1.拆开 lmol H-H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
= 946 kJ/mol + 3×436 kJ/mol 6×391 kJ/mol
= 92 kJ/mol
H =E (反应物键能)-E (生成物键能)
N2 + 3H2 2NH3
【课堂练习】
92 kJ/mol
30.7 kJ/mol
2.已知:①1mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成 1mol氯化氢气体,反应的ΔH =-183 kJ
B.氢气和氯气反应生成 2mol氯化氢气体,反应的ΔH = +183 kJ/mol
C.氢气和氯气反应生成 2mol氯化氢气体,反应的ΔH =-183 kJ/mol
D.氢气和氯气反应生成 1mol氯化氢气体,反应的ΔH = +183 kJ/mol
C
总结:反应热、焓、焓变的比较
反应热 焓变 焓
概念 化学反应释放或从吸收的热量 △H=H生成物-H反应物 物质具有的能量
符号 Q ΔH H
单位 kJ/mol 数值 正值表示反应吸热;负值表示反应放热 只有正值
联系 反应热 = 焓变(等压);ΔH=H(生成物)-H(反成物) 注意 焓变、焓、反应热代表的意义不同 任何化学反应都有反应热
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热与焓变
【复习回顾】常见放热反应
②酸碱中和反应
①燃烧(爆炸)
④大部分化合反应
③金属与水/酸反应
⑥铝热反应
⑤物质的缓慢氧化
常见吸热反应
①Ba(OH)2·8H2O
和NH4Cl
②C/CO/H2还
原金属氧化物
③大多分解反应
④盐酸和NaHCO3
注意:吸热反应、放热反应与反应是否需要加热等条件没有直接联系
1.判断正误,正确的画“√”,错误的画“×”。
(1)所有的化学反应都伴随着能量的变化,伴有能量变化的一定是
化学反应( )
(2)化学反应的过程中能量转化形式都是化学能与热能的转化( )
(3)热量的释放和吸收是化学反应中能量变化的常见形式( )
(4)氢气在氧气中的燃烧是放热反应( )
2.(双选)下列属于放热反应的是( )
A.水沸腾 B.甲烷的燃烧反应
C.生石灰与水的反应 D.所有的化合反应
【课堂练习】
×
×
√
√
BC
3.下列反应的能量变化与其他三个不相同的是( )
A.铝粉与氧化铁反应 B.氯化铵与消石灰反应
C.锌片与稀硫酸反应 D.钠与冷水反应
4.下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.对于ΔH>0的反应,反应物的总能量小于生成物的总能量
C.放热反应都不需要加热就能发生
D.吸热反应在一定条件(如常温、不加热等)下也能发生
B
C
如何定量描述化学反应中释放或者吸收的热量
体系(系统):试管中的溶液及发生的反应等。(包括反应物、生成物、发生的反应)
环境:与体系相互影响的其它部分(如试管、空气等)
热量 : 指因为温度不同而在体系与环境之间交换
或传递等能量。
一、反应热
1.定义:在等温条件下,化学反应过程中释放或吸收的热量
2.符号:Q
3.单位:kJ/mol 或 kJ.mol-1
体系
环境
二、焓变
1.内能(U):体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。 2.焓与焓变
①焓:与内能有关的物理量 符号:H
②焓变:等压条件下,反应热也可称为焓变 符号:△H 单位:kJ/mol
3.规定
反应体系的能量降低(即放热反应),则△H为“-”
反应体系的能量升高(即吸热反应),则△H为“+”
规定:当△H为“-”(△H < 0)时,为放热反应
当△H为“+”(△H > 0)时,为吸热反应
【课堂练习】
1. 1.0L 1.0mol/L H2SO4溶液与2.00L 1.0mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的反应热为△H= ________ 。
2. 1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H=_____________ 。
-114.6kJ/mol
+131.5kJ/mol
放热反应
反应物具有的总能量高
生成物具有的总能量低
化学
反应
向环境
释放能量
化学反应为什么产生反应热
①宏观分析:能量变化的角度
吸热反应
反应物具有的总能量低
生成物具有的总能量高
化学
反应
从环境
吸收能量
微观:从化学反应实质(化学键)的角度分析
H=反应物的总键能-生成物的总键能
=436 + 243-431×2
=-183 kJ/mol
ΔH<0 放热反应
1.(双选)已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )
A.该反应为吸热反应,ΔH>0
B.该反应吸收的能量为E1-E2
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
【课堂练习】
AB
2.(双选)下列说法正确的是( ) A.焓变单位中的kJ·mol-1是指1 mol物质参加反应时的能量变化 B.反应放热时ΔH<0,反应吸热时ΔH>0 C.一个化学反应中,当反应物的总能量大于生成物的总能量时,
反应放热,ΔH为“-” D.—个化学反应中,生成物化学键形成释放的总能量大于反应物
化学键断裂吸收的总能量时,反应吸热,ΔH为“+”
BC
3.已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列说法正确的是( )
A.每生成2分子AB吸收b kJ热量B.该反应热ΔH=+(a-b) kJ·mol-1C.该反应中反应物的总能量高于生成物的总能量D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
B
4.△H的计算公式
(1)宏观:△H=E总(生成物)- E总(反应物)
(2)微观:△H=E总(反应物断键吸收)- E总(生成物成键放出)
1.拆开 lmol H-H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
= 946 kJ/mol + 3×436 kJ/mol 6×391 kJ/mol
= 92 kJ/mol
H =E (反应物键能)-E (生成物键能)
N2 + 3H2 2NH3
【课堂练习】
92 kJ/mol
30.7 kJ/mol
2.已知:①1mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成 1mol氯化氢气体,反应的ΔH =-183 kJ
B.氢气和氯气反应生成 2mol氯化氢气体,反应的ΔH = +183 kJ/mol
C.氢气和氯气反应生成 2mol氯化氢气体,反应的ΔH =-183 kJ/mol
D.氢气和氯气反应生成 1mol氯化氢气体,反应的ΔH = +183 kJ/mol
C
总结:反应热、焓、焓变的比较
反应热 焓变 焓
概念 化学反应释放或从吸收的热量 △H=H生成物-H反应物 物质具有的能量
符号 Q ΔH H
单位 kJ/mol 数值 正值表示反应吸热;负值表示反应放热 只有正值
联系 反应热 = 焓变(等压);ΔH=H(生成物)-H(反成物) 注意 焓变、焓、反应热代表的意义不同 任何化学反应都有反应热
