2.1.1烷烃的结构与性质 课件 (共22张PPT) 高中化学 人教版(2019) 选择性必修3
文档属性
| 名称 | 2.1.1烷烃的结构与性质 课件 (共22张PPT) 高中化学 人教版(2019) 选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 42.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-30 15:37:26 | ||
图片预览




文档简介
(共22张PPT)
第1节 烷烃
第1课时:烷烃的结构与性质
第二章
环节一:创设情境,导入新课
甲烷
丙烷和丁烷
丁烷
C17~C21的烷烃
C18~C30的烷烃
C5~C11的烷烃
烷烃被广泛应用于生产生活的各个领域:
环节一:创设情境,导入新课
甲烷
乙烯
乙炔
苯
其结构和性质
认识
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型的主要依据
预测
烷烃是一类最基础的有机化合物
环节二:模型认知,探析结构
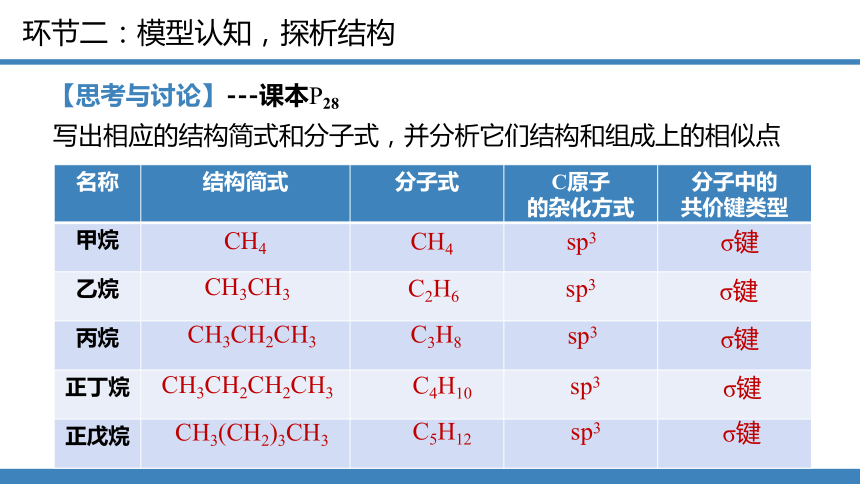
【思考与讨论】---课本P28
写出相应的结构简式和分子式,并分析它们结构和组成上的相似点
名称 结构简式 分子式 C原子 的杂化方式 分子中的
共价键类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
环节二:模型认知,探析结构
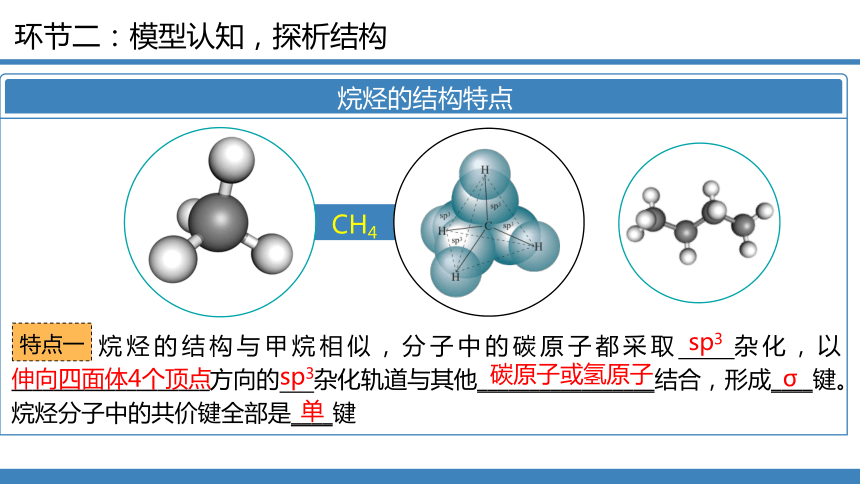
烷烃的结构特点
CH4
烷烃的结构与甲烷相似,分子中的碳原子都采取 杂化,以___________________方向的 杂化轨道与其他_________________结合,形成____键。烷烃分子中的共价键全部是____键
伸向四面体4个顶点
sp3
sp3
碳原子或氢原子
σ
单
特点一
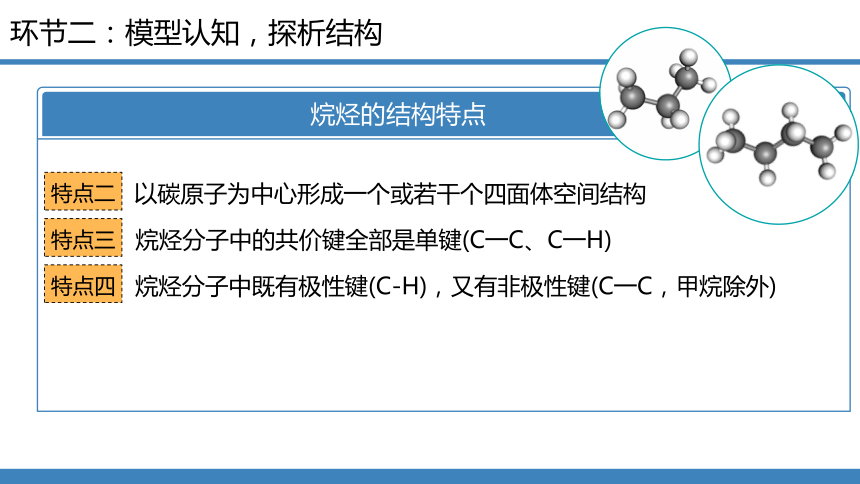
烷烃的结构特点
特点二
以碳原子为中心形成一个或若干个四面体空间结构
特点三
烷烃分子中的共价键全部是单键(C一C、C一H)
特点四
烷烃分子中既有极性键(C-H),又有非极性键(C一C,甲烷除外)
环节二:模型认知,探析结构
环节二:模型认知,探析结构
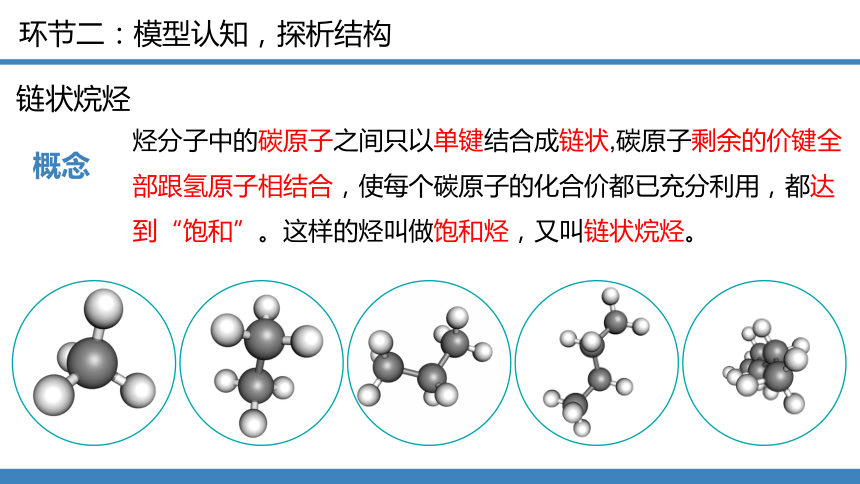
链状烷烃
概念
烃分子中的碳原子之间只以单键结合成链状,碳原子剩余的价键全部跟氢原子相结合,使每个碳原子的化合价都已充分利用,都达到“饱和”。这样的烃叫做饱和烃,又叫链状烷烃。
通式(链状)
CnH2n+2 (n≥1)
空间结构(链状)
C原子均为sp3杂化,碳链呈锯齿状
结构特点(链状)
链状、单键(可旋转)、碳氢键
环节二:模型认知,探析结构
【思考与交流】
(1)烷烃分子中,所有的原子不可能全部在同一共平面
(2)烷烃分子中,所有的碳原子不可能在同一平面
对
错
环节二:模型认知,探析结构
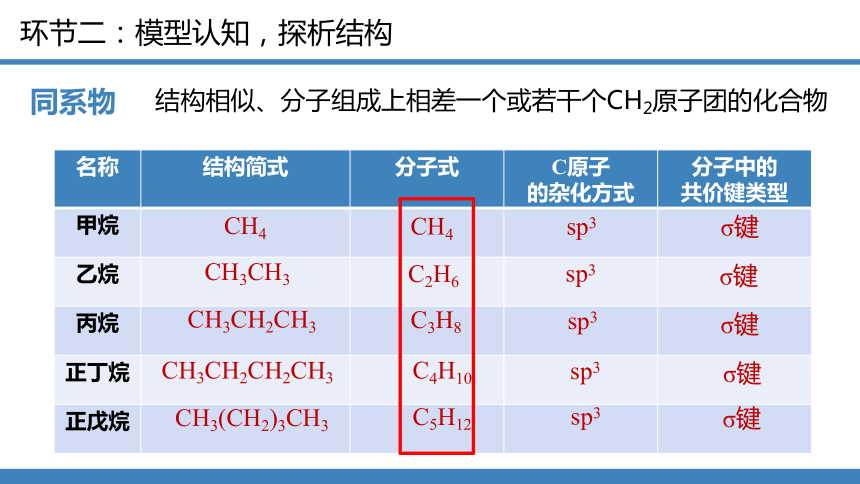
同系物
结构相似、分子组成上相差一个或若干个CH2原子团的化合物
名称 结构简式 分子式 C原子 的杂化方式 分子中的
共价键类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
环节二:模型认知,探析结构
同系物判断的三个关键点:
同
两种物质属于同一类物质,官能团的种类和数目一样。
似
差
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14 n)。
环节二:模型认知,探析结构
① CH3CH2OH 和 HOCH2CH2CH2OH
② CH2=CH2 和
③
④ CH3CH2CH3 和 CH3CH2CH(CH3)2
H2C
CH2
CH2
否
否
否
是
是
⑤CH3COOCH2CH3 和 HCOOCH3
⑥ CH2=CH2 和 CH2=CHCH=CH2
否
判断下列各组物质是否互为同系物?
和
环节三:类比迁移,深度学习
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
思考与交流:
表2-1 几种烷烃的熔点、沸点和密度---课本P30
环节三:类比迁移,深度学习
归纳总结:烷烃的性质——物理性质
物理性质 变化规律
状态 烷烃常温下存在的状态由_____态逐渐过渡到____态、___态。当碳原子数小于或等于_____时,烷烃在常温下呈气态
溶解性 都难溶于_____,易溶于_____________
熔、沸点 随碳原子数的增加,熔、沸点逐渐_______,同种烷烃的不同异构体中,支链越多,熔、沸点越_______
密度 随碳原子数的增加,密度逐渐_______,但比水的________
气
液
固
4
水
有机溶剂
升高
增大
小
低
回顾必修二---甲烷的性质
下列物质在一定条件下,可与CH4发生化学反应的是( )
A. 氯水 B. 液溴 C. O2 D. 酸性KMnO4溶液
E. 浓H2SO4 F. NaOH(aq)
BC
甲烷
结构角度
预测性质
烷 烃
成键方式相似,性质相似
环节三:类比迁移,深度学习
【思考与交流】---课本P29
颜色 溶解性 可燃性 与酸性KMnO4溶液 与溴的CCl4溶液 与强酸、 强碱溶液 与氯气(光照下)
(1)根据甲烷的性质推测烷烃可能具有的性质,填写下表。
无色
难溶
于水
可燃
不反应
取代反应
不反应
不反应
1、稳定性:
烷烃的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化。也不与强酸、强碱及溴的四氯化碳溶液反应,在空气中能燃烧和在光照下与Cl2发生取代反应。
环节三:类比迁移,深度学习
2、可燃性---氧化反应
烷烃都能燃烧
实验现象:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生。
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)完全燃烧的化学方程式。
2C8H18+25O2 16CO2+18H2O
点燃
环节三:类比迁移,深度学习
3、取代反应
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应
(3)写出乙烷与氯气反应生成一氯乙烷的化学方程式,指出该反应的反应类型。并从化学键和官能团的角度分析反应中有机化合物的变化。
CH3CH3+Cl2 CH3CH2Cl+HCl
光
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
环节三:类比迁移,深度学习
3、取代反应
灵犀一点:
(4)反应产物——连锁反应,混合物(多种卤代烃+卤化氢),不适宜制备卤代烃
(3)反应的特点——分步取代,多步反应同时进行,产物多
(2)反应物状态——卤素单质(F2、Cl2、Br2、I2),而不是其水溶液
(1)反应的条件——光照
(5)1mol卤素单质只能取代1molH
环节三:类比迁移,深度学习
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
一氯取代
二氯取代
三氯取代
四氯取代
五氯取代
六氯取代
CH3CH2Cl
CH3CHCl2
CH2ClCH2Cl
CH3CCl3
CH2ClCHCl2
CH2ClCCl3
CHCl2CHCl2
CHCl2CCl3
CCl3CCl3
HCl
共同:
乙烷与氯气在光照下反应,可能的产物有:HCl + 9种有机产物
环节三:类比迁移,深度学习
环节四:归纳整理,练习巩固
知识建构
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
其分子中的碳原子都采取sp3杂化,碳原子与碳原子或其他原子形成σ键
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
环节四:归纳整理,练习巩固
1.下列有机物:①正丁烷,②丙烷,③2 -甲基丁烷,④异丁烷,⑤己烷。沸点由高到低的顺序为( )
A.②①④③⑤ B.⑤③④①②
C.⑤③①④② D.②①③④⑤
C
2.关于烷烃的说法不正确的是( )
A.所有链状烷烃均符合通式CnH2n+2
B.烷烃分子中一定存在C—C σ键
C.烷烃分子中的碳原子均采取sp3杂化
D.烷烃分子中碳原子不一定在一条直线
B
环节四:归纳整理,练习巩固
3.下列叙述错误的是 ( )
A.甲烷与氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为CnH2n+2的烃一定是链状烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸
B
4、下列物质中,在常温和光照的条件下可以与乙烷发生化学反应的是( )
A、稀硫酸 B、NaOH溶液
C、Cl2 D、酸性KMnO4 溶液
C
第1节 烷烃
第1课时:烷烃的结构与性质
第二章
环节一:创设情境,导入新课
甲烷
丙烷和丁烷
丁烷
C17~C21的烷烃
C18~C30的烷烃
C5~C11的烷烃
烷烃被广泛应用于生产生活的各个领域:
环节一:创设情境,导入新课
甲烷
乙烯
乙炔
苯
其结构和性质
认识
各类烃的结构和性质
碳原子的饱和程度和化学键的类型
烃分子可能的断键部位与相应反应类型的主要依据
预测
烷烃是一类最基础的有机化合物
环节二:模型认知,探析结构
【思考与讨论】---课本P28
写出相应的结构简式和分子式,并分析它们结构和组成上的相似点
名称 结构简式 分子式 C原子 的杂化方式 分子中的
共价键类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
环节二:模型认知,探析结构
烷烃的结构特点
CH4
烷烃的结构与甲烷相似,分子中的碳原子都采取 杂化,以___________________方向的 杂化轨道与其他_________________结合,形成____键。烷烃分子中的共价键全部是____键
伸向四面体4个顶点
sp3
sp3
碳原子或氢原子
σ
单
特点一
烷烃的结构特点
特点二
以碳原子为中心形成一个或若干个四面体空间结构
特点三
烷烃分子中的共价键全部是单键(C一C、C一H)
特点四
烷烃分子中既有极性键(C-H),又有非极性键(C一C,甲烷除外)
环节二:模型认知,探析结构
环节二:模型认知,探析结构
链状烷烃
概念
烃分子中的碳原子之间只以单键结合成链状,碳原子剩余的价键全部跟氢原子相结合,使每个碳原子的化合价都已充分利用,都达到“饱和”。这样的烃叫做饱和烃,又叫链状烷烃。
通式(链状)
CnH2n+2 (n≥1)
空间结构(链状)
C原子均为sp3杂化,碳链呈锯齿状
结构特点(链状)
链状、单键(可旋转)、碳氢键
环节二:模型认知,探析结构
【思考与交流】
(1)烷烃分子中,所有的原子不可能全部在同一共平面
(2)烷烃分子中,所有的碳原子不可能在同一平面
对
错
环节二:模型认知,探析结构
同系物
结构相似、分子组成上相差一个或若干个CH2原子团的化合物
名称 结构简式 分子式 C原子 的杂化方式 分子中的
共价键类型
甲烷
乙烷
丙烷
正丁烷
正戊烷
CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
CH3(CH2)3CH3
CH4
C2H6
C3H8
C4H10
C5H12
sp3
sp3
sp3
sp3
sp3
σ键
σ键
σ键
σ键
σ键
环节二:模型认知,探析结构
同系物判断的三个关键点:
同
两种物质属于同一类物质,官能团的种类和数目一样。
似
差
两种物质结构相似,碳骨架的链接方式相同。
两种物质分子组成上相差一个或多个CH2原子团
(1)同系物一定具有不同的碳原子数(或分子式)。
(2)同系物一定具有不同的相对分子质量(相差14 n)。
环节二:模型认知,探析结构
① CH3CH2OH 和 HOCH2CH2CH2OH
② CH2=CH2 和
③
④ CH3CH2CH3 和 CH3CH2CH(CH3)2
H2C
CH2
CH2
否
否
否
是
是
⑤CH3COOCH2CH3 和 HCOOCH3
⑥ CH2=CH2 和 CH2=CHCH=CH2
否
判断下列各组物质是否互为同系物?
和
环节三:类比迁移,深度学习
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
思考与交流:
表2-1 几种烷烃的熔点、沸点和密度---课本P30
环节三:类比迁移,深度学习
归纳总结:烷烃的性质——物理性质
物理性质 变化规律
状态 烷烃常温下存在的状态由_____态逐渐过渡到____态、___态。当碳原子数小于或等于_____时,烷烃在常温下呈气态
溶解性 都难溶于_____,易溶于_____________
熔、沸点 随碳原子数的增加,熔、沸点逐渐_______,同种烷烃的不同异构体中,支链越多,熔、沸点越_______
密度 随碳原子数的增加,密度逐渐_______,但比水的________
气
液
固
4
水
有机溶剂
升高
增大
小
低
回顾必修二---甲烷的性质
下列物质在一定条件下,可与CH4发生化学反应的是( )
A. 氯水 B. 液溴 C. O2 D. 酸性KMnO4溶液
E. 浓H2SO4 F. NaOH(aq)
BC
甲烷
结构角度
预测性质
烷 烃
成键方式相似,性质相似
环节三:类比迁移,深度学习
【思考与交流】---课本P29
颜色 溶解性 可燃性 与酸性KMnO4溶液 与溴的CCl4溶液 与强酸、 强碱溶液 与氯气(光照下)
(1)根据甲烷的性质推测烷烃可能具有的性质,填写下表。
无色
难溶
于水
可燃
不反应
取代反应
不反应
不反应
1、稳定性:
烷烃的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化。也不与强酸、强碱及溴的四氯化碳溶液反应,在空气中能燃烧和在光照下与Cl2发生取代反应。
环节三:类比迁移,深度学习
2、可燃性---氧化反应
烷烃都能燃烧
实验现象:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生。
(2)根据甲烷的燃烧反应,写出汽油的成分之一辛烷(C8H18)完全燃烧的化学方程式。
2C8H18+25O2 16CO2+18H2O
点燃
环节三:类比迁移,深度学习
3、取代反应
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应
(3)写出乙烷与氯气反应生成一氯乙烷的化学方程式,指出该反应的反应类型。并从化学键和官能团的角度分析反应中有机化合物的变化。
CH3CH3+Cl2 CH3CH2Cl+HCl
光
+
Cl—Cl
光
C
C
H
H
H
H
H
H
C
C
Cl
H
H
H
H
H
Cl
H
+
环节三:类比迁移,深度学习
3、取代反应
灵犀一点:
(4)反应产物——连锁反应,混合物(多种卤代烃+卤化氢),不适宜制备卤代烃
(3)反应的特点——分步取代,多步反应同时进行,产物多
(2)反应物状态——卤素单质(F2、Cl2、Br2、I2),而不是其水溶液
(1)反应的条件——光照
(5)1mol卤素单质只能取代1molH
环节三:类比迁移,深度学习
(4)乙烷与氯气在光照下反应,可能生成哪些产物?请写出它们的结构简式。
一氯取代
二氯取代
三氯取代
四氯取代
五氯取代
六氯取代
CH3CH2Cl
CH3CHCl2
CH2ClCH2Cl
CH3CCl3
CH2ClCHCl2
CH2ClCCl3
CHCl2CHCl2
CHCl2CCl3
CCl3CCl3
HCl
共同:
乙烷与氯气在光照下反应,可能的产物有:HCl + 9种有机产物
环节三:类比迁移,深度学习
环节四:归纳整理,练习巩固
知识建构
结
质
质
烷烃分子中的共价键全部是单键
化
学
性
物
理
性
构
其分子中的碳原子都采取sp3杂化,碳原子与碳原子或其他原子形成σ键
烷烃的结构与性质
能在光照下与氯气发生取代反应
常温下不能被酸性高锰酸钾溶液氧化,不与强酸、强碱及溴的四氯化碳溶液反应
能在空气中燃烧(可燃性)
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
随着烷烃碳原子数的增加,烷烃的密度逐渐增大
随着烷烃碳原子数的增加,常温下的存在状态也由气态逐渐过渡到液态、固态。
环节四:归纳整理,练习巩固
1.下列有机物:①正丁烷,②丙烷,③2 -甲基丁烷,④异丁烷,⑤己烷。沸点由高到低的顺序为( )
A.②①④③⑤ B.⑤③④①②
C.⑤③①④② D.②①③④⑤
C
2.关于烷烃的说法不正确的是( )
A.所有链状烷烃均符合通式CnH2n+2
B.烷烃分子中一定存在C—C σ键
C.烷烃分子中的碳原子均采取sp3杂化
D.烷烃分子中碳原子不一定在一条直线
B
环节四:归纳整理,练习巩固
3.下列叙述错误的是 ( )
A.甲烷与氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为CnH2n+2的烃一定是链状烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸
B
4、下列物质中,在常温和光照的条件下可以与乙烷发生化学反应的是( )
A、稀硫酸 B、NaOH溶液
C、Cl2 D、酸性KMnO4 溶液
C
