4.2电解池 课件(共33张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2电解池 课件(共33张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-01 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
第四章 电化学基础
第二节 电解池
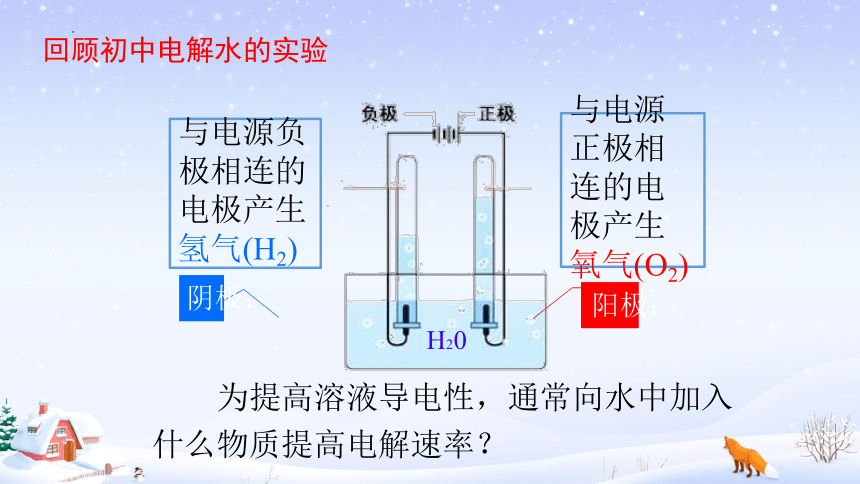
与电源负极相连的电极产生氢气(H2)
与电源正极相连的电极产生氧气(O2)
回顾初中电解水的实验
H20
阴极:
阳极:
为提高溶液导电性,通常向水中加入什么物质提高电解速率?
+
-
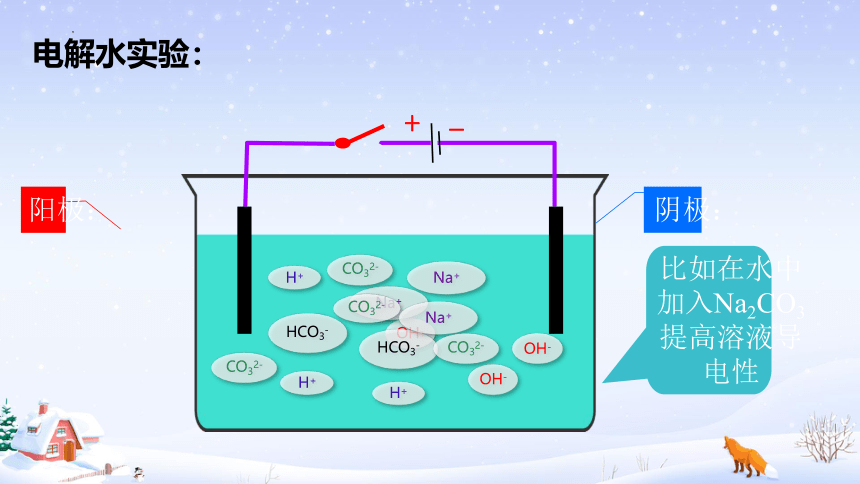
电解水实验:
Na+
HCO3-
OH-
H+
Na+
CO32-
H+
OH-
OH-
H+
HCO3-
Na+
CO32-
CO32-
CO32-
比如在水中加入Na2CO3提高溶液导电性
阳极:
阴极:
+
-
Na+
HCO3-
OH-
H+
Na+
CO32-
H+
OH-
OH-
H+
HCO3-
Na+
CO32-
CO32-
CO32-
H2
H2
H2
O2
O2
O2
e-
e-
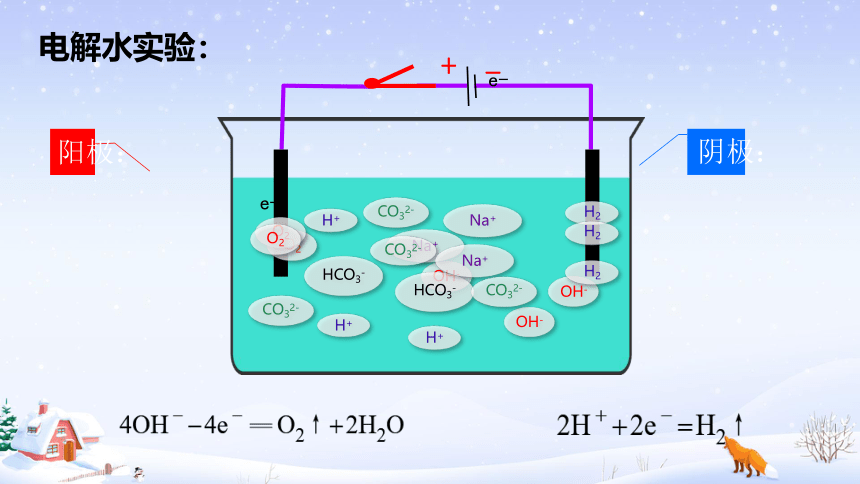
电解水实验:
阳极:
阴极:
阴极:
吸引溶液中的阳离子(Na+、H+)
OH-失电子——发生氧化反应
4OH-— 4e-=O2 ↑ + 2H2O
阳极:
吸引溶液中的阴离子(OH-、CO32-、HCO3-)
H+得电子——发生还原反应
总反应:
即:4H2O+4e-= 4OH-+2H2
H+来自于水的电离
OH-来自于水的电离
4H++4e- = 2H2↑
一、电解原理
对照下列问题进行探究:
(1)明确电解池的阴、阳极,辨别阳极材料(惰性电极还是活性电极)。
(2)通电前,溶液中有哪些离子 如何运动?
(3)通电后,电子的移动方向,离子的移动方向是怎样的?
(4)阴、阳两极各有什么现象?离子放电的先后顺序是怎样的?
(5)如何书写电极反应试和总反应式?
(6)电解质溶液浓度如何变化?溶液PH如何变化?
(7)电解过程中体系减少了什么?如何恢复原溶液?
(8)你能总结几种判断电解池阴极、阳极的方法?
实验探究:电极电解NaCl、CuSO4混合溶液
参看[实验4-2](教材P79)
盘点收获:
(1)明确电解池的阴、阳极,辨别阳极材料(惰性电极还是活性电极)。
(2)通电前,溶液中有哪些离子 如何运动?
(3)通电后,电子的移动方向,离子的移动方向是怎样的?
有Na+、CI—、Cu2+、SO42-、H+、OH—,作自由运动。
Na+、Cu2+、H+
阴极
阳极
CI—、SO42-、OH—
阳极是惰性电极
电子:电解池的阳极→电源的正极导线电源负极→电解池阴极。
离子:
实验探究:电极电解NaCl、CuSO4混合溶液
盘点收获:
(4)阴、阳两极各有什么现象?离子放电的先后顺序是怎样的?
(5)如何书写电极反应试和总反应式?
(6)电解质溶液浓度如何变化?溶液PH如何变化?
阴极(C):Cu2++2e-= Cu(还原反应)
阳极(C):2Cl—-2e-= Cl2↑(氧化反应)
总反应式:
CuCl2溶液浓度减小,溶液PH增大。
阴极:
产生黄绿色气体,淀粉KI试纸变蓝。
放电顺序:CI—>OH—、SO42-
阳极:
石墨棒上出现红色的固体物质。
放电顺序:Cu2+>H+、Na+
实验探究:电极电解NaCl、CuSO4混合溶液
实验探究:电极电解NaCl、CuSO4混合溶液
盘点收获:
(7)电解过程中体系减少了什么?如何恢复原溶液?
(8)你能总结几种判断电解池阴极、阳极的方法?
消耗溶质CuCl2
向电解后的溶液中加入一定质量的CuCl2固体即可恢复。
2.电解池电极判断方法:
方法1:看与电源的连接方式(与电源负极相连的是阴极)
(与电源正极相连的是阳极)
方法2:看电子流动方向(得到电子或电子流入的一极是阴极)
(失去电子或电子流出的一极是阳极)
方法3:看电流方向(电流流出的一极是阴极)
(电流流入的一极是阳极)
方法4:看离子移动方向(阳离子移向的一极是阴极)
(阴离子移向的一极是阳极)
方法5:看电极反应类型(化合价降低,发生还原反应的是阴极)
(化合价升高,发生氧化反应的是阳极)
方法6:看电极质量变化(电极材料质量增重是阴极)
(电极质量减轻是活泼电极材料,作阳极)
方法7:看电极产物的性质(生成还原性物质如H2、金属单质的是阴极)
(生成氧化性物质如O2、Cl2、I2等的是阳极)
思考与交流:
在电解NaCl、CuSO4溶液的实验中,阳离子Na+、Cu2+、H+向 极移动,但是首先在电极上析出了是 ,而不是 ,说明 ,如果Cu2+消耗完了,H+、Na+谁会放电呢?同样,在阳极上先析出的是 ,如果Cl-消耗完了,又会怎样呢?
阴
Cu
H2、Na
Cu2+比H+、Na+先放电
Cl2
离子的放电顺序
①阴极:(阳离子在阴极上按放电顺序得电子被还原,不考虑电极材料)
水溶液中只考虑此部分
浓度很大时排在H+(酸电离)前面
在水溶液中不放电,只在熔融状态下放电。
3.物质(离子)在电解过程中的放电顺序(总结提升)
Ag+>Hg2+>Fe3+>Cu2+>H+(酸电离)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水电离) >Al3+>Mg2+>Na+>Ca2+>K+
②阳极:(要分析电极材料)
a.活性电极(活泼金属)作阳极时:电极本身放电(溶解)。
b.惰性电极(C、Pt、Au等)作阳极时:阴离子在阳极上按放电顺序失电子被氧化。
放电顺序:活性阳极(金属)>S2->I->Br->Cl->OH->含氧酸根>F-
阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根>F-
水溶液中只考虑此部分
注意:在溶液中含氧酸根离子不放电,常指最高价(中心原子)含氧酸根离子不放电,但非最高价(中心原子)含氧酸根离子的放电能力比OH-的强,如SO32—、MnO42—等。
电解池 原电池
电极材料
电极名称
电极反应
能量变换
电子流向
特征
可以相同可以不同
可以相同可以不同
电能→化学能
化学能→电能
有外接电源
本身是电源,外接用电器
负→阴 阳→正
负→导线→正
4.电解池与原电池的区别
正极:还原反应
负极:氧化反应
正负极由电极材料决定
活泼性较强的金属做负极
阴极:还原反应
阳极:氧化反应
阴阳极由外接电源决定
与电源负极相连的做阴极
与电源正极相连的做阳极
二次电池放电、充电过程关系图
放电
负极
正极
还原反应
—氧化反应
—阴极
—阳极
充电
—还原反应
氧化反应
——正极
——负极
(原电池)
(电解池)
外接电源
电极
电极反应
电极反应
电极
明确溶液中存在哪些离子
根据阳极氧化、阴极还原分析得出产物
判断阳极材料及阴阳两极附近离子种类及离子放电顺序
先电离
后电解
16
5.电极反应式的书写的一般思路
附:书写电解方程式的注意事项
(1)首先看阳极材料,若阳极是活性电极,阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
(2)找出溶液中所有离子
(3)按放电顺序写出阴阳极反应(注意三种守恒关系)
(4)加和得到总反应
(5)若有H+、OH-。由水电离产生的,则总反应中需将其变成H2O,所有总反应的条件均为电解 。
(1). 写出用石墨电极电解硫酸铜溶液的电极反应式及总反应式
(2). 写出用铜做电极电解硫酸铜溶液的电极反应式
阳极
4OH- - 4e- = 2H2O + O2↑
或 2H2O - 4e- = 4H+ + O2↑
阴极
2Cu2+ + 4e- = 2Cu
总反应式
2CuSO4+2H2O===2Cu+2H2SO4+O2↑
电解
阳极 ( Cu ):
阴极 ( Cu ):
Cu - 2e– = Cu2+
Cu2+ + 2e– = Cu
【课堂练习】
【课堂练习2】
分析下图,哪些是原电池,哪些是电解池?
①③⑤
⑥⑦
类型 实例 电极反应(均为惰性电极) 实际电解对象 电解质溶液浓度 溶液PH 电解质溶液复原
电解水型
电解电解质型
电解电解质和水型
H2SO4
NaOH
Na2SO4
H2O
增大
增大
增大
增大
减小
不变
加H2O
加H2O
加H2O
HCl
CuCl2
HCl
CuCl2
减小
减小
增大
增大
加HCl
加CuCl2
NaCl
CuSO4
电解质和水
部分离子浓度减小
部分离子浓度减小
增大
减小
加HCl
加CuO
或CuCO3
阳极:4OH--4e-=2H2O+O2↑
或 2H2O-4e-=4H++O2↑
阴极:4H++ 4e- =2H2 ↑
或2H2O+4e-= 2H2 ↑ +4OH-
阳: 2Cl--2e - =Cl2 ↑阴: 2H++ 2e - =H2 ↑
阳: 2Cl--2e - =Cl2 ↑阴: Cu 2++ 2e - = Cu
阳: 2Cl--2e - =Cl2 ↑阴: 2H++ 2e - =H2 ↑
阳: 4OH--4e- =2H2O+O2↑阴: 2Cu 2++ 4e- =2 Cu
6. 电解规律
电解质溶液恢复原状的方法:少什么加什么,少多少加多少。(一般是阳极产物和阴极产物组合形成的化合物)
A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变
阴极d:
阳极c:
2Cl– – 2e– =
Cu2+ + 2e– = Cu
C
【课堂练习3】 如右图是电解氯化铜溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
Cl2
↑
C
【课堂练习4】完成下列溶液的电极反应(以石墨为电极电解)
6 氢溴酸 7 FeCl3溶液
1 硝酸溶液 2 KOH溶液 3 NaNO3溶液
4 AgNO3溶液 5 KCl溶液
电解水型
电解电解质和水型
电解电解质本身型
【课堂练习5】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A.NaCl[盐酸] B.NaOH[H2O]
C.CuCl2[HCl] D.CuSO4[Cu(OH)2]
B
电解质溶液恢复原状的方法:少什么加什么,少多少加多少。(一般是阳极产物和阴极产物组合形成的化合物)
二. 电解原理的应用
1.电解饱和NaCl溶液
(氯碱工业)
两极材料:碳棒或其它惰性电极
NaCl == Na+ + Cl–
H2O == H+ + OH–
阴极:
阳极:
2Cl– – 2e– = Cl2↑
2H+ + 2e– = H2↑
2NaCl + 2H2O === 2NaOH + H2↑+ Cl2↑
总反应:
通电
阳极产物 Cl2 和阴极产物 NaOH(H2)如何检验?
阳极:
使湿润的KI淀粉试纸 变蓝
阴极:
滴入酚酞,溶液变红
–
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
浓NaOH溶液
精制饱和NaCl溶液
阳离子交换膜
阳 极
金属钛网
阴 极
碳钢网
阳极室
阴极室
电解饱和食盐水的原理示意图
稀NaOH溶液
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢 阳极:钛(惰性)
氯碱工业:离子交换膜法制烧碱
(2)离子交换膜的作用:
a、防止氢气和氯气混合而引起爆炸;
b、避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠 的产量。
只允许阳离子通过(Cl-、OH-离子和 气体不能通过),把电解槽隔成阴极室和阳极室。
阳离子交换膜:
原料的精制
粗盐的成分:
除杂的过程:
粗盐水
过量BaCl2
(除SO42-)
过量NaOH
(除Mg2+、Fe3+)
过量Na2CO3
(除Ca2+、Ba2+)
过滤
(除泥沙及沉淀)
含少量Ca2+、 Mg2+
阳离子交换塔
(除Ca2+、 Mg2+)
精制盐水
BaCl2必须在Na2CO3之前
适量HCl
(除CO32- 、OH-)
必须先过滤再加盐酸
泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,会与碱性物质反应产生沉淀,损坏离子交换膜.
含氯漂白剂
有机合成、造纸
玻璃、肥皂
纺织、印染
有机合成
氯化物合成
农药
金属冶炼
有机合成
HCl
盐酸
电解饱和食盐水
以氯碱工业为基础的化工生产
H2
NaOH
湿氯气
湿氢气
液碱
Cl2
思考:
利用电解原理,用铁、铜、硫酸铜溶液能否实现在铁上镀铜?怎样实现?
2、电镀
⑴ 定义:
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的方法。
⑵ 电镀材料的选择:
阴极
⑶ 装置:
铜
镀件
CuSO4溶液
阳极
阴极
(电镀铜)
阳极:
阴极:
Cu – 2e– = Cu2+
Cu2+ + 2e– = Cu
⑷ 电镀的特点:
电镀液的浓度不变。
阳极参加反应
——镀件(待镀金属)
阳极
—— 镀层金属
电镀液
——含有镀层金属离子的溶液
1. a 、b哪一极为正极?
2. 若要给铁叉镀银,
a极选用什么材料?
选择何种溶液?
【思考】
e–
–
+
阳极
阴极
a极选用Ag
3、电冶金
2Al2O3 (熔融) === 4Al + 3O2↑
通电
MgCl2 (熔融) == Mg + Cl2↑
2NaCl (熔融) == 2Na + Cl2↑
AlCl3 ?
MgO ?
为什么不电解钠、镁、铝的盐溶液?
通电
通电
冰晶石
盐溶液则相当于电解水中的H+得到氢气
电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重要的方法。例如:冶炼Na、Ca、Mg、Al等活泼的金属。
阳极
阴极
纯铜
粗铜
4、铜的电解精炼
粗铜:含杂质(Zn、Fe、Ni、Ag、Au 等)
阳极:
Zn – 2e– = Zn2+
Fe – 2e– = Fe2+
Ni – 2e– = Ni2+
Cu – 2e– = Cu2+
Zn
Fe
Ni
Cu
Ag
Au
阴极:
阳极泥
思考:电解完后,CuSO4溶液的浓度有何变化?
硫酸铜溶液
Cu2+ + 2e– = Cu
稍变小
若把阴极纯铜换成铁棒,电解过程变吗?
不变,但不是精炼铜了,而叫电镀铜。
第四章 电化学基础
第二节 电解池
与电源负极相连的电极产生氢气(H2)
与电源正极相连的电极产生氧气(O2)
回顾初中电解水的实验
H20
阴极:
阳极:
为提高溶液导电性,通常向水中加入什么物质提高电解速率?
+
-
电解水实验:
Na+
HCO3-
OH-
H+
Na+
CO32-
H+
OH-
OH-
H+
HCO3-
Na+
CO32-
CO32-
CO32-
比如在水中加入Na2CO3提高溶液导电性
阳极:
阴极:
+
-
Na+
HCO3-
OH-
H+
Na+
CO32-
H+
OH-
OH-
H+
HCO3-
Na+
CO32-
CO32-
CO32-
H2
H2
H2
O2
O2
O2
e-
e-
电解水实验:
阳极:
阴极:
阴极:
吸引溶液中的阳离子(Na+、H+)
OH-失电子——发生氧化反应
4OH-— 4e-=O2 ↑ + 2H2O
阳极:
吸引溶液中的阴离子(OH-、CO32-、HCO3-)
H+得电子——发生还原反应
总反应:
即:4H2O+4e-= 4OH-+2H2
H+来自于水的电离
OH-来自于水的电离
4H++4e- = 2H2↑
一、电解原理
对照下列问题进行探究:
(1)明确电解池的阴、阳极,辨别阳极材料(惰性电极还是活性电极)。
(2)通电前,溶液中有哪些离子 如何运动?
(3)通电后,电子的移动方向,离子的移动方向是怎样的?
(4)阴、阳两极各有什么现象?离子放电的先后顺序是怎样的?
(5)如何书写电极反应试和总反应式?
(6)电解质溶液浓度如何变化?溶液PH如何变化?
(7)电解过程中体系减少了什么?如何恢复原溶液?
(8)你能总结几种判断电解池阴极、阳极的方法?
实验探究:电极电解NaCl、CuSO4混合溶液
参看[实验4-2](教材P79)
盘点收获:
(1)明确电解池的阴、阳极,辨别阳极材料(惰性电极还是活性电极)。
(2)通电前,溶液中有哪些离子 如何运动?
(3)通电后,电子的移动方向,离子的移动方向是怎样的?
有Na+、CI—、Cu2+、SO42-、H+、OH—,作自由运动。
Na+、Cu2+、H+
阴极
阳极
CI—、SO42-、OH—
阳极是惰性电极
电子:电解池的阳极→电源的正极导线电源负极→电解池阴极。
离子:
实验探究:电极电解NaCl、CuSO4混合溶液
盘点收获:
(4)阴、阳两极各有什么现象?离子放电的先后顺序是怎样的?
(5)如何书写电极反应试和总反应式?
(6)电解质溶液浓度如何变化?溶液PH如何变化?
阴极(C):Cu2++2e-= Cu(还原反应)
阳极(C):2Cl—-2e-= Cl2↑(氧化反应)
总反应式:
CuCl2溶液浓度减小,溶液PH增大。
阴极:
产生黄绿色气体,淀粉KI试纸变蓝。
放电顺序:CI—>OH—、SO42-
阳极:
石墨棒上出现红色的固体物质。
放电顺序:Cu2+>H+、Na+
实验探究:电极电解NaCl、CuSO4混合溶液
实验探究:电极电解NaCl、CuSO4混合溶液
盘点收获:
(7)电解过程中体系减少了什么?如何恢复原溶液?
(8)你能总结几种判断电解池阴极、阳极的方法?
消耗溶质CuCl2
向电解后的溶液中加入一定质量的CuCl2固体即可恢复。
2.电解池电极判断方法:
方法1:看与电源的连接方式(与电源负极相连的是阴极)
(与电源正极相连的是阳极)
方法2:看电子流动方向(得到电子或电子流入的一极是阴极)
(失去电子或电子流出的一极是阳极)
方法3:看电流方向(电流流出的一极是阴极)
(电流流入的一极是阳极)
方法4:看离子移动方向(阳离子移向的一极是阴极)
(阴离子移向的一极是阳极)
方法5:看电极反应类型(化合价降低,发生还原反应的是阴极)
(化合价升高,发生氧化反应的是阳极)
方法6:看电极质量变化(电极材料质量增重是阴极)
(电极质量减轻是活泼电极材料,作阳极)
方法7:看电极产物的性质(生成还原性物质如H2、金属单质的是阴极)
(生成氧化性物质如O2、Cl2、I2等的是阳极)
思考与交流:
在电解NaCl、CuSO4溶液的实验中,阳离子Na+、Cu2+、H+向 极移动,但是首先在电极上析出了是 ,而不是 ,说明 ,如果Cu2+消耗完了,H+、Na+谁会放电呢?同样,在阳极上先析出的是 ,如果Cl-消耗完了,又会怎样呢?
阴
Cu
H2、Na
Cu2+比H+、Na+先放电
Cl2
离子的放电顺序
①阴极:(阳离子在阴极上按放电顺序得电子被还原,不考虑电极材料)
水溶液中只考虑此部分
浓度很大时排在H+(酸电离)前面
在水溶液中不放电,只在熔融状态下放电。
3.物质(离子)在电解过程中的放电顺序(总结提升)
Ag+>Hg2+>Fe3+>Cu2+>H+(酸电离)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水电离) >Al3+>Mg2+>Na+>Ca2+>K+
②阳极:(要分析电极材料)
a.活性电极(活泼金属)作阳极时:电极本身放电(溶解)。
b.惰性电极(C、Pt、Au等)作阳极时:阴离子在阳极上按放电顺序失电子被氧化。
放电顺序:活性阳极(金属)>S2->I->Br->Cl->OH->含氧酸根>F-
阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根>F-
水溶液中只考虑此部分
注意:在溶液中含氧酸根离子不放电,常指最高价(中心原子)含氧酸根离子不放电,但非最高价(中心原子)含氧酸根离子的放电能力比OH-的强,如SO32—、MnO42—等。
电解池 原电池
电极材料
电极名称
电极反应
能量变换
电子流向
特征
可以相同可以不同
可以相同可以不同
电能→化学能
化学能→电能
有外接电源
本身是电源,外接用电器
负→阴 阳→正
负→导线→正
4.电解池与原电池的区别
正极:还原反应
负极:氧化反应
正负极由电极材料决定
活泼性较强的金属做负极
阴极:还原反应
阳极:氧化反应
阴阳极由外接电源决定
与电源负极相连的做阴极
与电源正极相连的做阳极
二次电池放电、充电过程关系图
放电
负极
正极
还原反应
—氧化反应
—阴极
—阳极
充电
—还原反应
氧化反应
——正极
——负极
(原电池)
(电解池)
外接电源
电极
电极反应
电极反应
电极
明确溶液中存在哪些离子
根据阳极氧化、阴极还原分析得出产物
判断阳极材料及阴阳两极附近离子种类及离子放电顺序
先电离
后电解
16
5.电极反应式的书写的一般思路
附:书写电解方程式的注意事项
(1)首先看阳极材料,若阳极是活性电极,阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
(2)找出溶液中所有离子
(3)按放电顺序写出阴阳极反应(注意三种守恒关系)
(4)加和得到总反应
(5)若有H+、OH-。由水电离产生的,则总反应中需将其变成H2O,所有总反应的条件均为电解 。
(1). 写出用石墨电极电解硫酸铜溶液的电极反应式及总反应式
(2). 写出用铜做电极电解硫酸铜溶液的电极反应式
阳极
4OH- - 4e- = 2H2O + O2↑
或 2H2O - 4e- = 4H+ + O2↑
阴极
2Cu2+ + 4e- = 2Cu
总反应式
2CuSO4+2H2O===2Cu+2H2SO4+O2↑
电解
阳极 ( Cu ):
阴极 ( Cu ):
Cu - 2e– = Cu2+
Cu2+ + 2e– = Cu
【课堂练习】
【课堂练习2】
分析下图,哪些是原电池,哪些是电解池?
①③⑤
⑥⑦
类型 实例 电极反应(均为惰性电极) 实际电解对象 电解质溶液浓度 溶液PH 电解质溶液复原
电解水型
电解电解质型
电解电解质和水型
H2SO4
NaOH
Na2SO4
H2O
增大
增大
增大
增大
减小
不变
加H2O
加H2O
加H2O
HCl
CuCl2
HCl
CuCl2
减小
减小
增大
增大
加HCl
加CuCl2
NaCl
CuSO4
电解质和水
部分离子浓度减小
部分离子浓度减小
增大
减小
加HCl
加CuO
或CuCO3
阳极:4OH--4e-=2H2O+O2↑
或 2H2O-4e-=4H++O2↑
阴极:4H++ 4e- =2H2 ↑
或2H2O+4e-= 2H2 ↑ +4OH-
阳: 2Cl--2e - =Cl2 ↑阴: 2H++ 2e - =H2 ↑
阳: 2Cl--2e - =Cl2 ↑阴: Cu 2++ 2e - = Cu
阳: 2Cl--2e - =Cl2 ↑阴: 2H++ 2e - =H2 ↑
阳: 4OH--4e- =2H2O+O2↑阴: 2Cu 2++ 4e- =2 Cu
6. 电解规律
电解质溶液恢复原状的方法:少什么加什么,少多少加多少。(一般是阳极产物和阴极产物组合形成的化合物)
A、a为负极,b为正极 B、a为阳极,b为阴极 C、电解过程中,d电极质量增加 D、电解过程中,氯离子浓度不变
阴极d:
阳极c:
2Cl– – 2e– =
Cu2+ + 2e– = Cu
C
【课堂练习3】 如右图是电解氯化铜溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
Cl2
↑
C
【课堂练习4】完成下列溶液的电极反应(以石墨为电极电解)
6 氢溴酸 7 FeCl3溶液
1 硝酸溶液 2 KOH溶液 3 NaNO3溶液
4 AgNO3溶液 5 KCl溶液
电解水型
电解电解质和水型
电解电解质本身型
【课堂练习5】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A.NaCl[盐酸] B.NaOH[H2O]
C.CuCl2[HCl] D.CuSO4[Cu(OH)2]
B
电解质溶液恢复原状的方法:少什么加什么,少多少加多少。(一般是阳极产物和阴极产物组合形成的化合物)
二. 电解原理的应用
1.电解饱和NaCl溶液
(氯碱工业)
两极材料:碳棒或其它惰性电极
NaCl == Na+ + Cl–
H2O == H+ + OH–
阴极:
阳极:
2Cl– – 2e– = Cl2↑
2H+ + 2e– = H2↑
2NaCl + 2H2O === 2NaOH + H2↑+ Cl2↑
总反应:
通电
阳极产物 Cl2 和阴极产物 NaOH(H2)如何检验?
阳极:
使湿润的KI淀粉试纸 变蓝
阴极:
滴入酚酞,溶液变红
–
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
浓NaOH溶液
精制饱和NaCl溶液
阳离子交换膜
阳 极
金属钛网
阴 极
碳钢网
阳极室
阴极室
电解饱和食盐水的原理示意图
稀NaOH溶液
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢 阳极:钛(惰性)
氯碱工业:离子交换膜法制烧碱
(2)离子交换膜的作用:
a、防止氢气和氯气混合而引起爆炸;
b、避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠 的产量。
只允许阳离子通过(Cl-、OH-离子和 气体不能通过),把电解槽隔成阴极室和阳极室。
阳离子交换膜:
原料的精制
粗盐的成分:
除杂的过程:
粗盐水
过量BaCl2
(除SO42-)
过量NaOH
(除Mg2+、Fe3+)
过量Na2CO3
(除Ca2+、Ba2+)
过滤
(除泥沙及沉淀)
含少量Ca2+、 Mg2+
阳离子交换塔
(除Ca2+、 Mg2+)
精制盐水
BaCl2必须在Na2CO3之前
适量HCl
(除CO32- 、OH-)
必须先过滤再加盐酸
泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,会与碱性物质反应产生沉淀,损坏离子交换膜.
含氯漂白剂
有机合成、造纸
玻璃、肥皂
纺织、印染
有机合成
氯化物合成
农药
金属冶炼
有机合成
HCl
盐酸
电解饱和食盐水
以氯碱工业为基础的化工生产
H2
NaOH
湿氯气
湿氢气
液碱
Cl2
思考:
利用电解原理,用铁、铜、硫酸铜溶液能否实现在铁上镀铜?怎样实现?
2、电镀
⑴ 定义:
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的方法。
⑵ 电镀材料的选择:
阴极
⑶ 装置:
铜
镀件
CuSO4溶液
阳极
阴极
(电镀铜)
阳极:
阴极:
Cu – 2e– = Cu2+
Cu2+ + 2e– = Cu
⑷ 电镀的特点:
电镀液的浓度不变。
阳极参加反应
——镀件(待镀金属)
阳极
—— 镀层金属
电镀液
——含有镀层金属离子的溶液
1. a 、b哪一极为正极?
2. 若要给铁叉镀银,
a极选用什么材料?
选择何种溶液?
【思考】
e–
–
+
阳极
阴极
a极选用Ag
3、电冶金
2Al2O3 (熔融) === 4Al + 3O2↑
通电
MgCl2 (熔融) == Mg + Cl2↑
2NaCl (熔融) == 2Na + Cl2↑
AlCl3 ?
MgO ?
为什么不电解钠、镁、铝的盐溶液?
通电
通电
冰晶石
盐溶液则相当于电解水中的H+得到氢气
电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重要的方法。例如:冶炼Na、Ca、Mg、Al等活泼的金属。
阳极
阴极
纯铜
粗铜
4、铜的电解精炼
粗铜:含杂质(Zn、Fe、Ni、Ag、Au 等)
阳极:
Zn – 2e– = Zn2+
Fe – 2e– = Fe2+
Ni – 2e– = Ni2+
Cu – 2e– = Cu2+
Zn
Fe
Ni
Cu
Ag
Au
阴极:
阳极泥
思考:电解完后,CuSO4溶液的浓度有何变化?
硫酸铜溶液
Cu2+ + 2e– = Cu
稍变小
若把阴极纯铜换成铁棒,电解过程变吗?
不变,但不是精炼铜了,而叫电镀铜。
