海南省部分学校2023-2024学年高一下学期7月期末考试 化学试题(PDF版含答案 )
文档属性
| 名称 | 海南省部分学校2023-2024学年高一下学期7月期末考试 化学试题(PDF版含答案 ) |  | |
| 格式 | |||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-02 15:41:30 | ||
图片预览


文档简介
海南省部分学校 2023-2024学年高一下学期 7月期末联考
化学试题
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在
答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试
卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Fe 56 Zn 65 Ba 137
一、选择题:本题共 8小题,每小题 2分,共 16分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1. CO甲醇是一种“绿色”燃料,其在合成、消耗过程中 2的量实现零增长,碳循环过程如图所示。下列说
法正确的是
A. CO2、CH3OH均属于有机物
B. 制H2 过程中,电能转化为化学能
C. 合成CH3OH的反应中原子利用率为 100%
D. CH3OH分子中含有非极性键
2. 131I 13553 、 53 I
131 135
具有放射性,在医药上用于治疗肿瘤。下列关于 53 I、 53 I的说法正确的是
A. 131I 135 I B. 13153 、 53 互为同素异形体 53 I的质量数是 53
C. 13553 I
135
的中子数是 82 D. 53 I的电子数是 188
3. 实验室用 Zn与稀硫酸反应制H2 : Zn H2SO4=ZnSO4 H2 ,反应过程中的能量变化如图所示。下
列说法正确的是
A. 该反应是吸热反应
B. 1molZn 的能量大于 1molH2 的能量
C. 若有 32.5gZn 参加反应时,可收集到 11.2LH2
D. 可利用该反应设计成原电池,将化学能转化为电能
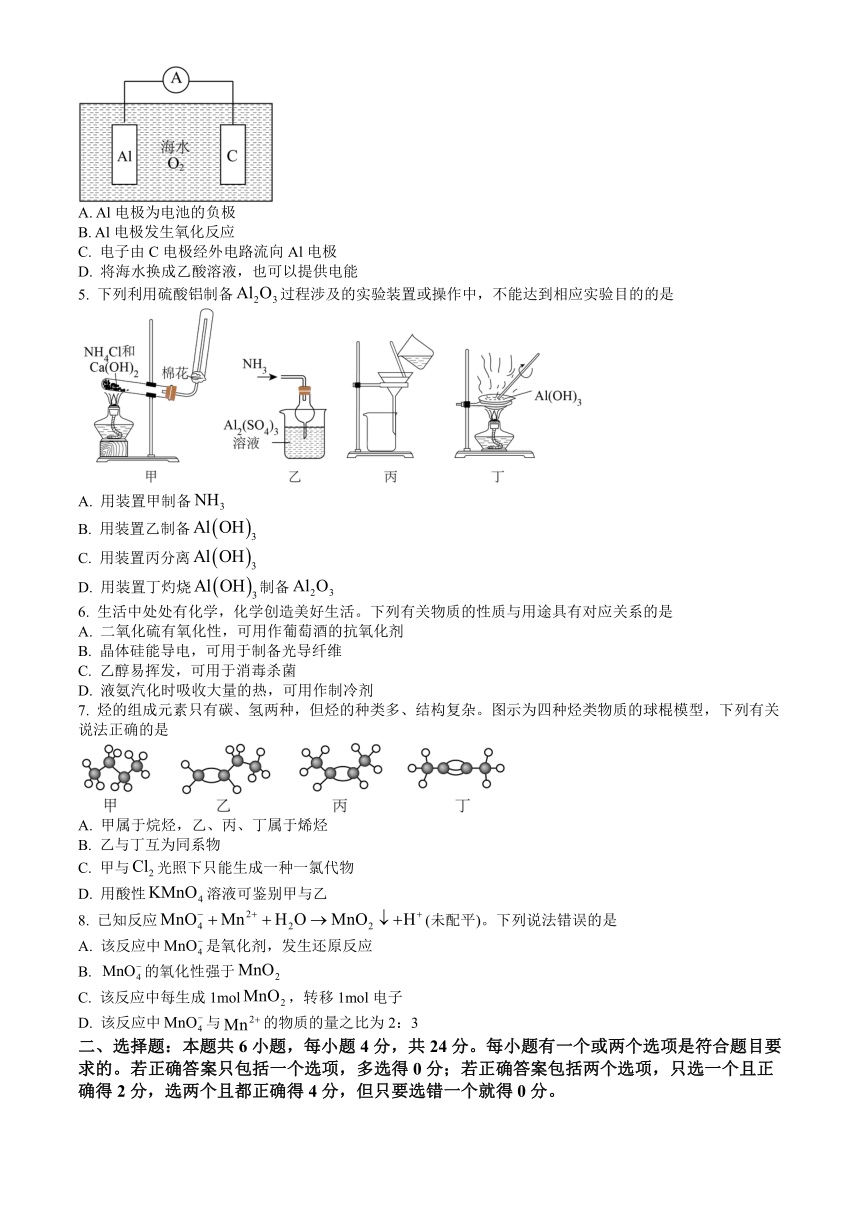
4. 铝-空气-海水电池可以作为航海指示灯的电源,电池总反应为 4Al 3O2 6H2O=4Al OH 3。工作原
理如图所示,下列说法错误的是
A. Al电极为电池的负极
B. Al电极发生氧化反应
C. 电子由 C电极经外电路流向 Al电极
D. 将海水换成乙酸溶液,也可以提供电能
5. 下列利用硫酸铝制备Al2O3过程涉及的实验装置或操作中,不能达到相应实验目的的是
A. 用装置甲制备NH3
B. 用装置乙制备Al OH 3
C. 用装置丙分离Al OH 3
D. 用装置丁灼烧Al OH 3制备Al2O3
6. 生活中处处有化学,化学创造美好生活。下列有关物质的性质与用途具有对应关系的是
A. 二氧化硫有氧化性,可用作葡萄酒的抗氧化剂
B. 晶体硅能导电,可用于制备光导纤维
C. 乙醇易挥发,可用于消毒杀菌
D. 液氨汽化时吸收大量的热,可用作制冷剂
7. 烃的组成元素只有碳、氢两种,但烃的种类多、结构复杂。图示为四种烃类物质的球棍模型,下列有关
说法正确的是
A. 甲属于烷烃,乙、丙、丁属于烯烃
B. 乙与丁互为同系物
C. 甲与Cl2光照下只能生成一种一氯代物
D. 用酸性KMnO4 溶液可鉴别甲与乙
8. 2 已知反应MnO4 Mn H2O MnO2 H (未配平)。下列说法错误的是
A. 该反应中MnO 4 是氧化剂,发生还原反应
B. MnO 4 的氧化性强于MnO2
C. 该反应中每生成 1molMnO2,转移 1mol电子
D. 该反应中MnO 2 4 与Mn 的物质的量之比为 2:3
二、选择题:本题共 6小题,每小题 4分,共 24分。每小题有一个或两个选项是符合题目要
求的。若正确答案只包括一个选项,多选得 0分;若正确答案包括两个选项,只选一个且正
确得 2分,选两个且都正确得 4分,但只要选错一个就得 0分。
9. 化学是以实验为基础的科学。根据下列实验操作和现象所得到的结论正确的是
选
实验操作和现象 结论
项
A 向酸性KMnO4 溶液中滴加无水乙醇,溶液红色褪去 乙醇发生氧化反应
该溶液中一定含有
B 向某溶液中滴加BaCl2溶液,产生白色沉淀 SO2 4
C 向0.1mol L 1HCl溶液中加入少量镁粉,测得溶液温度升高 镁与盐酸的反应放热
D 向水解后的淀粉溶液中加入过量 NaOH溶液中和,滴加几滴碘水,溶液不 淀粉完全水解
变蓝
A. A B. B C. C D. D
10. 短周期主族元素 X、Y、Z、W的原子序数依次增大,元素 X形成的化合物种类最多;Y和W位于同一
主族,W的最高正化合价与最低负化合价的代数和为 4;Z是地壳中含量最多的金属元素。下列说法正确的
是
A. 原子半径:W>Z>Y
B. 简单氢化物的热稳定性:Y>W
C. 元素 X的所有气态氢化物都稳定,都不能被酸性KMnO4 溶液氧化
D. 工业上常用热还原法制备 Z的单质
11. 在 2L恒温恒容密闭容器中充入 2molN2和 3molH2 ,发生催化反应:
N2 g 3H2 g
高温、高压
2NH3 g 。测得N2和H2 的转化率随时间的变化如图所示。下列说法正确催化剂
的是
A. 6min时,NH3的生成速率小于其分解速率
B. 0~6min内,NH 的平均反应速率为0.05mol L 1 13 min
C. 使用催化剂可缩短反应到达平衡时所需的时间
D. 若反应中通入足量的N2,可使H2 完全转化为NH3
12. 硫和氮两种元素既是重要的工业元素,也是生命物质的重要组成元素。下列能正确描述硫、氮化合物性
质的离子方程式是
A. 氨水与 FeCl 3 3溶液反应制备Fe OH : Fe 3OH Fe3 OH 3
B. NO2溶于水生成HNO3 : NO2 H2O 2H
NO 3
C. 2 向氯水中通入 SO2,溶液褪色:SO2 Cl2 2H2O 4H 2Cl SO4
D. Cu Cu 2H Cu 2 将 溶于稀硝酸中: H 2
13. 具有相同官能团的有机物性质相似。某有机物的结构简式为HOCH2CH CHCOOH,下列关于该有
机物的说法正确的是
A. 该有机物只含有两种官能团
B. 该有机物能使溴的四氯化碳溶液褪色
C. 1mol该有机物与足量 Na反应生成 0.5molH2
D. 一定条件下,该有机物能与乙醇或乙酸发生酯化反应
14. 工业上含SO2的尾气和含Cr 2 3+2O7 的废水可通过Fe 循环处理吸收,其反应原理如图所示。下列说法正
确的是
A. 该循环过程中Fe3+ 为催化剂
B. 由该循环过程可知,若直接用Cr O2 2 7 不能氧化SO2
C. 该循环过程中每处理 1molCr O2 2 7 ,可同时处理 3molSO2
D. 第②步中,1molCr 2 2O7 参加反应时转移 3mol电子
三、非选择题:本题共 5小题,共 60分。
15. 短周期元素 X、Y、Z、W、M的原子序数依次增大。元素M的单质通常为黄绿色气体。元素 X与W
的原子核外均有一个价电子,能形成离子化合物WX。X可分别与 Y、Z形成 10电子分子甲和乙,乙的水
溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为___________。
(2)甲与M的单质在光照下发生反应的反应类型为___________。
(3)化合物WX与水反应的化学方程式为___________。
(4)X与 Z可形成 10电子分子乙,也可形成 10电子阳离子丙,阳离子丙的电子式为___________。
(5)M的单质与化合物乙反应生成白色固体和 Z的单质,该白色固体属于___________(填“离子化合物”
或“共价化合物”)。
(6)化合物ZM3与H2O反应生成一种具有漂白性的酸和乙,写出该反应的化学方程式:___________。
16. 甲烷水蒸气催化重整是制备高纯氢的方法之一,反应原理之一为
CH4 g 2H2O g 4H2 g CO2 g 。
(1)已知:一定条件下断开 1mol气态物质中的化学键吸收的能量或形成 1mol气态物质中的化学键放出的
能量数据如下表:
物质 H2 H2O CH4 CO2
E/ kJ mol 1 436 924 1652 1490
该催化重整反应断开反应物中的化学键吸收的能量___________(填“大于”或“小于”)形成生成物中的化
学键放出的能量,该反应为___________(填“放热”或“吸热”)反应。
(2)在容积为 2L的恒温恒容密闭容器中充入 1molCH4 g 和 2molH2O g ,发生上述反应,CH4 和CO2
的物质的量随时间的变化关系如图所示。
①图中 a=___________,3min时,H2O的转化率为___________。
②该温度下达到平衡时,混合气体中 n H2 ___________mol,此时体系压强与开始时的压强之比为
___________(填最简整数比)。
③下列叙述正确的是___________(填字母)。
a.3min时,CH4 的生成速率等于其消耗速率
b.由 c H2 保持不变可判断该反应达到平衡状态
c.当 4v CH4 v H2 时,该反应一定达到平衡状态
d.图中 b点的正反应速率大于 c点的逆反应速率
④其他条件不变时,下列措施可以加快该反应速率的是___________(填字母)。
a.升高温度 b.增大甲烷的浓度
c.将容器的容积变为 4L d.恒容条件下充入一定量的N2
17. FeSO4可用作还原剂等,在不同温度下分解产物不同,高温下发生分解反应:
高温
2FeSO4 Fe2O3 SO2 SO3 。某小组设计如图所示装置验证无水FeSO4受热分解发生上述反应
及生成物中SO2、SO3的物质的量之比。
已知:①标准状况下SO3是一种无色晶体,其熔点为 16.8℃,沸点为 44.8℃。
②无水硫酸亚铁是白色粉末。
请回答下列问题:
(1)装置 A中的现象为___________。
(2)反应前后均需要通入N2,反应后通N2的目的是___________。
(3)装置 B中冰水浴的作用是___________。
(4)装置 C中发生反应的离子方程式是___________。
(5)经测定装置 B中试管增加的质量为 1.60g,装置 C中生成沉淀的质量为 6.99g,由实验数据可得
n SO2 : n SO3 ___________。该小组经检查实验装置和试剂都符合实验要求,试分析实验数据与方程
式中的定量关系不相符合的原因有___________(填一条)。
18. 丙烯酸乙酯天然存在于菠萝等水果中,也是一种食用合成香料。由 A、C为原料合成丙烯酸乙酯的路线
如图所示:
(1)淀粉的分子式为___________;葡萄糖经酒化酶作用得到的乙醇浓度通常较低,提高其浓度需采取的
操作名称为___________。
(2)有机物 C的结构简式为___________,C中官能团的名称为___________。
(3)A→B的反应类型为___________。
(4)B与 C反应生成丙烯酸乙酯的化学方程式为___________。
(5)D是加聚反应得到的高分子,其结构简式为___________。
19. 自然资源是人类社会发展不可或缺的物质基础。设计合理的物质生产流程,始终是化学面对的重要课题。
Ⅰ.海水资源丰富,开发与利用海水资源具有广阔的前景。实验室模拟从海水中提取Mg的流程如图所示:
(1)实验室粗盐提纯过程中需要用到下列仪器中的___________(填字母)。
(2)工业上沉镁过程中常用氢氧化钙而不用氢氧化钠的原因是___________。
(3)反应②是___________(填“放热”或“吸热”)反应,该反应的离子方程式为___________。
(4)工业上用无水MgCl2制取Mg的化学方程式为___________。
Ⅱ.Cu2O主要用于制造船底防污漆、杀虫剂、各种铜盐以及分析试剂等,其有关制备途径如图所示:
(5)途径Ⅰ、Ⅱ比较,符合绿色化学思想的是途径___________(填“Ⅰ”或“Ⅱ”)。
(6)X可以是单糖,由生成Cu2O推测 X中含有的官能团名称为___________。
(7)Cu经途径Ⅰ发生反应的化学方程式为___________。
参考答案
1. B
2. C
3. D
4. C
5. D
6. D
7. D
8. C
9. AC
10. B
11. BC
12. C
13. BD
14. AC
15. (1)第三周期 VIIA族
(2)取代反应
(3)NaH+H2O=NaOH+H2
(4)
(5)离子化合物
(6)NCl3+3H2O=3HClO+NH3
16. (1) 大于 吸热
(2)①. 0.2 ②. 50% ③. 3.2 ④. 23:15 ⑤. bd ⑥. ab
17. (1)固体由白色变为红棕色
(2)使生成的SO3、SO2全部被收集或吸收
(3)冷却收集SO3
(4)Ba2++H2O2+SO2=BaSO4↓+2H+
(5) 3:2 气流速率过快,装置 B中SO3冷却不完全,SO3在装置 C中反应生成 BaSO4
18. (1) C6H10O5 n 蒸馏
(2) CH2 CHCOOH 碳碳双键、羧基
(3)加成反应
(4)CH2 CHCOOH C2H5OH
浓硫酸
CH2 CHCOOC2H5 H2O
(5)
19. (1)BD
(2)NaOH价格较贵,氢氧化钙廉价易得
(3) 放热 Mg(OH)2+2H+=Mg2++2H2O
(4 电解)MgCl2(熔融) Mg+Cl2↑
(5)Ⅱ
(6)醛基
7 Cu+2H SO ( ) ( ) 2 4 浓 CuSO4+SO2↑+2H2O
化学试题
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在
答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试
卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Fe 56 Zn 65 Ba 137
一、选择题:本题共 8小题,每小题 2分,共 16分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1. CO甲醇是一种“绿色”燃料,其在合成、消耗过程中 2的量实现零增长,碳循环过程如图所示。下列说
法正确的是
A. CO2、CH3OH均属于有机物
B. 制H2 过程中,电能转化为化学能
C. 合成CH3OH的反应中原子利用率为 100%
D. CH3OH分子中含有非极性键
2. 131I 13553 、 53 I
131 135
具有放射性,在医药上用于治疗肿瘤。下列关于 53 I、 53 I的说法正确的是
A. 131I 135 I B. 13153 、 53 互为同素异形体 53 I的质量数是 53
C. 13553 I
135
的中子数是 82 D. 53 I的电子数是 188
3. 实验室用 Zn与稀硫酸反应制H2 : Zn H2SO4=ZnSO4 H2 ,反应过程中的能量变化如图所示。下
列说法正确的是
A. 该反应是吸热反应
B. 1molZn 的能量大于 1molH2 的能量
C. 若有 32.5gZn 参加反应时,可收集到 11.2LH2
D. 可利用该反应设计成原电池,将化学能转化为电能
4. 铝-空气-海水电池可以作为航海指示灯的电源,电池总反应为 4Al 3O2 6H2O=4Al OH 3。工作原
理如图所示,下列说法错误的是
A. Al电极为电池的负极
B. Al电极发生氧化反应
C. 电子由 C电极经外电路流向 Al电极
D. 将海水换成乙酸溶液,也可以提供电能
5. 下列利用硫酸铝制备Al2O3过程涉及的实验装置或操作中,不能达到相应实验目的的是
A. 用装置甲制备NH3
B. 用装置乙制备Al OH 3
C. 用装置丙分离Al OH 3
D. 用装置丁灼烧Al OH 3制备Al2O3
6. 生活中处处有化学,化学创造美好生活。下列有关物质的性质与用途具有对应关系的是
A. 二氧化硫有氧化性,可用作葡萄酒的抗氧化剂
B. 晶体硅能导电,可用于制备光导纤维
C. 乙醇易挥发,可用于消毒杀菌
D. 液氨汽化时吸收大量的热,可用作制冷剂
7. 烃的组成元素只有碳、氢两种,但烃的种类多、结构复杂。图示为四种烃类物质的球棍模型,下列有关
说法正确的是
A. 甲属于烷烃,乙、丙、丁属于烯烃
B. 乙与丁互为同系物
C. 甲与Cl2光照下只能生成一种一氯代物
D. 用酸性KMnO4 溶液可鉴别甲与乙
8. 2 已知反应MnO4 Mn H2O MnO2 H (未配平)。下列说法错误的是
A. 该反应中MnO 4 是氧化剂,发生还原反应
B. MnO 4 的氧化性强于MnO2
C. 该反应中每生成 1molMnO2,转移 1mol电子
D. 该反应中MnO 2 4 与Mn 的物质的量之比为 2:3
二、选择题:本题共 6小题,每小题 4分,共 24分。每小题有一个或两个选项是符合题目要
求的。若正确答案只包括一个选项,多选得 0分;若正确答案包括两个选项,只选一个且正
确得 2分,选两个且都正确得 4分,但只要选错一个就得 0分。
9. 化学是以实验为基础的科学。根据下列实验操作和现象所得到的结论正确的是
选
实验操作和现象 结论
项
A 向酸性KMnO4 溶液中滴加无水乙醇,溶液红色褪去 乙醇发生氧化反应
该溶液中一定含有
B 向某溶液中滴加BaCl2溶液,产生白色沉淀 SO2 4
C 向0.1mol L 1HCl溶液中加入少量镁粉,测得溶液温度升高 镁与盐酸的反应放热
D 向水解后的淀粉溶液中加入过量 NaOH溶液中和,滴加几滴碘水,溶液不 淀粉完全水解
变蓝
A. A B. B C. C D. D
10. 短周期主族元素 X、Y、Z、W的原子序数依次增大,元素 X形成的化合物种类最多;Y和W位于同一
主族,W的最高正化合价与最低负化合价的代数和为 4;Z是地壳中含量最多的金属元素。下列说法正确的
是
A. 原子半径:W>Z>Y
B. 简单氢化物的热稳定性:Y>W
C. 元素 X的所有气态氢化物都稳定,都不能被酸性KMnO4 溶液氧化
D. 工业上常用热还原法制备 Z的单质
11. 在 2L恒温恒容密闭容器中充入 2molN2和 3molH2 ,发生催化反应:
N2 g 3H2 g
高温、高压
2NH3 g 。测得N2和H2 的转化率随时间的变化如图所示。下列说法正确催化剂
的是
A. 6min时,NH3的生成速率小于其分解速率
B. 0~6min内,NH 的平均反应速率为0.05mol L 1 13 min
C. 使用催化剂可缩短反应到达平衡时所需的时间
D. 若反应中通入足量的N2,可使H2 完全转化为NH3
12. 硫和氮两种元素既是重要的工业元素,也是生命物质的重要组成元素。下列能正确描述硫、氮化合物性
质的离子方程式是
A. 氨水与 FeCl 3 3溶液反应制备Fe OH : Fe 3OH Fe3 OH 3
B. NO2溶于水生成HNO3 : NO2 H2O 2H
NO 3
C. 2 向氯水中通入 SO2,溶液褪色:SO2 Cl2 2H2O 4H 2Cl SO4
D. Cu Cu 2H Cu 2 将 溶于稀硝酸中: H 2
13. 具有相同官能团的有机物性质相似。某有机物的结构简式为HOCH2CH CHCOOH,下列关于该有
机物的说法正确的是
A. 该有机物只含有两种官能团
B. 该有机物能使溴的四氯化碳溶液褪色
C. 1mol该有机物与足量 Na反应生成 0.5molH2
D. 一定条件下,该有机物能与乙醇或乙酸发生酯化反应
14. 工业上含SO2的尾气和含Cr 2 3+2O7 的废水可通过Fe 循环处理吸收,其反应原理如图所示。下列说法正
确的是
A. 该循环过程中Fe3+ 为催化剂
B. 由该循环过程可知,若直接用Cr O2 2 7 不能氧化SO2
C. 该循环过程中每处理 1molCr O2 2 7 ,可同时处理 3molSO2
D. 第②步中,1molCr 2 2O7 参加反应时转移 3mol电子
三、非选择题:本题共 5小题,共 60分。
15. 短周期元素 X、Y、Z、W、M的原子序数依次增大。元素M的单质通常为黄绿色气体。元素 X与W
的原子核外均有一个价电子,能形成离子化合物WX。X可分别与 Y、Z形成 10电子分子甲和乙,乙的水
溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为___________。
(2)甲与M的单质在光照下发生反应的反应类型为___________。
(3)化合物WX与水反应的化学方程式为___________。
(4)X与 Z可形成 10电子分子乙,也可形成 10电子阳离子丙,阳离子丙的电子式为___________。
(5)M的单质与化合物乙反应生成白色固体和 Z的单质,该白色固体属于___________(填“离子化合物”
或“共价化合物”)。
(6)化合物ZM3与H2O反应生成一种具有漂白性的酸和乙,写出该反应的化学方程式:___________。
16. 甲烷水蒸气催化重整是制备高纯氢的方法之一,反应原理之一为
CH4 g 2H2O g 4H2 g CO2 g 。
(1)已知:一定条件下断开 1mol气态物质中的化学键吸收的能量或形成 1mol气态物质中的化学键放出的
能量数据如下表:
物质 H2 H2O CH4 CO2
E/ kJ mol 1 436 924 1652 1490
该催化重整反应断开反应物中的化学键吸收的能量___________(填“大于”或“小于”)形成生成物中的化
学键放出的能量,该反应为___________(填“放热”或“吸热”)反应。
(2)在容积为 2L的恒温恒容密闭容器中充入 1molCH4 g 和 2molH2O g ,发生上述反应,CH4 和CO2
的物质的量随时间的变化关系如图所示。
①图中 a=___________,3min时,H2O的转化率为___________。
②该温度下达到平衡时,混合气体中 n H2 ___________mol,此时体系压强与开始时的压强之比为
___________(填最简整数比)。
③下列叙述正确的是___________(填字母)。
a.3min时,CH4 的生成速率等于其消耗速率
b.由 c H2 保持不变可判断该反应达到平衡状态
c.当 4v CH4 v H2 时,该反应一定达到平衡状态
d.图中 b点的正反应速率大于 c点的逆反应速率
④其他条件不变时,下列措施可以加快该反应速率的是___________(填字母)。
a.升高温度 b.增大甲烷的浓度
c.将容器的容积变为 4L d.恒容条件下充入一定量的N2
17. FeSO4可用作还原剂等,在不同温度下分解产物不同,高温下发生分解反应:
高温
2FeSO4 Fe2O3 SO2 SO3 。某小组设计如图所示装置验证无水FeSO4受热分解发生上述反应
及生成物中SO2、SO3的物质的量之比。
已知:①标准状况下SO3是一种无色晶体,其熔点为 16.8℃,沸点为 44.8℃。
②无水硫酸亚铁是白色粉末。
请回答下列问题:
(1)装置 A中的现象为___________。
(2)反应前后均需要通入N2,反应后通N2的目的是___________。
(3)装置 B中冰水浴的作用是___________。
(4)装置 C中发生反应的离子方程式是___________。
(5)经测定装置 B中试管增加的质量为 1.60g,装置 C中生成沉淀的质量为 6.99g,由实验数据可得
n SO2 : n SO3 ___________。该小组经检查实验装置和试剂都符合实验要求,试分析实验数据与方程
式中的定量关系不相符合的原因有___________(填一条)。
18. 丙烯酸乙酯天然存在于菠萝等水果中,也是一种食用合成香料。由 A、C为原料合成丙烯酸乙酯的路线
如图所示:
(1)淀粉的分子式为___________;葡萄糖经酒化酶作用得到的乙醇浓度通常较低,提高其浓度需采取的
操作名称为___________。
(2)有机物 C的结构简式为___________,C中官能团的名称为___________。
(3)A→B的反应类型为___________。
(4)B与 C反应生成丙烯酸乙酯的化学方程式为___________。
(5)D是加聚反应得到的高分子,其结构简式为___________。
19. 自然资源是人类社会发展不可或缺的物质基础。设计合理的物质生产流程,始终是化学面对的重要课题。
Ⅰ.海水资源丰富,开发与利用海水资源具有广阔的前景。实验室模拟从海水中提取Mg的流程如图所示:
(1)实验室粗盐提纯过程中需要用到下列仪器中的___________(填字母)。
(2)工业上沉镁过程中常用氢氧化钙而不用氢氧化钠的原因是___________。
(3)反应②是___________(填“放热”或“吸热”)反应,该反应的离子方程式为___________。
(4)工业上用无水MgCl2制取Mg的化学方程式为___________。
Ⅱ.Cu2O主要用于制造船底防污漆、杀虫剂、各种铜盐以及分析试剂等,其有关制备途径如图所示:
(5)途径Ⅰ、Ⅱ比较,符合绿色化学思想的是途径___________(填“Ⅰ”或“Ⅱ”)。
(6)X可以是单糖,由生成Cu2O推测 X中含有的官能团名称为___________。
(7)Cu经途径Ⅰ发生反应的化学方程式为___________。
参考答案
1. B
2. C
3. D
4. C
5. D
6. D
7. D
8. C
9. AC
10. B
11. BC
12. C
13. BD
14. AC
15. (1)第三周期 VIIA族
(2)取代反应
(3)NaH+H2O=NaOH+H2
(4)
(5)离子化合物
(6)NCl3+3H2O=3HClO+NH3
16. (1) 大于 吸热
(2)①. 0.2 ②. 50% ③. 3.2 ④. 23:15 ⑤. bd ⑥. ab
17. (1)固体由白色变为红棕色
(2)使生成的SO3、SO2全部被收集或吸收
(3)冷却收集SO3
(4)Ba2++H2O2+SO2=BaSO4↓+2H+
(5) 3:2 气流速率过快,装置 B中SO3冷却不完全,SO3在装置 C中反应生成 BaSO4
18. (1) C6H10O5 n 蒸馏
(2) CH2 CHCOOH 碳碳双键、羧基
(3)加成反应
(4)CH2 CHCOOH C2H5OH
浓硫酸
CH2 CHCOOC2H5 H2O
(5)
19. (1)BD
(2)NaOH价格较贵,氢氧化钙廉价易得
(3) 放热 Mg(OH)2+2H+=Mg2++2H2O
(4 电解)MgCl2(熔融) Mg+Cl2↑
(5)Ⅱ
(6)醛基
7 Cu+2H SO ( ) ( ) 2 4 浓 CuSO4+SO2↑+2H2O
同课章节目录
