江苏省盐城市亭湖区南洋中学2015-2016学年高一上学期第二次阶段考试化学试题(无答案)
文档属性
| 名称 | 江苏省盐城市亭湖区南洋中学2015-2016学年高一上学期第二次阶段考试化学试题(无答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 109.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-01-05 00:00:00 | ||
图片预览


文档简介
盐城市南洋中学2015年秋学期高一年级课堂检测
化 学 试 题
2015.12
本卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27
S:32 Cl:35.5 K:39 Fe:56
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1.2015年12月全球气候大会达成约定要节能减排。下列措施中,不利于节能减排和改善
环境的是
A. 推广可利用太阳能、风能的城市照明系统
B. 使用露天焚烧法处理未经分类的生活垃圾
C. 加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
D. 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
2.体操运动员比赛时为了防滑。常在手掌上涂抹碳酸镁粉末。碳酸镁属于
A.酸 B.碱
C.盐 D.氧化物
3.下列过程只涉及物理变化的是
A.伐薪烧炭 B.酿酒成醋
C.滴水成冰 D.百炼成钢
4.工业焊接钢管时常用13755Cs进行“无损探伤”,这里的“137”是指该原子的
A.质子数 B.中子数
C.电子数 D.质量数
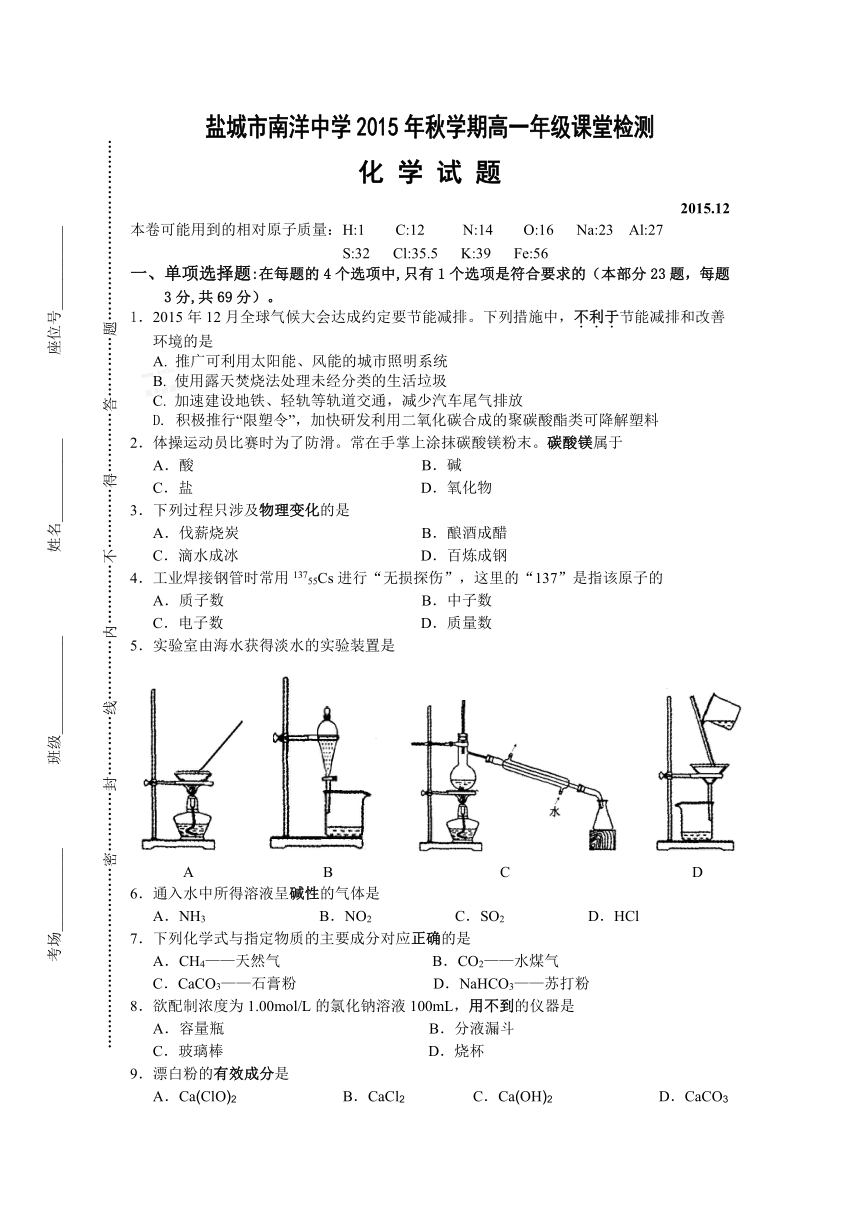
5.实验室由海水获得淡水的实验装置是
A B C D
6.通入水中所得溶液呈碱性的气体是
A.NH3 B.NO2 C.SO2 D.HCl
7.下列化学式与指定物质的主要成分对应正确的是
A.CH4——天然气 B.CO2——水煤气
C.CaCO3——石膏粉 D.NaHCO3——苏打粉
8.欲配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是
A.容量瓶 B.分液漏斗
C.玻璃棒 D.烧杯
9.漂白粉的有效成分是
A.Ca(ClO)2 B.CaCl2 C.Ca(OH)2 D.CaCO3
10.在含有大量的Na+、OH—、NO3—,该溶液中还可能大量存在的离子是
A.NH4+ B. H+ C. SO42— D.Mg2+
11.下列试剂需要用棕色试剂瓶保存的是
A.浓硫酸 B.新制的氯水
C.浓盐酸 D.碳酸钠溶液
12. 下列有关物质检验的实验结论正确的是
实 验 操 作 现 象 实 验 结 论
A. 向某溶液中加入硝酸酸化的氯化钡溶液 生成白色沉淀 溶液中一定含有SO42-
B. 将某溶液蘸取少量放置于火焰上灼烧 火焰呈黄色 该溶液中一定含K+
C. 往粉末中加入NaOH溶液 有气泡生成 溶液中一定含有Al
D. 往某溶液中加入盐酸 产生无色气体 溶液中一定含有CO32-
13. 氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是
A.Cl2 B.HCl C.HClO D.H2O
14. 实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
15. 在水溶液中能大量共存的离子组是
A.Mg2+、Cl—、OH— B.Na+、CO32—、OH—
C.Fe2+、H+、CO32- D.Fe3+、K+、OH—
16.下列关于碳酸钠和碳酸氢钠的叙述,正确的是
A. 常温时,在水中的溶解性:碳酸钠>碳酸氢钠
B. 热稳定性:碳酸钠<碳酸氢钠
C. 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠
D. 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
17.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体
积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.3:1 B.2:1 C.1:1 D.1:3
18.用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L Cl2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
19.中国最新战机歼-31使用了高强度、耐高温的钛合金材料。
工业上冶炼钛的反应如下:TiCl4+2Mg Ti+2MgCl2 。
下列有关该反应的说法正确的是
A.TiCl4是还原剂
B.Mg被氧化
C.TiCl4发生氧化反应
D.Mg得到电子
20.钠与水反应时产生的各种现象如下:
①钠浮在水面上 ②钠沉在水底 ③钠熔化成小球
④小球迅速游动逐渐减小,最后消失 ⑤发出嘶嘶的声音
⑥滴入酚酞后溶液显红色其中正确的一组是
A.①②③④⑤ B.全部
C.①②③⑤⑥ D.①③④⑤⑥
21.下列反应的离子方程式书写正确的是
A.锌粒与稀盐酸反应: Zn + 2H+ = Zn2+ + H2↑
B.大理石与稀盐酸反应: CO32— + 2H+ = CO2 ↑+ H2O
C.氢氧化铜与稀硫酸反应: OH—+ H+ = H2O
D.钠与水反应: Na +2H2O = Na++ 2OH—+ H2↑
22. 能用铝槽车运输下列哪一种物质?
A.盐酸 B.氯水 C.烧碱溶液 D.浓硫酸
23.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D.称取3.80g固体,加热至恒重, ( http: / / www.21cnjy.com )质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
非选择题(共31分)
24.填空:(18分)
(1)9.03×1023个氢气分子含___________mol氢气分子;标准状况下,11.2L的 CO2约含
有 mol氧原子,。
(2)配制一定物质的量浓度溶液的实验中,如果出现以下操作,会产生的误差(填偏大、
偏小或无影响)
A.在烧杯中溶解时,有少量液体洒出 ;
B.定容时,俯视刻度线 ;
C.转移时,容量瓶中有少量水 。
(3)碳酸氢钠是食品中常用的疏松剂,他们在加热的条件下产生气体,使食品变得疏松。
请写出反应的化学方程式 。同时,碳酸氢钠还可
以做成药品,可以治疗胃酸过多,试写出离子方程式: 。
(4)镁粉中混入少量铝粉除去,应选用的试剂是 ,其化学
方程式为: 。
25.实验(6分)
某课外活动小组用如图所示装置制取次氯酸钠。图中瓶乙盛饱和食盐水(已知氯气在其中的溶解度很小),瓶丙盛浓硫酸,仪器A中盛浓盐酸,C中盛NaOH溶液。试回答:
(1)仪器A的名称
(2)乙装置的作用:
(3)实验中若用12mol ( http: / / www.21cnjy.com )/L的浓盐酸100mL,与足量的MnO2反应,最终生成次氯酸钠的物质的量总是小于0.3mol,其主要原因是
26.综合(7分)某研发小组通过下列流程制备碱式次氯酸镁:
注:碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发
价值的无机抗菌剂。
(1)从上述流程中可以判断,滤液中可回收的主要物质是 。(2分)
(2)NaClO用Cl2与NaOH反应制得化学方程式: 。(2分)
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:
ClO— + Cl— + 2H+ =Cl2↑+ H2O
若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。通过计算判断该
产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)(3分)
考场___________ 班级_____________ 姓名___________ 座位号___________
………………………………密…………封…………线…………内…………不…………得…………答…………题………………………………
化 学 试 题
2015.12
本卷可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27
S:32 Cl:35.5 K:39 Fe:56
一、单项选择题:在每题的4个选项中,只有1个选项是符合要求的(本部分23题,每题3分,共69分)。
1.2015年12月全球气候大会达成约定要节能减排。下列措施中,不利于节能减排和改善
环境的是
A. 推广可利用太阳能、风能的城市照明系统
B. 使用露天焚烧法处理未经分类的生活垃圾
C. 加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
D. 积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
2.体操运动员比赛时为了防滑。常在手掌上涂抹碳酸镁粉末。碳酸镁属于
A.酸 B.碱
C.盐 D.氧化物
3.下列过程只涉及物理变化的是
A.伐薪烧炭 B.酿酒成醋
C.滴水成冰 D.百炼成钢
4.工业焊接钢管时常用13755Cs进行“无损探伤”,这里的“137”是指该原子的
A.质子数 B.中子数
C.电子数 D.质量数
5.实验室由海水获得淡水的实验装置是
A B C D
6.通入水中所得溶液呈碱性的气体是
A.NH3 B.NO2 C.SO2 D.HCl
7.下列化学式与指定物质的主要成分对应正确的是
A.CH4——天然气 B.CO2——水煤气
C.CaCO3——石膏粉 D.NaHCO3——苏打粉
8.欲配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是
A.容量瓶 B.分液漏斗
C.玻璃棒 D.烧杯
9.漂白粉的有效成分是
A.Ca(ClO)2 B.CaCl2 C.Ca(OH)2 D.CaCO3
10.在含有大量的Na+、OH—、NO3—,该溶液中还可能大量存在的离子是
A.NH4+ B. H+ C. SO42— D.Mg2+
11.下列试剂需要用棕色试剂瓶保存的是
A.浓硫酸 B.新制的氯水
C.浓盐酸 D.碳酸钠溶液
12. 下列有关物质检验的实验结论正确的是
实 验 操 作 现 象 实 验 结 论
A. 向某溶液中加入硝酸酸化的氯化钡溶液 生成白色沉淀 溶液中一定含有SO42-
B. 将某溶液蘸取少量放置于火焰上灼烧 火焰呈黄色 该溶液中一定含K+
C. 往粉末中加入NaOH溶液 有气泡生成 溶液中一定含有Al
D. 往某溶液中加入盐酸 产生无色气体 溶液中一定含有CO32-
13. 氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是
A.Cl2 B.HCl C.HClO D.H2O
14. 实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
15. 在水溶液中能大量共存的离子组是
A.Mg2+、Cl—、OH— B.Na+、CO32—、OH—
C.Fe2+、H+、CO32- D.Fe3+、K+、OH—
16.下列关于碳酸钠和碳酸氢钠的叙述,正确的是
A. 常温时,在水中的溶解性:碳酸钠>碳酸氢钠
B. 热稳定性:碳酸钠<碳酸氢钠
C. 质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠
D. 物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
17.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体
积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.3:1 B.2:1 C.1:1 D.1:3
18.用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L Cl2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
19.中国最新战机歼-31使用了高强度、耐高温的钛合金材料。
工业上冶炼钛的反应如下:TiCl4+2Mg Ti+2MgCl2 。
下列有关该反应的说法正确的是
A.TiCl4是还原剂
B.Mg被氧化
C.TiCl4发生氧化反应
D.Mg得到电子
20.钠与水反应时产生的各种现象如下:
①钠浮在水面上 ②钠沉在水底 ③钠熔化成小球
④小球迅速游动逐渐减小,最后消失 ⑤发出嘶嘶的声音
⑥滴入酚酞后溶液显红色其中正确的一组是
A.①②③④⑤ B.全部
C.①②③⑤⑥ D.①③④⑤⑥
21.下列反应的离子方程式书写正确的是
A.锌粒与稀盐酸反应: Zn + 2H+ = Zn2+ + H2↑
B.大理石与稀盐酸反应: CO32— + 2H+ = CO2 ↑+ H2O
C.氢氧化铜与稀硫酸反应: OH—+ H+ = H2O
D.钠与水反应: Na +2H2O = Na++ 2OH—+ H2↑
22. 能用铝槽车运输下列哪一种物质?
A.盐酸 B.氯水 C.烧碱溶液 D.浓硫酸
23.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D.称取3.80g固体,加热至恒重, ( http: / / www.21cnjy.com )质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
非选择题(共31分)
24.填空:(18分)
(1)9.03×1023个氢气分子含___________mol氢气分子;标准状况下,11.2L的 CO2约含
有 mol氧原子,。
(2)配制一定物质的量浓度溶液的实验中,如果出现以下操作,会产生的误差(填偏大、
偏小或无影响)
A.在烧杯中溶解时,有少量液体洒出 ;
B.定容时,俯视刻度线 ;
C.转移时,容量瓶中有少量水 。
(3)碳酸氢钠是食品中常用的疏松剂,他们在加热的条件下产生气体,使食品变得疏松。
请写出反应的化学方程式 。同时,碳酸氢钠还可
以做成药品,可以治疗胃酸过多,试写出离子方程式: 。
(4)镁粉中混入少量铝粉除去,应选用的试剂是 ,其化学
方程式为: 。
25.实验(6分)
某课外活动小组用如图所示装置制取次氯酸钠。图中瓶乙盛饱和食盐水(已知氯气在其中的溶解度很小),瓶丙盛浓硫酸,仪器A中盛浓盐酸,C中盛NaOH溶液。试回答:
(1)仪器A的名称
(2)乙装置的作用:
(3)实验中若用12mol ( http: / / www.21cnjy.com )/L的浓盐酸100mL,与足量的MnO2反应,最终生成次氯酸钠的物质的量总是小于0.3mol,其主要原因是
26.综合(7分)某研发小组通过下列流程制备碱式次氯酸镁:
注:碱式次氯酸镁[Mg2ClO(OH)3·H2O]微溶于水,不吸湿,相对稳定,是一种有开发
价值的无机抗菌剂。
(1)从上述流程中可以判断,滤液中可回收的主要物质是 。(2分)
(2)NaClO用Cl2与NaOH反应制得化学方程式: 。(2分)
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标。次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示:
ClO— + Cl— + 2H+ =Cl2↑+ H2O
若测得某碱式次氯酸镁产品中镁含量为29.01%,有效氯含量为40.28%。通过计算判断该
产品中镁和有效氯含量的测定值与理论值相比,是偏高或偏低?(写出计算过程)(3分)
考场___________ 班级_____________ 姓名___________ 座位号___________
………………………………密…………封…………线…………内…………不…………得…………答…………题………………………………
同课章节目录
