海南省部分学校2023-2024学年高一下学期7月期末考试 化学试题(含答案)
文档属性
| 名称 | 海南省部分学校2023-2024学年高一下学期7月期末考试 化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-02 19:20:02 | ||
图片预览

文档简介
海南省部分学校2023-2024学年高一下学期7月期末联考
化学试题
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Fe 56 Zn 65 Ba 137
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 甲醇是一种“绿色”燃料,其在合成、消耗过程中的量实现零增长,碳循环过程如图所示。下列说法正确的是
A. 、均属于有机物
B. 制过程中,电能转化为化学能
C. 合成的反应中原子利用率为100%
D. 分子中含有非极性键
2. 、具有放射性,在医药上用于治疗肿瘤。下列关于、的说法正确的是
A. 、互为同素异形体 B. 的质量数是53
C. 的中子数是82 D. 的电子数是188
3. 实验室用Zn与稀硫酸反应制,反应过程中的能量变化如图所示。下列说法正确的是
A. 该反应是吸热反应
B. 1molZn的能量大于1mol的能量
C. 若有32.5gZn参加反应时,可收集到11.2L
D. 可利用该反应设计成原电池,将化学能转化为电能
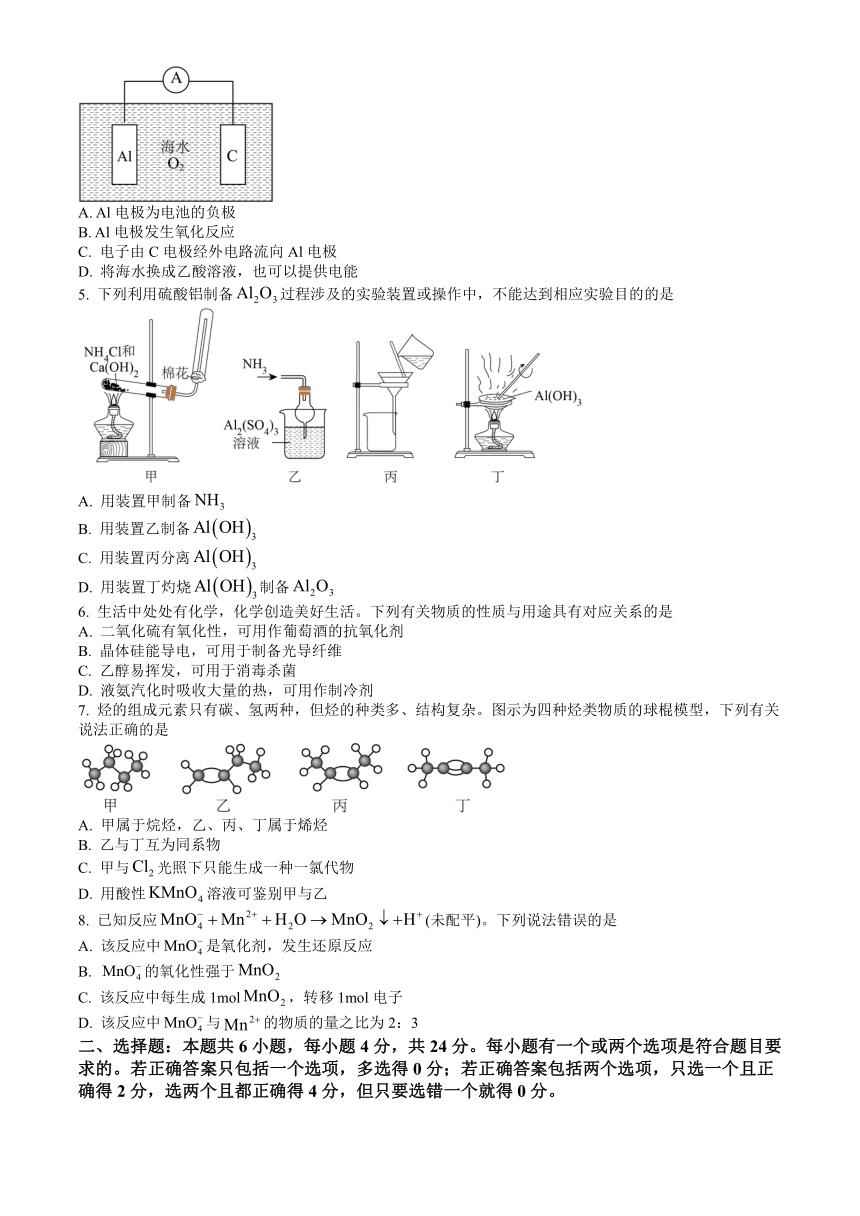
4. 铝-空气-海水电池可以作为航海指示灯电源,电池总反应为。工作原理如图所示,下列说法错误的是
A. Al电极为电池的负极
B. Al电极发生氧化反应
C. 电子由C电极经外电路流向Al电极
D. 将海水换成乙酸溶液,也可以提供电能
5. 下列利用硫酸铝制备过程涉及的实验装置或操作中,不能达到相应实验目的的是
A. 用装置甲制备
B. 用装置乙制备
C. 用装置丙分离
D. 用装置丁灼烧制备
6. 生活中处处有化学,化学创造美好生活。下列有关物质的性质与用途具有对应关系的是
A. 二氧化硫有氧化性,可用作葡萄酒的抗氧化剂
B. 晶体硅能导电,可用于制备光导纤维
C. 乙醇易挥发,可用于消毒杀菌
D. 液氨汽化时吸收大量的热,可用作制冷剂
7. 烃的组成元素只有碳、氢两种,但烃的种类多、结构复杂。图示为四种烃类物质的球棍模型,下列有关说法正确的是
A. 甲属于烷烃,乙、丙、丁属于烯烃
B. 乙与丁互为同系物
C. 甲与光照下只能生成一种一氯代物
D. 用酸性溶液可鉴别甲与乙
8. 已知反应(未配平)。下列说法错误的是
A. 该反应中是氧化剂,发生还原反应
B. 的氧化性强于
C. 该反应中每生成1mol,转移1mol电子
D. 该反应中与的物质的量之比为2:3
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
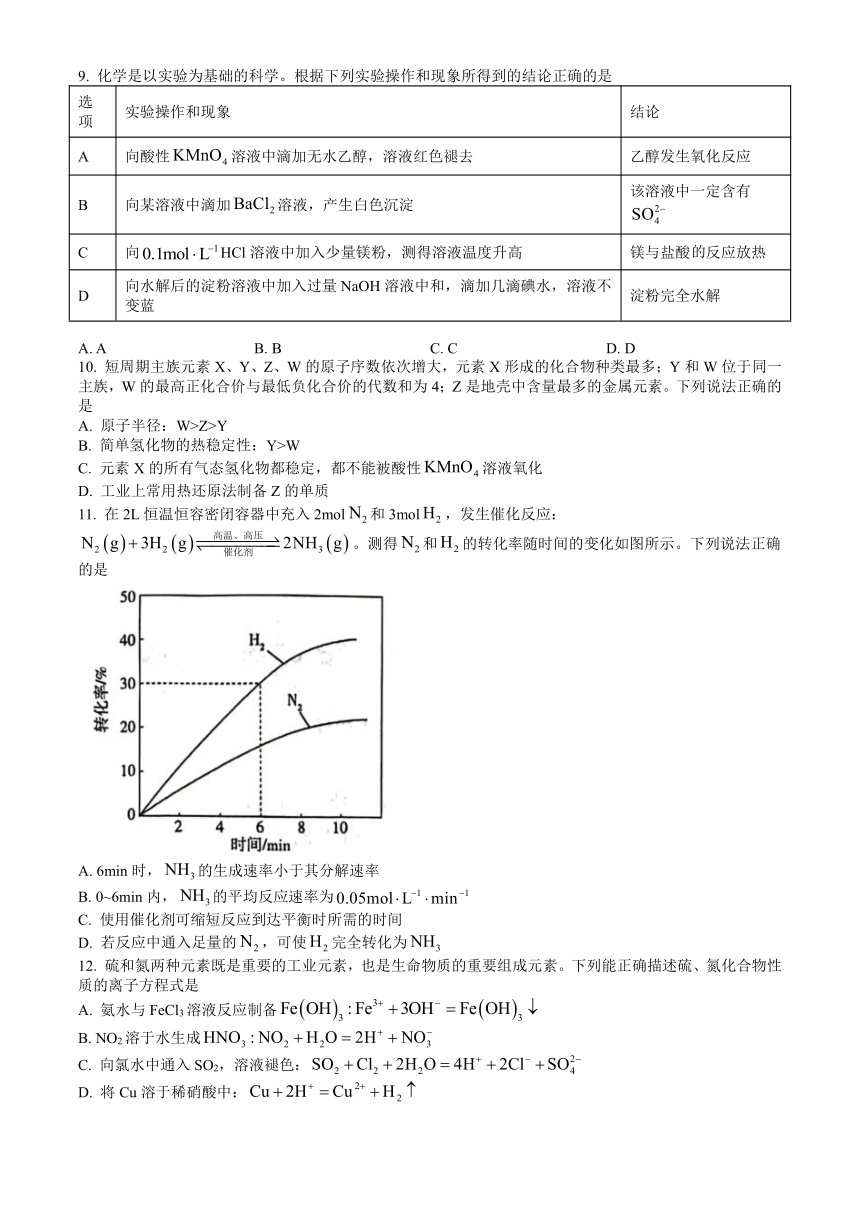
9. 化学是以实验为基础的科学。根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 向酸性溶液中滴加无水乙醇,溶液红色褪去 乙醇发生氧化反应
B 向某溶液中滴加溶液,产生白色沉淀 该溶液中一定含有
C 向HCl溶液中加入少量镁粉,测得溶液温度升高 镁与盐酸反应放热
D 向水解后的淀粉溶液中加入过量NaOH溶液中和,滴加几滴碘水,溶液不变蓝 淀粉完全水解
A. A B. B C. C D. D
10. 短周期主族元素X、Y、Z、W的原子序数依次增大,元素X形成的化合物种类最多;Y和W位于同一主族,W的最高正化合价与最低负化合价的代数和为4;Z是地壳中含量最多的金属元素。下列说法正确的是
A. 原子半径:W>Z>Y
B. 简单氢化物的热稳定性:Y>W
C. 元素X的所有气态氢化物都稳定,都不能被酸性溶液氧化
D. 工业上常用热还原法制备Z的单质
11. 在2L恒温恒容密闭容器中充入2mol和3mol,发生催化反应:。测得和的转化率随时间的变化如图所示。下列说法正确的是
A. 6min时,的生成速率小于其分解速率
B. 0~6min内,的平均反应速率为
C. 使用催化剂可缩短反应到达平衡时所需的时间
D. 若反应中通入足量的,可使完全转化为
12. 硫和氮两种元素既是重要的工业元素,也是生命物质的重要组成元素。下列能正确描述硫、氮化合物性质的离子方程式是
A. 氨水与FeCl3溶液反应制备
B. NO2溶于水生成
C. 向氯水中通入SO2,溶液褪色:
D. 将Cu溶于稀硝酸中:
13. 具有相同官能团的有机物性质相似。某有机物的结构简式为,下列关于该有机物的说法正确的是
A. 该有机物只含有两种官能团
B. 该有机物能使溴的四氯化碳溶液褪色
C. 1mol该有机物与足量Na反应生成0.5mol
D. 一定条件下,该有机物能与乙醇或乙酸发生酯化反应
14. 工业上含的尾气和含的废水可通过循环处理吸收,其反应原理如图所示。下列说法正确的是
A. 该循环过程中为催化剂
B. 由该循环过程可知,若直接用不能氧化
C. 该循环过程中每处理1mol,可同时处理3mol
D. 第②步中,1mol参加反应时转移3mol电子
三、非选择题:本题共5小题,共60分。
15. 短周期元素X、Y、Z、W、M的原子序数依次增大。元素M的单质通常为黄绿色气体。元素X与W的原子核外均有一个价电子,能形成离子化合物WX。X可分别与Y、Z形成10电子分子甲和乙,乙的水溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为___________。
(2)甲与M的单质在光照下发生反应的反应类型为___________。
(3)化合物WX与水反应的化学方程式为___________。
(4)X与Z可形成10电子分子乙,也可形成10电子阳离子丙,阳离子丙的电子式为___________。
(5)M的单质与化合物乙反应生成白色固体和Z的单质,该白色固体属于___________(填“离子化合物”或“共价化合物”)。
(6)化合物与反应生成一种具有漂白性的酸和乙,写出该反应的化学方程式:___________。
16. 甲烷水蒸气催化重整是制备高纯氢的方法之一,反应原理之一为。
(1)已知:一定条件下断开1mol气态物质中的化学键吸收的能量或形成1mol气态物质中的化学键放出的能量数据如下表:
物质
436 924 1652 1490
该催化重整反应断开反应物中的化学键吸收的能量___________(填“大于”或“小于”)形成生成物中的化学键放出的能量,该反应为___________(填“放热”或“吸热”)反应。
(2)在容积为2L的恒温恒容密闭容器中充入1mol和2mol,发生上述反应,和的物质的量随时间的变化关系如图所示。
①图中a=___________,3min时,的转化率为___________。
②该温度下达到平衡时,混合气体中___________mol,此时体系压强与开始时压强之比为___________(填最简整数比)。
③下列叙述正确的是___________(填字母)。
a.3min时,的生成速率等于其消耗速率
b.由保持不变可判断该反应达到平衡状态
c.当时,该反应一定达到平衡状态
d.图中b点的正反应速率大于c点的逆反应速率
④其他条件不变时,下列措施可以加快该反应速率的是___________(填字母)。
a.升高温度 b.增大甲烷浓度
c.将容器的容积变为4L d.恒容条件下充入一定量的
17. 可用作还原剂等,在不同温度下分解产物不同,高温下发生分解反应:。某小组设计如图所示装置验证无水受热分解发生上述反应及生成物中、的物质的量之比。
已知:①标准状况下是一种无色晶体,其熔点为16.8℃,沸点为44.8℃。
②无水硫酸亚铁是白色粉末。
请回答下列问题:
(1)装置A中的现象为___________。
(2)反应前后均需要通入,反应后通的目的是___________。
(3)装置B中冰水浴的作用是___________。
(4)装置C中发生反应的离子方程式是___________。
(5)经测定装置B中试管增加的质量为1.60g,装置C中生成沉淀的质量为6.99g,由实验数据可得___________。该小组经检查实验装置和试剂都符合实验要求,试分析实验数据与方程式中的定量关系不相符合的原因有___________(填一条)。
18. 丙烯酸乙酯天然存在于菠萝等水果中,也是一种食用合成香料。由A、C为原料合成丙烯酸乙酯的路线如图所示:
(1)淀粉的分子式为___________;葡萄糖经酒化酶作用得到的乙醇浓度通常较低,提高其浓度需采取的操作名称为___________。
(2)有机物C结构简式为___________,C中官能团的名称为___________。
(3)A→B的反应类型为___________。
(4)B与C反应生成丙烯酸乙酯的化学方程式为___________。
(5)D是加聚反应得到的高分子,其结构简式为___________。
19. 自然资源是人类社会发展不可或缺的物质基础。设计合理的物质生产流程,始终是化学面对的重要课题。
Ⅰ.海水资源丰富,开发与利用海水资源具有广阔的前景。实验室模拟从海水中提取Mg的流程如图所示:
(1)实验室粗盐提纯过程中需要用到下列仪器中的___________(填字母)。
(2)工业上沉镁过程中常用氢氧化钙而不用氢氧化钠的原因是___________。
(3)反应②是___________(填“放热”或“吸热”)反应,该反应的离子方程式为___________。
(4)工业上用无水MgCl2制取Mg的化学方程式为___________。
Ⅱ.主要用于制造船底防污漆、杀虫剂、各种铜盐以及分析试剂等,其有关制备途径如图所示:
(5)途径Ⅰ、Ⅱ比较,符合绿色化学思想的是途径___________(填“Ⅰ”或“Ⅱ”)。
(6)X可以是单糖,由生成推测X中含有的官能团名称为___________。
(7)Cu经途径Ⅰ发生反应的化学方程式为___________。
参考答案
1. B
2. C
3. D
4. C
5. D
6. D
7. D
8. C
9. AC
10. B
11. BC
12. C
13. BD
14. AC
15. (1)第三周期VIIA族
(2)取代反应
(3)NaH+H2O=NaOH+H2
(4)
(5)离子化合物
(6)NCl3+3H2O=3HClO+NH3
16. (1) 大于 吸热
(2)①. 0.2 ②. 50% ③. 3.2 ④. 23:15 ⑤. bd ⑥. ab
17. (1)固体由白色变为红棕色
(2)使生成的、SO2全部被收集或吸收
(3)冷却收集
(4)Ba2++H2O2+SO2=BaSO4↓+2H+
(5) 3:2 气流速率过快,装置B中冷却不完全,在装置C中反应生成BaSO4
18. (1) 蒸馏
(2) 碳碳双键、羧基
(3)加成反应
(4)
(5)
19. (1)BD
(2)NaOH价格较贵,氢氧化钙廉价易得
(3) 放热 Mg(OH)2+2H+=Mg2++2H2O
(4)MgCl2(熔融)Mg+Cl2↑
(5)Ⅱ
(6)醛基
(7)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
化学试题
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Fe 56 Zn 65 Ba 137
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 甲醇是一种“绿色”燃料,其在合成、消耗过程中的量实现零增长,碳循环过程如图所示。下列说法正确的是
A. 、均属于有机物
B. 制过程中,电能转化为化学能
C. 合成的反应中原子利用率为100%
D. 分子中含有非极性键
2. 、具有放射性,在医药上用于治疗肿瘤。下列关于、的说法正确的是
A. 、互为同素异形体 B. 的质量数是53
C. 的中子数是82 D. 的电子数是188
3. 实验室用Zn与稀硫酸反应制,反应过程中的能量变化如图所示。下列说法正确的是
A. 该反应是吸热反应
B. 1molZn的能量大于1mol的能量
C. 若有32.5gZn参加反应时,可收集到11.2L
D. 可利用该反应设计成原电池,将化学能转化为电能
4. 铝-空气-海水电池可以作为航海指示灯电源,电池总反应为。工作原理如图所示,下列说法错误的是
A. Al电极为电池的负极
B. Al电极发生氧化反应
C. 电子由C电极经外电路流向Al电极
D. 将海水换成乙酸溶液,也可以提供电能
5. 下列利用硫酸铝制备过程涉及的实验装置或操作中,不能达到相应实验目的的是
A. 用装置甲制备
B. 用装置乙制备
C. 用装置丙分离
D. 用装置丁灼烧制备
6. 生活中处处有化学,化学创造美好生活。下列有关物质的性质与用途具有对应关系的是
A. 二氧化硫有氧化性,可用作葡萄酒的抗氧化剂
B. 晶体硅能导电,可用于制备光导纤维
C. 乙醇易挥发,可用于消毒杀菌
D. 液氨汽化时吸收大量的热,可用作制冷剂
7. 烃的组成元素只有碳、氢两种,但烃的种类多、结构复杂。图示为四种烃类物质的球棍模型,下列有关说法正确的是
A. 甲属于烷烃,乙、丙、丁属于烯烃
B. 乙与丁互为同系物
C. 甲与光照下只能生成一种一氯代物
D. 用酸性溶液可鉴别甲与乙
8. 已知反应(未配平)。下列说法错误的是
A. 该反应中是氧化剂,发生还原反应
B. 的氧化性强于
C. 该反应中每生成1mol,转移1mol电子
D. 该反应中与的物质的量之比为2:3
二、选择题:本题共6小题,每小题4分,共24分。每小题有一个或两个选项是符合题目要求的。若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确得4分,但只要选错一个就得0分。
9. 化学是以实验为基础的科学。根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 向酸性溶液中滴加无水乙醇,溶液红色褪去 乙醇发生氧化反应
B 向某溶液中滴加溶液,产生白色沉淀 该溶液中一定含有
C 向HCl溶液中加入少量镁粉,测得溶液温度升高 镁与盐酸反应放热
D 向水解后的淀粉溶液中加入过量NaOH溶液中和,滴加几滴碘水,溶液不变蓝 淀粉完全水解
A. A B. B C. C D. D
10. 短周期主族元素X、Y、Z、W的原子序数依次增大,元素X形成的化合物种类最多;Y和W位于同一主族,W的最高正化合价与最低负化合价的代数和为4;Z是地壳中含量最多的金属元素。下列说法正确的是
A. 原子半径:W>Z>Y
B. 简单氢化物的热稳定性:Y>W
C. 元素X的所有气态氢化物都稳定,都不能被酸性溶液氧化
D. 工业上常用热还原法制备Z的单质
11. 在2L恒温恒容密闭容器中充入2mol和3mol,发生催化反应:。测得和的转化率随时间的变化如图所示。下列说法正确的是
A. 6min时,的生成速率小于其分解速率
B. 0~6min内,的平均反应速率为
C. 使用催化剂可缩短反应到达平衡时所需的时间
D. 若反应中通入足量的,可使完全转化为
12. 硫和氮两种元素既是重要的工业元素,也是生命物质的重要组成元素。下列能正确描述硫、氮化合物性质的离子方程式是
A. 氨水与FeCl3溶液反应制备
B. NO2溶于水生成
C. 向氯水中通入SO2,溶液褪色:
D. 将Cu溶于稀硝酸中:
13. 具有相同官能团的有机物性质相似。某有机物的结构简式为,下列关于该有机物的说法正确的是
A. 该有机物只含有两种官能团
B. 该有机物能使溴的四氯化碳溶液褪色
C. 1mol该有机物与足量Na反应生成0.5mol
D. 一定条件下,该有机物能与乙醇或乙酸发生酯化反应
14. 工业上含的尾气和含的废水可通过循环处理吸收,其反应原理如图所示。下列说法正确的是
A. 该循环过程中为催化剂
B. 由该循环过程可知,若直接用不能氧化
C. 该循环过程中每处理1mol,可同时处理3mol
D. 第②步中,1mol参加反应时转移3mol电子
三、非选择题:本题共5小题,共60分。
15. 短周期元素X、Y、Z、W、M的原子序数依次增大。元素M的单质通常为黄绿色气体。元素X与W的原子核外均有一个价电子,能形成离子化合物WX。X可分别与Y、Z形成10电子分子甲和乙,乙的水溶液呈碱性。请回答下列问题:
(1)M在元素周期表中的位置为___________。
(2)甲与M的单质在光照下发生反应的反应类型为___________。
(3)化合物WX与水反应的化学方程式为___________。
(4)X与Z可形成10电子分子乙,也可形成10电子阳离子丙,阳离子丙的电子式为___________。
(5)M的单质与化合物乙反应生成白色固体和Z的单质,该白色固体属于___________(填“离子化合物”或“共价化合物”)。
(6)化合物与反应生成一种具有漂白性的酸和乙,写出该反应的化学方程式:___________。
16. 甲烷水蒸气催化重整是制备高纯氢的方法之一,反应原理之一为。
(1)已知:一定条件下断开1mol气态物质中的化学键吸收的能量或形成1mol气态物质中的化学键放出的能量数据如下表:
物质
436 924 1652 1490
该催化重整反应断开反应物中的化学键吸收的能量___________(填“大于”或“小于”)形成生成物中的化学键放出的能量,该反应为___________(填“放热”或“吸热”)反应。
(2)在容积为2L的恒温恒容密闭容器中充入1mol和2mol,发生上述反应,和的物质的量随时间的变化关系如图所示。
①图中a=___________,3min时,的转化率为___________。
②该温度下达到平衡时,混合气体中___________mol,此时体系压强与开始时压强之比为___________(填最简整数比)。
③下列叙述正确的是___________(填字母)。
a.3min时,的生成速率等于其消耗速率
b.由保持不变可判断该反应达到平衡状态
c.当时,该反应一定达到平衡状态
d.图中b点的正反应速率大于c点的逆反应速率
④其他条件不变时,下列措施可以加快该反应速率的是___________(填字母)。
a.升高温度 b.增大甲烷浓度
c.将容器的容积变为4L d.恒容条件下充入一定量的
17. 可用作还原剂等,在不同温度下分解产物不同,高温下发生分解反应:。某小组设计如图所示装置验证无水受热分解发生上述反应及生成物中、的物质的量之比。
已知:①标准状况下是一种无色晶体,其熔点为16.8℃,沸点为44.8℃。
②无水硫酸亚铁是白色粉末。
请回答下列问题:
(1)装置A中的现象为___________。
(2)反应前后均需要通入,反应后通的目的是___________。
(3)装置B中冰水浴的作用是___________。
(4)装置C中发生反应的离子方程式是___________。
(5)经测定装置B中试管增加的质量为1.60g,装置C中生成沉淀的质量为6.99g,由实验数据可得___________。该小组经检查实验装置和试剂都符合实验要求,试分析实验数据与方程式中的定量关系不相符合的原因有___________(填一条)。
18. 丙烯酸乙酯天然存在于菠萝等水果中,也是一种食用合成香料。由A、C为原料合成丙烯酸乙酯的路线如图所示:
(1)淀粉的分子式为___________;葡萄糖经酒化酶作用得到的乙醇浓度通常较低,提高其浓度需采取的操作名称为___________。
(2)有机物C结构简式为___________,C中官能团的名称为___________。
(3)A→B的反应类型为___________。
(4)B与C反应生成丙烯酸乙酯的化学方程式为___________。
(5)D是加聚反应得到的高分子,其结构简式为___________。
19. 自然资源是人类社会发展不可或缺的物质基础。设计合理的物质生产流程,始终是化学面对的重要课题。
Ⅰ.海水资源丰富,开发与利用海水资源具有广阔的前景。实验室模拟从海水中提取Mg的流程如图所示:
(1)实验室粗盐提纯过程中需要用到下列仪器中的___________(填字母)。
(2)工业上沉镁过程中常用氢氧化钙而不用氢氧化钠的原因是___________。
(3)反应②是___________(填“放热”或“吸热”)反应,该反应的离子方程式为___________。
(4)工业上用无水MgCl2制取Mg的化学方程式为___________。
Ⅱ.主要用于制造船底防污漆、杀虫剂、各种铜盐以及分析试剂等,其有关制备途径如图所示:
(5)途径Ⅰ、Ⅱ比较,符合绿色化学思想的是途径___________(填“Ⅰ”或“Ⅱ”)。
(6)X可以是单糖,由生成推测X中含有的官能团名称为___________。
(7)Cu经途径Ⅰ发生反应的化学方程式为___________。
参考答案
1. B
2. C
3. D
4. C
5. D
6. D
7. D
8. C
9. AC
10. B
11. BC
12. C
13. BD
14. AC
15. (1)第三周期VIIA族
(2)取代反应
(3)NaH+H2O=NaOH+H2
(4)
(5)离子化合物
(6)NCl3+3H2O=3HClO+NH3
16. (1) 大于 吸热
(2)①. 0.2 ②. 50% ③. 3.2 ④. 23:15 ⑤. bd ⑥. ab
17. (1)固体由白色变为红棕色
(2)使生成的、SO2全部被收集或吸收
(3)冷却收集
(4)Ba2++H2O2+SO2=BaSO4↓+2H+
(5) 3:2 气流速率过快,装置B中冷却不完全,在装置C中反应生成BaSO4
18. (1) 蒸馏
(2) 碳碳双键、羧基
(3)加成反应
(4)
(5)
19. (1)BD
(2)NaOH价格较贵,氢氧化钙廉价易得
(3) 放热 Mg(OH)2+2H+=Mg2++2H2O
(4)MgCl2(熔融)Mg+Cl2↑
(5)Ⅱ
(6)醛基
(7)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
同课章节目录
