核素+高一上学期化学人教版(2019)必修第一册(共20张PPT)
文档属性
| 名称 | 核素+高一上学期化学人教版(2019)必修第一册(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:02:45 | ||
图片预览





文档简介
(共20张PPT)
核 素
高中化学人教版(2019)必修1第四章 · 第一节
(第3课时)
核心素养
宏观辨识与微观探析:从原子核的构成认识核素、同位素、元素等 概念,并能比较它们的不同。
学习目标
1.知道元素、核素、同位素的含义;(重点&难点) 2.学会原子结构的表示方法。
1.下面的字母各表示什么
A—— 代表质量数
Z—— 代表质子数(核电荷数)
a—— 代表离子的价态
b—— 代表原子个数
2.填一填
4C的质量数为14,质子数为6,中子数为 8。
2 Na*的质量数为23,质子数为11,核外电子数为 10。
2R
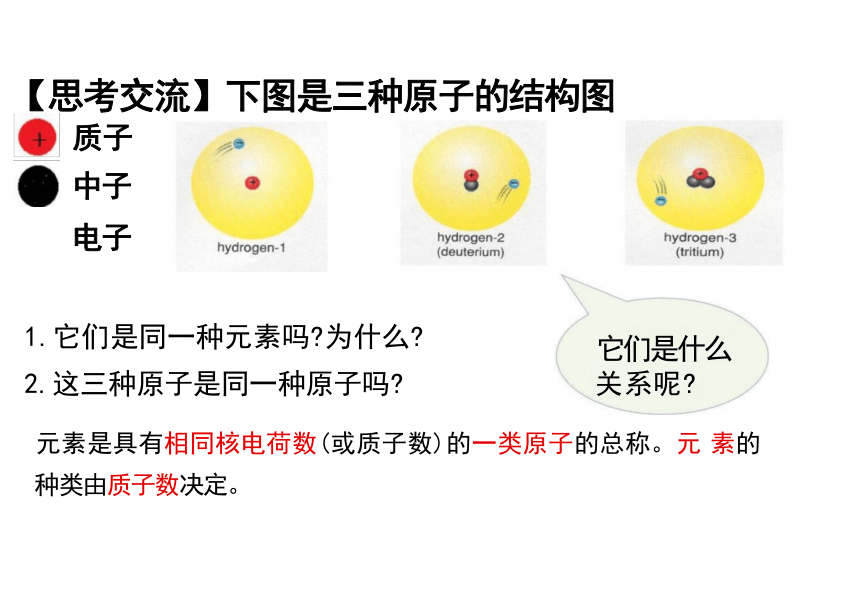
元素是具有相同核电荷数(或质子数)的一类原子的总称。元 素的
种类由质子数决定。
1.它们是同一种元素吗 为什么
2.这三种原子是同一种原子吗
它们是什么 关系呢
【思考交流】下图是三种原子的结构图
质子
中子 电子
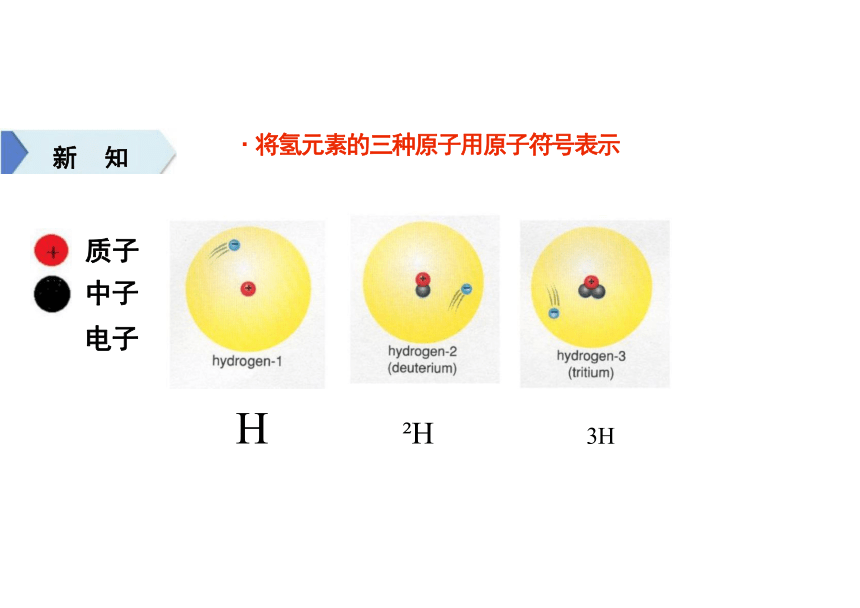
H H 3H
·将氢元素的三种原子用原子符号表示
新 知
质子
中子 电子
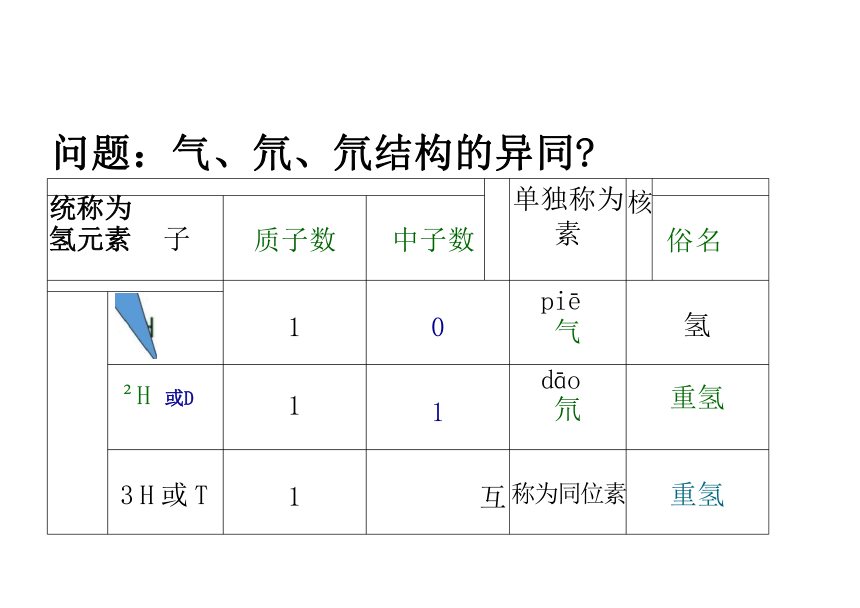
单独称为 素 核
统称为 氢元素 子 质子数 中子数
俗名
1 0 piē 气 氢
H 或D 1 1 dāo 氘 重氢
3 H 或 T 1 互 称为同位素 重氢
问题:气、氘、氘结构的异同
核素:具有一定数目的质子和一定数目的中子的一种原子;
质子和中子都相同是同一种核素。
同位素:质子数相同而中子数不同的同一元素的不同原子 (同一元素的 不同核素)互称为同位素;
核素是一种原子的称谓,同位素是同种元素的不同核素间的互称。 思考:三种核素气、氘、氚的异同
过程小结:
同位素的特点
① 三同:质子数相同在元素周期表中占相同的位置、属同一元素、 化学性质基本相同。
② 三不同:中子数不同、质量数不同、物理性质不同
③ 在天然存在的某种元素里,各种同位素原子所占的原子个数百分比 (丰度)一般是不变的。
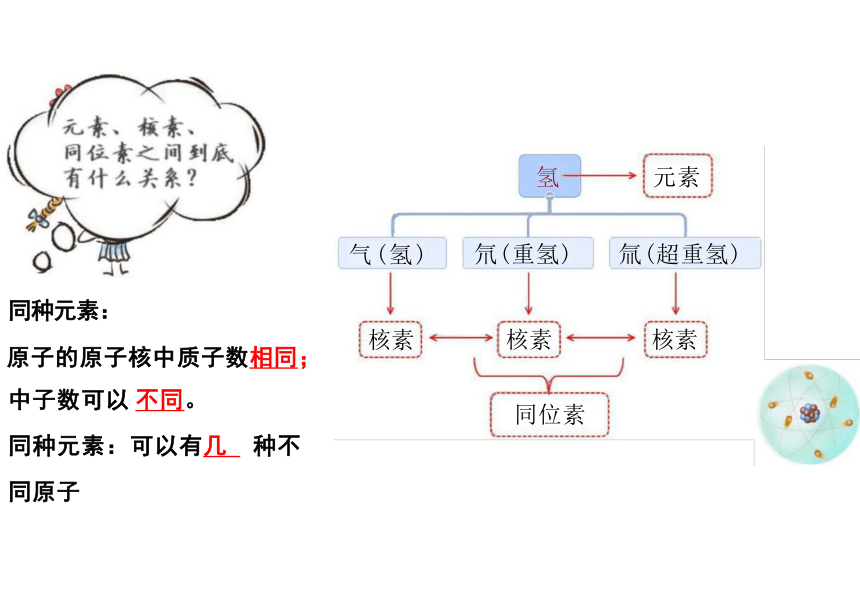
氢 元素
氘(重氢) 氚(超重氢)
核素 核素
同位素
同种元素:
原子的原子核中质子数相同; 中子数可以 不同。
同种元素:可以有几 种不
气(氢)
核素
同原子
互称为同位
素
又如:
碳元素的各种核素 12C 、13C 、14C ;
氧元素的各种核素 160、170、180 ; 铀元素的各种核素234U、235U、238U ;
科学视野
铀-235原子核完全裂变放出的能量是同量煤完全燃烧
放出能量的2700000倍。也就是说1克U-235 完全裂变释 放的能量相当于2吨半优质煤完全燃烧时所释放的能量。
以重水堆为热源的核电站。重水堆是以重水作慢化剂的反应堆,可以 直接利用天然铀作为核燃料。
重水堆核电站是发展较早的核电站,有各种类别。
科学视野 重水反应堆
14C衰变测定装置
[练习]以下互为同位素的是(D)
A.D 与H B.T O和 H O
C. 金刚石与石墨 D.35CI 与17Cl
同位素:同种元素的不同原子互称同位素,如D和T。
同素异形体:同种元素的不同单质间的互称, 如O 、O ; 金刚石和石墨。
这节课的主要
联系 内容是什么
元素 同种 单 质
元素
核素1核素2……核素儿组成 单质1单质2 …单质
它们之间互称同位素 互称同素异形体
比较项目 元素 核素 同位素
同素异形体
本质 质子数相同的一 类原子的总称 质子数、中子数 都一定的原子 质子数相同、中 子数不同的核素
同种元素形成的
不同单质
范畴 同类原子 原子 原子
单质
特性 只有种类,没有 个数 化学反应中的最 小微粒 化学性质几乎完 全相同
元素相同、性质
不同
决定因素 质子数 质子数、中子数 质子数、中子数
组成元素、结构
举例 H、C、N三种元 素 H、H、H三种核 素 H、H、H互称同 位素
0 与O 互为同素
异形体
总结:元素、核素、同位素、同素异形体:
1.3He可以作为核聚变材料。下列关于3He 的叙述正确的是( A )
A.3He原子核内中子数为1
B.3He 原子易失去两个电子
C.3He和3H 互为同位素
D.3He原子核内质子数为3
2.元素的种类和原子的种类( B )
A.前者大 B.后者大
C. 相 同 D. 无法确定
课堂评价
3.医学界通过用14C 标记的C 0发现一种C 0的羧酸衍生物,在特定 条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正 确叙述是(D
A.与1 C 0的碳原子化学性质不同
B.与14N 含的中子数相同
C.是1 C 0的同素异形体
D.与12C、13C互为同位素
查阅同位素在能源、医疗、农业、考古等方面的应用,
以读书报告会形式进行交流。
【课后评价】
帆 風
核 素
高中化学人教版(2019)必修1第四章 · 第一节
(第3课时)
核心素养
宏观辨识与微观探析:从原子核的构成认识核素、同位素、元素等 概念,并能比较它们的不同。
学习目标
1.知道元素、核素、同位素的含义;(重点&难点) 2.学会原子结构的表示方法。
1.下面的字母各表示什么
A—— 代表质量数
Z—— 代表质子数(核电荷数)
a—— 代表离子的价态
b—— 代表原子个数
2.填一填
4C的质量数为14,质子数为6,中子数为 8。
2 Na*的质量数为23,质子数为11,核外电子数为 10。
2R
元素是具有相同核电荷数(或质子数)的一类原子的总称。元 素的
种类由质子数决定。
1.它们是同一种元素吗 为什么
2.这三种原子是同一种原子吗
它们是什么 关系呢
【思考交流】下图是三种原子的结构图
质子
中子 电子
H H 3H
·将氢元素的三种原子用原子符号表示
新 知
质子
中子 电子
单独称为 素 核
统称为 氢元素 子 质子数 中子数
俗名
1 0 piē 气 氢
H 或D 1 1 dāo 氘 重氢
3 H 或 T 1 互 称为同位素 重氢
问题:气、氘、氘结构的异同
核素:具有一定数目的质子和一定数目的中子的一种原子;
质子和中子都相同是同一种核素。
同位素:质子数相同而中子数不同的同一元素的不同原子 (同一元素的 不同核素)互称为同位素;
核素是一种原子的称谓,同位素是同种元素的不同核素间的互称。 思考:三种核素气、氘、氚的异同
过程小结:
同位素的特点
① 三同:质子数相同在元素周期表中占相同的位置、属同一元素、 化学性质基本相同。
② 三不同:中子数不同、质量数不同、物理性质不同
③ 在天然存在的某种元素里,各种同位素原子所占的原子个数百分比 (丰度)一般是不变的。
氢 元素
氘(重氢) 氚(超重氢)
核素 核素
同位素
同种元素:
原子的原子核中质子数相同; 中子数可以 不同。
同种元素:可以有几 种不
气(氢)
核素
同原子
互称为同位
素
又如:
碳元素的各种核素 12C 、13C 、14C ;
氧元素的各种核素 160、170、180 ; 铀元素的各种核素234U、235U、238U ;
科学视野
铀-235原子核完全裂变放出的能量是同量煤完全燃烧
放出能量的2700000倍。也就是说1克U-235 完全裂变释 放的能量相当于2吨半优质煤完全燃烧时所释放的能量。
以重水堆为热源的核电站。重水堆是以重水作慢化剂的反应堆,可以 直接利用天然铀作为核燃料。
重水堆核电站是发展较早的核电站,有各种类别。
科学视野 重水反应堆
14C衰变测定装置
[练习]以下互为同位素的是(D)
A.D 与H B.T O和 H O
C. 金刚石与石墨 D.35CI 与17Cl
同位素:同种元素的不同原子互称同位素,如D和T。
同素异形体:同种元素的不同单质间的互称, 如O 、O ; 金刚石和石墨。
这节课的主要
联系 内容是什么
元素 同种 单 质
元素
核素1核素2……核素儿组成 单质1单质2 …单质
它们之间互称同位素 互称同素异形体
比较项目 元素 核素 同位素
同素异形体
本质 质子数相同的一 类原子的总称 质子数、中子数 都一定的原子 质子数相同、中 子数不同的核素
同种元素形成的
不同单质
范畴 同类原子 原子 原子
单质
特性 只有种类,没有 个数 化学反应中的最 小微粒 化学性质几乎完 全相同
元素相同、性质
不同
决定因素 质子数 质子数、中子数 质子数、中子数
组成元素、结构
举例 H、C、N三种元 素 H、H、H三种核 素 H、H、H互称同 位素
0 与O 互为同素
异形体
总结:元素、核素、同位素、同素异形体:
1.3He可以作为核聚变材料。下列关于3He 的叙述正确的是( A )
A.3He原子核内中子数为1
B.3He 原子易失去两个电子
C.3He和3H 互为同位素
D.3He原子核内质子数为3
2.元素的种类和原子的种类( B )
A.前者大 B.后者大
C. 相 同 D. 无法确定
课堂评价
3.医学界通过用14C 标记的C 0发现一种C 0的羧酸衍生物,在特定 条件下可以通过断裂DNA抑制艾滋病病毒的繁殖,则有关14C的正 确叙述是(D
A.与1 C 0的碳原子化学性质不同
B.与14N 含的中子数相同
C.是1 C 0的同素异形体
D.与12C、13C互为同位素
查阅同位素在能源、医疗、农业、考古等方面的应用,
以读书报告会形式进行交流。
【课后评价】
帆 風
