铝和铝合金+高一上学期化学人教版(2019)必修第一册(共31张PPT)
文档属性
| 名称 | 铝和铝合金+高一上学期化学人教版(2019)必修第一册(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:04:58 | ||
图片预览











文档简介
(共31张PPT)
第三章铁金属材料
第二节金属材料
课时2铝和铝合金
学习目标
通过实验探究铝和氧化铝的性质及 转化,认识两性氧化物,丰富对金 属多样性的认识
以铝合金为例,能从元素组成上 对合金进行分类,并认识不同类 型金属材料组成、性能与应用的 联系
思考:铝的化学性质比较活泼,为什
么我们通常看见铁生锈而没有看到铝
生 锈
铝锅 铁锅
铝和铝合金
01
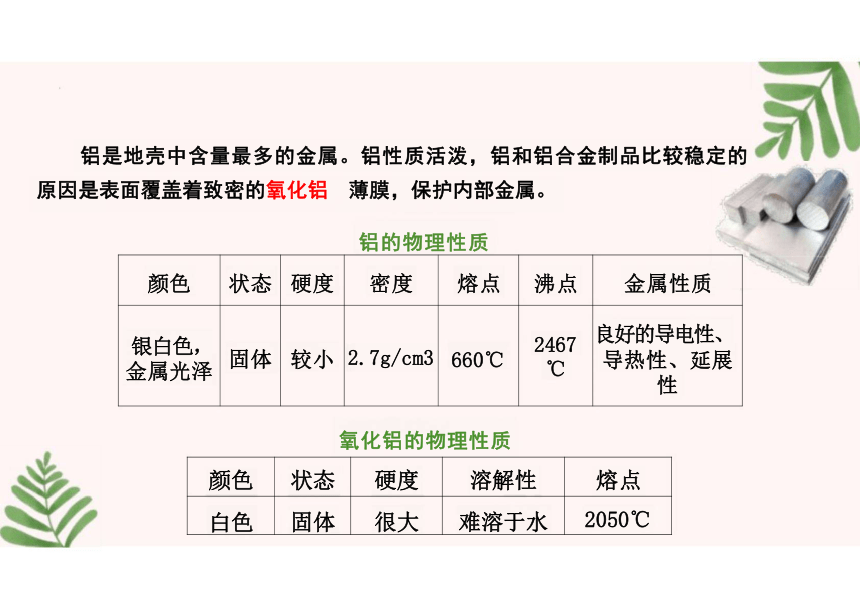
颜色 状态 硬度 密度 熔点 沸点
金属性质
银白色, 金属光泽 固体 较小 2.7g/cm3 660℃ 2467 ℃
良好的导电性、
导热性、延展
性
铝是地壳中含量最多的金属。铝性质活泼,铝和铝合金制品比较稳定的
原因是表面覆盖着致密的氧化铝 薄膜,保护内部金属。
铝的物理性质
颜色 状态 硬度 溶解性
熔点
白色 固体 很大 难溶于水
2050℃
氧化铝的物理性质
铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面
生产一层致密的氧化铝薄膜。
口 氧化铝薄膜(Al O )
口 化学方程式4Al+3O ==2Al O
铝的化学性质
铝被氧化后在表明生成一层致密 的氧化层,阻止铝继续被氧化, 因此铝具有良好的抗腐蚀性。而 铁被氧化后,在表面形成疏松多 孔的铁锈,能吸收水分和二氧化 碳以及氧气,加速内部铁的持续
思考:铝的化学性质比较活泼,为什
么我们通常看见铁生锈而没有看到铝 生锈
铝锅
铁锅
在一支试管中加入5mL 盐酸,再向试管中放入一小块铝片。观察现 象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
铝、氧化铝的性质——与酸反应
实验 现象
铝片逐渐溶解,有无色气泡冒出;将点燃的木条放在试管口 有爆鸣声
方程式
Al O +6HCl==2AICl +3H O、2Al+6HCl==2AICl +3H 个 Al O +6H+==2Al ++3H O、2Al+6H+==2Al ++3H 个
实验现象
在两支试管中分别加入少量的NaOH 溶液,然后向其中一支试管中放入一小块铝 片 , 向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过 一段时间后,将点燃的木条分别放在两支试管口。你观察到什么现象
铝、氧化铝的性质——与碱反应
实验 现象 试管①中一开始无气泡产生, 一段时间后,铝片溶解,有无色气泡 冒出。 试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口, 都有爆鸣声。
方程式 Al O +2NaOH+3H O=— (Al O +2OH-+3H O==2[
2Na[Al(OH) ] 2Al+2NaOH+6H O== 2Na[Al(OH) ] +3H 个
(四羟基合铝酸钠)
Al(OH) ]-) (2Al+2OH-+6H O=== 2[Al(OH) ]- +3H 个)
铝表面有某种物质,能与盐酸和氢氧化钠溶液反应,但不能产生气体;表面的物质反应
完全之后,内部的铝能与盐酸和氢氧化钠溶液继续反应生成可燃性气体。
实验结论
口铝既能与稀盐酸反应又能与NaOH 溶液反应,都生成盐 和氢气。
2Al+6H+=2Al ++3H 个 2 Al+2OH-+6H O=== 2[Al(OH) ]-+3H 个
口氧化铝既能与稀盐酸反应又能与NaOH 溶液反应,都生成盐 _和水。
Al O +6H+—2Al ++3H O Al O +2OH-+3H O= 2 [Al(OH) ] -
铝、氧化铝的性质——总结
两性氧化物 既能与酸反应生成盐和水,又能与碱反应生成 盐和水_的氧化物,如Al O
Al O 溶于盐酸:Al O +6H+—2A ++3H O
Al O 溶于NaOH 溶 液 :2 Al+20H-+6H O===2[Al(OH I+3H ↑
两性氢氧化物 既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)
Al(OH) 溶于盐酸:A(OH) +3HCI—AICl+3H O
Al(OH) 溶于NaOH 溶 液 :Al(OH) +NaOH—Na[Al(OH) A
两性氧化物、两性氢氧化物
例1下列关于除杂试剂的选择不正确的是(括号中的物质为杂质)
( C )
A.Fe O (Al O ):NaOH 溶液 B.Cl (HCl) : 饱和食盐水
C .NaHCO (Na CO ): 澄清石灰水 D.FeCl (FeCl ):Cl
解析:A.氧化铝是两性氧化物,氢氧化钠和氧化铝反应得到偏铝酸钠,可以
除去杂质,A 项正确;B. 饱和食盐水可以吸收HCI, 可以除去杂质,B 项正确;
C. 碳酸钠和碳酸氢钠都会和澄清石灰水反应,不能除去杂质,C项错误D. 氯
气和氯化亚铁反应生成氯化铁,可以除去杂质,D 项正确;答案选C。
B. 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C. 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 D. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热, 熔化后的液态铝会滴落下来,是因为金属铝的熔点较低
解析:铝和NaOH 溶液反应,生成偏铝酸钠和氢气,其离子方程式为2AI+2OH-
+6H O=2[Al(OH) ]-+3H 个,A 错误;铝制品在空气中有很强的抗腐蚀性,主要
是其表面形成致密的氧化膜,而铝是较活泼的金属,其化学性质不稳定,B错误;
无论是铝还是其氧化物都能与酸或碱反应,C正确;打磨后的铝箔在酒精灯上灼 烧 表面生成Al O , 高熔点的Al O 兜住了熔融液态铝,不会滴落,D 错误。
例2下列关于铝单质的叙述中,正确的是( C )
A. 铝 和NaOH溶液反应:Al+2OH-+2H O=[Al(OH) ]-+H
个
②正确;Al O 与NaOH溶液反应生成NaAlO 和H O, 与盐酸反应生成AICl 和H O,
③正确;Na CO 与NaOH 溶液不发生反应,④错误;(NH ) SO 与NaOH 溶液反应生 成NH H O 和Na SO , 与盐酸反应生成NH4Cl 、H O和SO ,⑤ 正确。
①NaHCO ②Al ③Al O ④Na CO
⑤(NH ) SO
A.①②③⑤ B.②③④
C.①③④⑤ D.①②④
解析:NaHCO 与NaOH 溶液反应生成Na CO 和H O, 与盐酸反应生成NaCl、H O
和CO ,① 正 确 ;Al与NaOH 溶液反应生成NaAlO 和H , 与盐酸反应生成AICl 和H ,
例3下列物质中,既能与盐酸反应,又能与NaOH 溶液反应的是
(A)
铝合金
02
成分
性能
铝 Al
强度和硬度较小,不适合制造机械零件等
铝 合 金 ①铝硅合金(含Si质量分数为 13.5%)②硬铝(含Cu 4%、 Mg 0.5%、Mn 0.5%、Si0.7%) (均为质量分数)
①熔点为564℃,比纯铝或硅的熔点低,而
且它在凝固时收缩率又很小。因而,这种 合金适合铸造。②强度和硬度都比纯铝大, 几乎相当于钢材,且密度较小
铝是地壳中含量最多的金属元素,铝合金的种类很多,它们在汽车、船舶、飞 机等制造业上以及在日常生活里的用途很广
铝合金有哪些特点和用途
【注意】由于纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,
生活中使用较多的是具有不同组成和性质的铝合金。
铝不是人体必需的元素,而铝锅对人体有无危害,主要取决于铝锅的使用方式以及使用 频率。通常情况下,在蒸煮料理时使用铝锅,基本上对于人体并无危害。但长期使用铝锅可 能造成铝元素在体内潴留,当累积到一定程度后,对人体具有一定程度的危害,可能引起机 体缺钙、过早衰老、消化功能紊乱、贫血、肝肾损伤等一系列负面影响。
铝锅对人体有害吗
例下列关于铝及铝合金的叙述中,不正确的是( B )
A .铝是地壳中含量最多的金属元素
B. 在自然界中,既存在游离态,又存在化合态的铝
C. 生活中铝制品通常是铝合金制造的,其表面有致密的氧化膜,起 保护内部金属的作用
D. 纯铝硬度和强度小,硬铝(含Cu、Mg、Mn、Si 等)密度小、强度高, 是制造航天设备的理想材料
解析:铝是地壳中含量最多的金属元素,A 正确;Al是活泼金属,在自然界中以化
合态形式存在,B 错误;铝化学性质活泼,表面容易生成一层致密的氧化物保护膜,
对内部金属起到保护作用,使得铝制品在空气中有很强的抗腐蚀性,C 正确;纯铝 硬度和强度小,硬铝密度小、强度高,是制造航天设备的理想材料,D正确。
课堂总结
03
存在
物理性质
化学性质
铝、氧化铝的性质——与酸反应
金
铝、氧化铝的性质———与碱反应
硬铝
铝合金
铝和铝合
铝
课堂检测
04
1.中国国产大型客机C919机身部分采用第三代新型铝锂合金材料。
下列关于铝锂合金的认识不正确的是( D )
A .铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B. 改变原料的配比,可以制得性能不同的铝锂合金
C. 铝锂合金具有金属光泽,可导电导热
D. 铝锂合金的性质与各成分金属的性质完全相同
金属特性的物质,改变原料的配比,可以制得性能不同的铝锂合金;合金一般
比其组分金属的颜色更鲜艳,可导电;合金的熔点比它的各成分金属的熔点低, 硬度大于其成分金属,铝锂合金的性质与各成分金属的性质不完全相同。
【解析】铝锂密度较小,其合金密度较小;合金是不同金属熔合而成的具有
C. 反应中1molAl 失去3/2mol电子
D. 此反应中,只有水是氧化剂,NaOH 既不是氧化剂也不是还原剂
【解析】铝与氢氧化钠溶液发生反应的实质为2Al+6H O= 2Al(OH) +3H 个、
Na OH+Al(OH) =Na[Al(OH) 】, 据此回答;根据反应实质,Al的化合价升高,Al 作还原 剂 ,H O 作氧化剂,NaOH既不是氧化剂也不是还原剂,故A错误;根据铝与
氢氧化钠溶液反应实质,NaOH 既不是氧化剂也不是还原剂,氢气只来自于H O, 故 B错误;反应Al的化合价由0价→+3价,因此1molAl参与反应失去3mol电子,故C错 误;根据上述分析,水是氧化剂,NaOH 既不是氧化剂也不是还原剂,故D正确。
2.有关Al与NaOH 溶液反应的说法中,正确的是(
A .Al是还原剂,NaOH 及H O均是氧化剂
B. 还原产物是H , 且 由H O 还原所得的H 与NaOH
还原所得的H 物
质 的 量 之 比 为 2 : 1
D )
3.铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染
源之一”而加以控制。铝在下列使用场合须加以控制的是A .制铝锭
B. 制电线电缆
C. 用明矾和苏打作食物膨化剂
D. 制防锈油漆
【答案】C
解析:A. 制铝锭,不需要控制用量,不会造成食品污染,故A不符合题意;
B. 制电线电缆,为人类提供电能输送,不需要控制用量,故B不符合题意;
C. 用明矾和苏打作食物膨化剂,使用时严格控制用量,过多长期积累会在人体内不断积累而慢性中毒,故C符 合题意;
D. 制防锈油漆,减缓金属被腐蚀,不需控制,故D不符合题意。
综上所述,答案为C。
4.下列关于金属铝及其化合物的叙述,正确的是
A. 铝耐腐蚀是因为常温下金属铝不能与氧气反应
B. 铝合金密度小,硬度大,耐腐蚀,是制造飞机的理想材料
C. 相同质量的铝分别与足量盐酸和烧碱溶液反应产氢气的质量比为 3 : 1
D. 铝表面有氧化膜保护,铝制器皿可以长时间盛放酸碱性溶液
【答案】B
解析:A.铝耐腐蚀是因为常温下金属铝与氧气反应生成一层致密的氧化铝薄膜,故A错误;
B.铝合金密度小,硬度大,耐腐蚀,是制造飞机的理想材料,故B正确;
C. 铝与酸反应生成氯化铝和H , 铝和烧碱反应生成偏铝酸钠和H ,相同质量的铝分别与足量盐酸和 烧碱溶液反应产氢气的质量比为1:1,故C错误;
D . 氧化铝是两性氢氧化物,氧化铝可以和酸性溶液和碱性溶液反应,故铝制器皿不可以长时间盛放 酸碱性溶液,故D错误;
5.将A、B 两份铝分别放入足量的盐酸和氢氧化钠溶液中,产生的氢气在标准状况下 的体积相同,则A、B的质量比为
A.1:1
B.1:3
C.3:1
D.2:3
【答案】A
解析:2Al+6HCl=2AICl +3H 个,2Al+2H O+2NaOH=2NaAlO +3H 个,由方程式可知,等量的铝分别 与足量的盐酸和氢氧化钠溶液反应生成的氢气在标准状况下体积相等,答案选A。
6.下列关于Al O 的说法正确的是
A .Al O 可以与酸反应,是碱性氧化物
B.Al O 加热分解为铝和氧气
C.Al O 熔点高可以做耐火材料
D. 打磨过的铝条在酒精灯上灼烧会有液体滴落
【答案】C
解析:A.Al O3既可以与酸反应,也可以与碱反应,是两性氧化物,描述错误,不符题意;
B.Al元素金属性强,其单质制备无法通过加热分解获得,描述错误,不符题意;
C.Al O 属于离子晶体,熔点高,不可燃,故常做耐火材料,描述正确,符合题意;
D .铝条表面会形成一层致密氧化膜,Al O 的熔点高于单质铝,且Al O 阻燃,所以铝熔化后会被Al O 膜兜住,
不会滴落,描述错误,不符题意;
综 上 ,本题选C。
感谢观看
第三章铁金属材料
第二节金属材料
课时2铝和铝合金
学习目标
通过实验探究铝和氧化铝的性质及 转化,认识两性氧化物,丰富对金 属多样性的认识
以铝合金为例,能从元素组成上 对合金进行分类,并认识不同类 型金属材料组成、性能与应用的 联系
思考:铝的化学性质比较活泼,为什
么我们通常看见铁生锈而没有看到铝
生 锈
铝锅 铁锅
铝和铝合金
01
颜色 状态 硬度 密度 熔点 沸点
金属性质
银白色, 金属光泽 固体 较小 2.7g/cm3 660℃ 2467 ℃
良好的导电性、
导热性、延展
性
铝是地壳中含量最多的金属。铝性质活泼,铝和铝合金制品比较稳定的
原因是表面覆盖着致密的氧化铝 薄膜,保护内部金属。
铝的物理性质
颜色 状态 硬度 溶解性
熔点
白色 固体 很大 难溶于水
2050℃
氧化铝的物理性质
铝是一种活泼金属,在常温下就能与空气中的氧气发生反应,表面
生产一层致密的氧化铝薄膜。
口 氧化铝薄膜(Al O )
口 化学方程式4Al+3O ==2Al O
铝的化学性质
铝被氧化后在表明生成一层致密 的氧化层,阻止铝继续被氧化, 因此铝具有良好的抗腐蚀性。而 铁被氧化后,在表面形成疏松多 孔的铁锈,能吸收水分和二氧化 碳以及氧气,加速内部铁的持续
思考:铝的化学性质比较活泼,为什
么我们通常看见铁生锈而没有看到铝 生锈
铝锅
铁锅
在一支试管中加入5mL 盐酸,再向试管中放入一小块铝片。观察现 象。过一段时间后,将点燃的木条放在试管口,你观察到什么现象
铝、氧化铝的性质——与酸反应
实验 现象
铝片逐渐溶解,有无色气泡冒出;将点燃的木条放在试管口 有爆鸣声
方程式
Al O +6HCl==2AICl +3H O、2Al+6HCl==2AICl +3H 个 Al O +6H+==2Al ++3H O、2Al+6H+==2Al ++3H 个
实验现象
在两支试管中分别加入少量的NaOH 溶液,然后向其中一支试管中放入一小块铝 片 , 向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过 一段时间后,将点燃的木条分别放在两支试管口。你观察到什么现象
铝、氧化铝的性质——与碱反应
实验 现象 试管①中一开始无气泡产生, 一段时间后,铝片溶解,有无色气泡 冒出。 试管②中铝片溶解,立即产生无色气泡,将点燃的木条放在试管口, 都有爆鸣声。
方程式 Al O +2NaOH+3H O=— (Al O +2OH-+3H O==2[
2Na[Al(OH) ] 2Al+2NaOH+6H O== 2Na[Al(OH) ] +3H 个
(四羟基合铝酸钠)
Al(OH) ]-) (2Al+2OH-+6H O=== 2[Al(OH) ]- +3H 个)
铝表面有某种物质,能与盐酸和氢氧化钠溶液反应,但不能产生气体;表面的物质反应
完全之后,内部的铝能与盐酸和氢氧化钠溶液继续反应生成可燃性气体。
实验结论
口铝既能与稀盐酸反应又能与NaOH 溶液反应,都生成盐 和氢气。
2Al+6H+=2Al ++3H 个 2 Al+2OH-+6H O=== 2[Al(OH) ]-+3H 个
口氧化铝既能与稀盐酸反应又能与NaOH 溶液反应,都生成盐 _和水。
Al O +6H+—2Al ++3H O Al O +2OH-+3H O= 2 [Al(OH) ] -
铝、氧化铝的性质——总结
两性氧化物 既能与酸反应生成盐和水,又能与碱反应生成 盐和水_的氧化物,如Al O
Al O 溶于盐酸:Al O +6H+—2A ++3H O
Al O 溶于NaOH 溶 液 :2 Al+20H-+6H O===2[Al(OH I+3H ↑
两性氢氧化物 既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,如Al(OH)
Al(OH) 溶于盐酸:A(OH) +3HCI—AICl+3H O
Al(OH) 溶于NaOH 溶 液 :Al(OH) +NaOH—Na[Al(OH) A
两性氧化物、两性氢氧化物
例1下列关于除杂试剂的选择不正确的是(括号中的物质为杂质)
( C )
A.Fe O (Al O ):NaOH 溶液 B.Cl (HCl) : 饱和食盐水
C .NaHCO (Na CO ): 澄清石灰水 D.FeCl (FeCl ):Cl
解析:A.氧化铝是两性氧化物,氢氧化钠和氧化铝反应得到偏铝酸钠,可以
除去杂质,A 项正确;B. 饱和食盐水可以吸收HCI, 可以除去杂质,B 项正确;
C. 碳酸钠和碳酸氢钠都会和澄清石灰水反应,不能除去杂质,C项错误D. 氯
气和氯化亚铁反应生成氯化铁,可以除去杂质,D 项正确;答案选C。
B. 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定
C. 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 D. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热, 熔化后的液态铝会滴落下来,是因为金属铝的熔点较低
解析:铝和NaOH 溶液反应,生成偏铝酸钠和氢气,其离子方程式为2AI+2OH-
+6H O=2[Al(OH) ]-+3H 个,A 错误;铝制品在空气中有很强的抗腐蚀性,主要
是其表面形成致密的氧化膜,而铝是较活泼的金属,其化学性质不稳定,B错误;
无论是铝还是其氧化物都能与酸或碱反应,C正确;打磨后的铝箔在酒精灯上灼 烧 表面生成Al O , 高熔点的Al O 兜住了熔融液态铝,不会滴落,D 错误。
例2下列关于铝单质的叙述中,正确的是( C )
A. 铝 和NaOH溶液反应:Al+2OH-+2H O=[Al(OH) ]-+H
个
②正确;Al O 与NaOH溶液反应生成NaAlO 和H O, 与盐酸反应生成AICl 和H O,
③正确;Na CO 与NaOH 溶液不发生反应,④错误;(NH ) SO 与NaOH 溶液反应生 成NH H O 和Na SO , 与盐酸反应生成NH4Cl 、H O和SO ,⑤ 正确。
①NaHCO ②Al ③Al O ④Na CO
⑤(NH ) SO
A.①②③⑤ B.②③④
C.①③④⑤ D.①②④
解析:NaHCO 与NaOH 溶液反应生成Na CO 和H O, 与盐酸反应生成NaCl、H O
和CO ,① 正 确 ;Al与NaOH 溶液反应生成NaAlO 和H , 与盐酸反应生成AICl 和H ,
例3下列物质中,既能与盐酸反应,又能与NaOH 溶液反应的是
(A)
铝合金
02
成分
性能
铝 Al
强度和硬度较小,不适合制造机械零件等
铝 合 金 ①铝硅合金(含Si质量分数为 13.5%)②硬铝(含Cu 4%、 Mg 0.5%、Mn 0.5%、Si0.7%) (均为质量分数)
①熔点为564℃,比纯铝或硅的熔点低,而
且它在凝固时收缩率又很小。因而,这种 合金适合铸造。②强度和硬度都比纯铝大, 几乎相当于钢材,且密度较小
铝是地壳中含量最多的金属元素,铝合金的种类很多,它们在汽车、船舶、飞 机等制造业上以及在日常生活里的用途很广
铝合金有哪些特点和用途
【注意】由于纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,
生活中使用较多的是具有不同组成和性质的铝合金。
铝不是人体必需的元素,而铝锅对人体有无危害,主要取决于铝锅的使用方式以及使用 频率。通常情况下,在蒸煮料理时使用铝锅,基本上对于人体并无危害。但长期使用铝锅可 能造成铝元素在体内潴留,当累积到一定程度后,对人体具有一定程度的危害,可能引起机 体缺钙、过早衰老、消化功能紊乱、贫血、肝肾损伤等一系列负面影响。
铝锅对人体有害吗
例下列关于铝及铝合金的叙述中,不正确的是( B )
A .铝是地壳中含量最多的金属元素
B. 在自然界中,既存在游离态,又存在化合态的铝
C. 生活中铝制品通常是铝合金制造的,其表面有致密的氧化膜,起 保护内部金属的作用
D. 纯铝硬度和强度小,硬铝(含Cu、Mg、Mn、Si 等)密度小、强度高, 是制造航天设备的理想材料
解析:铝是地壳中含量最多的金属元素,A 正确;Al是活泼金属,在自然界中以化
合态形式存在,B 错误;铝化学性质活泼,表面容易生成一层致密的氧化物保护膜,
对内部金属起到保护作用,使得铝制品在空气中有很强的抗腐蚀性,C 正确;纯铝 硬度和强度小,硬铝密度小、强度高,是制造航天设备的理想材料,D正确。
课堂总结
03
存在
物理性质
化学性质
铝、氧化铝的性质——与酸反应
金
铝、氧化铝的性质———与碱反应
硬铝
铝合金
铝和铝合
铝
课堂检测
04
1.中国国产大型客机C919机身部分采用第三代新型铝锂合金材料。
下列关于铝锂合金的认识不正确的是( D )
A .铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B. 改变原料的配比,可以制得性能不同的铝锂合金
C. 铝锂合金具有金属光泽,可导电导热
D. 铝锂合金的性质与各成分金属的性质完全相同
金属特性的物质,改变原料的配比,可以制得性能不同的铝锂合金;合金一般
比其组分金属的颜色更鲜艳,可导电;合金的熔点比它的各成分金属的熔点低, 硬度大于其成分金属,铝锂合金的性质与各成分金属的性质不完全相同。
【解析】铝锂密度较小,其合金密度较小;合金是不同金属熔合而成的具有
C. 反应中1molAl 失去3/2mol电子
D. 此反应中,只有水是氧化剂,NaOH 既不是氧化剂也不是还原剂
【解析】铝与氢氧化钠溶液发生反应的实质为2Al+6H O= 2Al(OH) +3H 个、
Na OH+Al(OH) =Na[Al(OH) 】, 据此回答;根据反应实质,Al的化合价升高,Al 作还原 剂 ,H O 作氧化剂,NaOH既不是氧化剂也不是还原剂,故A错误;根据铝与
氢氧化钠溶液反应实质,NaOH 既不是氧化剂也不是还原剂,氢气只来自于H O, 故 B错误;反应Al的化合价由0价→+3价,因此1molAl参与反应失去3mol电子,故C错 误;根据上述分析,水是氧化剂,NaOH 既不是氧化剂也不是还原剂,故D正确。
2.有关Al与NaOH 溶液反应的说法中,正确的是(
A .Al是还原剂,NaOH 及H O均是氧化剂
B. 还原产物是H , 且 由H O 还原所得的H 与NaOH
还原所得的H 物
质 的 量 之 比 为 2 : 1
D )
3.铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染
源之一”而加以控制。铝在下列使用场合须加以控制的是A .制铝锭
B. 制电线电缆
C. 用明矾和苏打作食物膨化剂
D. 制防锈油漆
【答案】C
解析:A. 制铝锭,不需要控制用量,不会造成食品污染,故A不符合题意;
B. 制电线电缆,为人类提供电能输送,不需要控制用量,故B不符合题意;
C. 用明矾和苏打作食物膨化剂,使用时严格控制用量,过多长期积累会在人体内不断积累而慢性中毒,故C符 合题意;
D. 制防锈油漆,减缓金属被腐蚀,不需控制,故D不符合题意。
综上所述,答案为C。
4.下列关于金属铝及其化合物的叙述,正确的是
A. 铝耐腐蚀是因为常温下金属铝不能与氧气反应
B. 铝合金密度小,硬度大,耐腐蚀,是制造飞机的理想材料
C. 相同质量的铝分别与足量盐酸和烧碱溶液反应产氢气的质量比为 3 : 1
D. 铝表面有氧化膜保护,铝制器皿可以长时间盛放酸碱性溶液
【答案】B
解析:A.铝耐腐蚀是因为常温下金属铝与氧气反应生成一层致密的氧化铝薄膜,故A错误;
B.铝合金密度小,硬度大,耐腐蚀,是制造飞机的理想材料,故B正确;
C. 铝与酸反应生成氯化铝和H , 铝和烧碱反应生成偏铝酸钠和H ,相同质量的铝分别与足量盐酸和 烧碱溶液反应产氢气的质量比为1:1,故C错误;
D . 氧化铝是两性氢氧化物,氧化铝可以和酸性溶液和碱性溶液反应,故铝制器皿不可以长时间盛放 酸碱性溶液,故D错误;
5.将A、B 两份铝分别放入足量的盐酸和氢氧化钠溶液中,产生的氢气在标准状况下 的体积相同,则A、B的质量比为
A.1:1
B.1:3
C.3:1
D.2:3
【答案】A
解析:2Al+6HCl=2AICl +3H 个,2Al+2H O+2NaOH=2NaAlO +3H 个,由方程式可知,等量的铝分别 与足量的盐酸和氢氧化钠溶液反应生成的氢气在标准状况下体积相等,答案选A。
6.下列关于Al O 的说法正确的是
A .Al O 可以与酸反应,是碱性氧化物
B.Al O 加热分解为铝和氧气
C.Al O 熔点高可以做耐火材料
D. 打磨过的铝条在酒精灯上灼烧会有液体滴落
【答案】C
解析:A.Al O3既可以与酸反应,也可以与碱反应,是两性氧化物,描述错误,不符题意;
B.Al元素金属性强,其单质制备无法通过加热分解获得,描述错误,不符题意;
C.Al O 属于离子晶体,熔点高,不可燃,故常做耐火材料,描述正确,符合题意;
D .铝条表面会形成一层致密氧化膜,Al O 的熔点高于单质铝,且Al O 阻燃,所以铝熔化后会被Al O 膜兜住,
不会滴落,描述错误,不符题意;
综 上 ,本题选C。
感谢观看
