氧化还原反应高一化学人教版(2019)必修第一册(共20张PPT)
文档属性
| 名称 | 氧化还原反应高一化学人教版(2019)必修第一册(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:06:44 | ||
图片预览







文档简介
(共20张PPT)
氧化还原反应
第 一 章 物 质 及 其 变 化
1.通过对化合价和电子转移的分析,微观上认识氧化还原反应的本质。
2.掌握氧化还原反应中电子转移的表示方法(单线桥、双线桥)
发生了氧化还原反应
只有得氧(或失氧)的反应才是氧化反应(或还原反应)吗 这类反应的本质是什么
一 、多角度认识氧化还原反应 1.从得失氧的角度认识氧化还原反应
思考与讨论
(1)请根据初中学过的氧化反应和还氧反应的知识,分析以下反应,完成下表。
物质 反应物
发生的反应(氧化反应或还氧反应)
得氧物质 C、CO
氧化反应
失氧物质 CuO、Fe O
还原反应
高温
Fe O +3 CO=2Fe+3 CO
高温
2CuO+C=2Cu+CO 个
注意:得失氧是同时发生!
一 、多角度认识氧化还原反应 1.从得失氧的角度认识氧化还原反应
得到氧,被氧化,氧化反应
失去氧,被还原,还原反应
一种物质得到氧发生 氧化反应,同时另一种物质失去氧发生还 原反
应的反应叫氧化还原反应。得氧和失氧的反应只是氧化还原反应中的一部分。
Fe+CuSO ——Cu+FeSO
2.从元素化合价升降的角度认识氧化还原反应
【问题】以上反应在得氧失氧的同时,元素的化合价是否发生了变化 标出 各元素的化合价。
化合价升 高 ,得到氧,被氧化,氧化反应
F 83+3c02高温2re+3Co
化合价降低,失去氧,被还原,还原反应
化合价升高,被氧化,氧化反应
0 +2 0 +2
Fe+CuSO = Cu+FeSO
化合价降 低 ,被还原,还原反应
氧化还原反应的特征现象:反应前后元素化合价发生变化。——判断依据
思考与讨论:是什么原因导致元素的化合价发生变化的呢 化合价的变化是不
是跟电子的转移有关呢
导线中有电 子通过
化合价升高,得到氧,被氧化,氧化反应
Fe O +3Co2 高温-2Fe +3CO 个 碳棒
铁片
CuSO
化合价降低,失去氧,被还原,还原反应
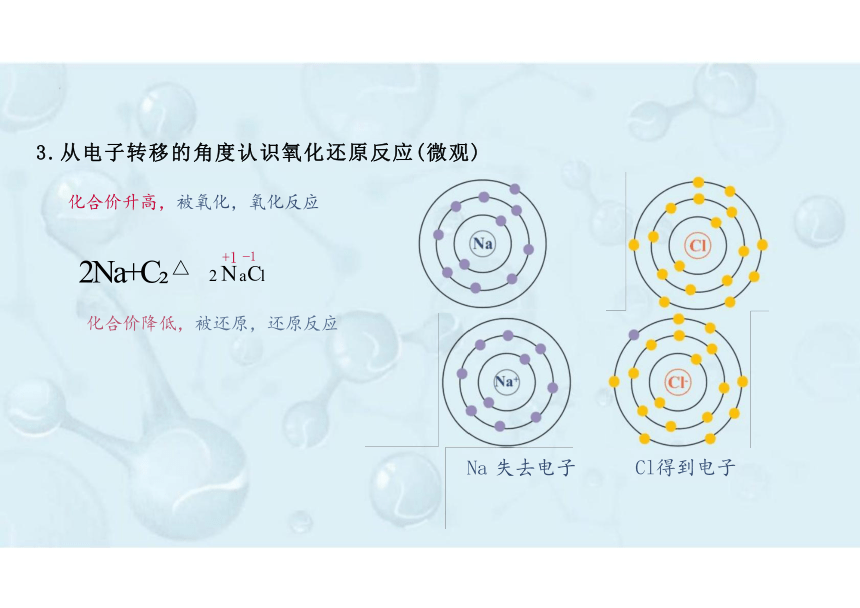
Na 失去电子
化合价升高,被氧化,氧化反应
2Na+C △ 2 a l
化合价降低,被还原,还原反应
-
C
1
N
+1
3.从电子转移的角度认识氧化还原反应(微观)
Cl得到电子
电子对偏向,化合价降低,被还原,还原反应
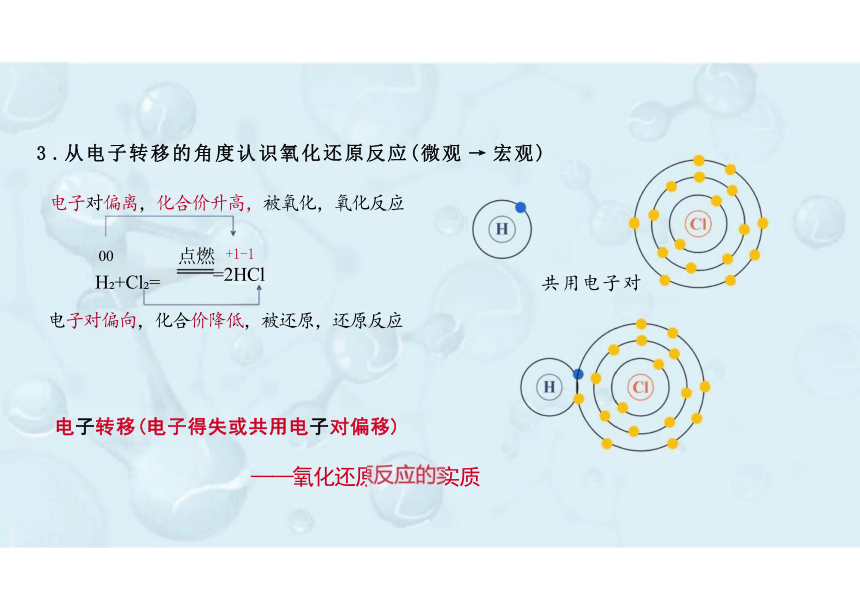
电子转移(电子得失或共用电子对偏移)
——氧化还原反应的实质
3 .从电子转移的角度认识氧化还原反应(微观 → 宏观)
电子对偏离,化合价升高,被氧化,氧化反应
点燃 +1-1 =2HCl
00
H +Cl =
共用电子对
化合反应:有单质参加的是氧化还原反应;
分解反应:有单质生成的是氧化还原反应;
置换反应:全部是氧化还原反应;
复分解反应:都是非氧化还原反应。
分解反应
氧化还原反应
化合反应
置换反应
二、氧化还原反应与基本反应类型的关系
二 、氧化还原反应与基本反应类型的关系
分解反应
有单质参加或生成的化学反 应一定是氧化还原反应吗
氧化还原反应
置换反应
不一定,30 点= 燃 2 0
复分解反应
化合反应
三、氧化还原反应中电子转移的表示方法
1.双线桥法表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
标 价 态 :正确标出反应前后各元素的化合价, 失去2×e-,化合价升高,被氧化
明确变价元素的化合价升降关系
连双线:反应物指向生成物同种元素
注得 失 :标出“失去”或“得到”电子的总数
得失电子总数表示:原子个数×每个原子得失电子数
得到2×e, 化合价降低,被还原
双线桥法的注意事项
· 必须注明“得到”或“失去”
· 电子转移数用a× be-形式表示,a 表示发生氧化反应或还原反应的原子个数, b表示每个原子得到或失去的电子数,当a=1 或b=1 时,要省略
· 得失电子数守恒
请用双线桥法标出以下反应的电子转移:
Fe+CuSO =FeSO +Cu Fe O +3CO 高 温 2Fe+3CO
三、氧化还原反应中电子转移的表示方法
2.单线桥法表示反应过程中不同元素原子间的电子转移情况。
标 价 态 :正确标出反应前后各元素的化合价,
明确变价元素的化合价升降关系
连单 线:始于被氧化的物质中的化合价升高
的元素,止于被还原的物质中的化合价降低
的元素
注得失 :标出转移电子的总数
请用单线桥法标出以下反应的电子转移:
Fe+CuSO =FeSO +Cu Fe O +3CO 高 温 2Fe+3CO
1.概念辨析
氧化还原反应中一定有氧元素的得失(×)
氧化还原反应中得电子的物质发生还原反应( √ )
氧化还原反应中一种元素被氧化,则一定有另一种元素被还原(×) 一个反应中可以只有元素化合价升高,而无元素化合价降低(×)
有单质参加的反应一定是氧化还原反应(×)
2.下列化学反应中,属于氧化还原反应的是 B
A.Na CO +CaCl =CaCO J+2NaCl
B.Fe+CuSO =Cu+FeSO
C.2NaHCO =△Na CO +CO 个+H O
D.CaO+H O=Ca(OH)
A. 2Cl +2Ca(OH) =CaCl +Ca(CIO) +2H O
失去e-
失去6e-
C.H S+H SO (浓)=SJ+SO 个+2H O 得到6e
3.下列氧化还原反应方程式中,电子转移方向和数目正确的是 D
得到e-
失去2×e-
得到3e-
得到e-
△
2KMnO = K MnO +MnO +O 个
失去2×2e-
B.
D.
4.两份等质量的KClO 分别发生下述反应:①有MnO 催化剂存在时,受热完全分解得
到氧气, 用催化剂,加热至470℃左右得到KCIO (高
氯酸钾)和 0
下列关于反应①和②的说法不正确的是 D
A. 都属于氧化还原反应
B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同
D. 生成KCl的质量相同
氧化还原反应
第 一 章 物 质 及 其 变 化
1.通过对化合价和电子转移的分析,微观上认识氧化还原反应的本质。
2.掌握氧化还原反应中电子转移的表示方法(单线桥、双线桥)
发生了氧化还原反应
只有得氧(或失氧)的反应才是氧化反应(或还原反应)吗 这类反应的本质是什么
一 、多角度认识氧化还原反应 1.从得失氧的角度认识氧化还原反应
思考与讨论
(1)请根据初中学过的氧化反应和还氧反应的知识,分析以下反应,完成下表。
物质 反应物
发生的反应(氧化反应或还氧反应)
得氧物质 C、CO
氧化反应
失氧物质 CuO、Fe O
还原反应
高温
Fe O +3 CO=2Fe+3 CO
高温
2CuO+C=2Cu+CO 个
注意:得失氧是同时发生!
一 、多角度认识氧化还原反应 1.从得失氧的角度认识氧化还原反应
得到氧,被氧化,氧化反应
失去氧,被还原,还原反应
一种物质得到氧发生 氧化反应,同时另一种物质失去氧发生还 原反
应的反应叫氧化还原反应。得氧和失氧的反应只是氧化还原反应中的一部分。
Fe+CuSO ——Cu+FeSO
2.从元素化合价升降的角度认识氧化还原反应
【问题】以上反应在得氧失氧的同时,元素的化合价是否发生了变化 标出 各元素的化合价。
化合价升 高 ,得到氧,被氧化,氧化反应
F 83+3c02高温2re+3Co
化合价降低,失去氧,被还原,还原反应
化合价升高,被氧化,氧化反应
0 +2 0 +2
Fe+CuSO = Cu+FeSO
化合价降 低 ,被还原,还原反应
氧化还原反应的特征现象:反应前后元素化合价发生变化。——判断依据
思考与讨论:是什么原因导致元素的化合价发生变化的呢 化合价的变化是不
是跟电子的转移有关呢
导线中有电 子通过
化合价升高,得到氧,被氧化,氧化反应
Fe O +3Co2 高温-2Fe +3CO 个 碳棒
铁片
CuSO
化合价降低,失去氧,被还原,还原反应
Na 失去电子
化合价升高,被氧化,氧化反应
2Na+C △ 2 a l
化合价降低,被还原,还原反应
-
C
1
N
+1
3.从电子转移的角度认识氧化还原反应(微观)
Cl得到电子
电子对偏向,化合价降低,被还原,还原反应
电子转移(电子得失或共用电子对偏移)
——氧化还原反应的实质
3 .从电子转移的角度认识氧化还原反应(微观 → 宏观)
电子对偏离,化合价升高,被氧化,氧化反应
点燃 +1-1 =2HCl
00
H +Cl =
共用电子对
化合反应:有单质参加的是氧化还原反应;
分解反应:有单质生成的是氧化还原反应;
置换反应:全部是氧化还原反应;
复分解反应:都是非氧化还原反应。
分解反应
氧化还原反应
化合反应
置换反应
二、氧化还原反应与基本反应类型的关系
二 、氧化还原反应与基本反应类型的关系
分解反应
有单质参加或生成的化学反 应一定是氧化还原反应吗
氧化还原反应
置换反应
不一定,30 点= 燃 2 0
复分解反应
化合反应
三、氧化还原反应中电子转移的表示方法
1.双线桥法表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
标 价 态 :正确标出反应前后各元素的化合价, 失去2×e-,化合价升高,被氧化
明确变价元素的化合价升降关系
连双线:反应物指向生成物同种元素
注得 失 :标出“失去”或“得到”电子的总数
得失电子总数表示:原子个数×每个原子得失电子数
得到2×e, 化合价降低,被还原
双线桥法的注意事项
· 必须注明“得到”或“失去”
· 电子转移数用a× be-形式表示,a 表示发生氧化反应或还原反应的原子个数, b表示每个原子得到或失去的电子数,当a=1 或b=1 时,要省略
· 得失电子数守恒
请用双线桥法标出以下反应的电子转移:
Fe+CuSO =FeSO +Cu Fe O +3CO 高 温 2Fe+3CO
三、氧化还原反应中电子转移的表示方法
2.单线桥法表示反应过程中不同元素原子间的电子转移情况。
标 价 态 :正确标出反应前后各元素的化合价,
明确变价元素的化合价升降关系
连单 线:始于被氧化的物质中的化合价升高
的元素,止于被还原的物质中的化合价降低
的元素
注得失 :标出转移电子的总数
请用单线桥法标出以下反应的电子转移:
Fe+CuSO =FeSO +Cu Fe O +3CO 高 温 2Fe+3CO
1.概念辨析
氧化还原反应中一定有氧元素的得失(×)
氧化还原反应中得电子的物质发生还原反应( √ )
氧化还原反应中一种元素被氧化,则一定有另一种元素被还原(×) 一个反应中可以只有元素化合价升高,而无元素化合价降低(×)
有单质参加的反应一定是氧化还原反应(×)
2.下列化学反应中,属于氧化还原反应的是 B
A.Na CO +CaCl =CaCO J+2NaCl
B.Fe+CuSO =Cu+FeSO
C.2NaHCO =△Na CO +CO 个+H O
D.CaO+H O=Ca(OH)
A. 2Cl +2Ca(OH) =CaCl +Ca(CIO) +2H O
失去e-
失去6e-
C.H S+H SO (浓)=SJ+SO 个+2H O 得到6e
3.下列氧化还原反应方程式中,电子转移方向和数目正确的是 D
得到e-
失去2×e-
得到3e-
得到e-
△
2KMnO = K MnO +MnO +O 个
失去2×2e-
B.
D.
4.两份等质量的KClO 分别发生下述反应:①有MnO 催化剂存在时,受热完全分解得
到氧气, 用催化剂,加热至470℃左右得到KCIO (高
氯酸钾)和 0
下列关于反应①和②的说法不正确的是 D
A. 都属于氧化还原反应
B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同
D. 生成KCl的质量相同
