元素周期表 高一上学期化学人教版(2019)必修第一册(共27张PPT)
文档属性
| 名称 | 元素周期表 高一上学期化学人教版(2019)必修第一册(共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 00:00:00 | ||
图片预览







文档简介
(共27张PPT)
新人教版高中化学必修1(2019)
第四章物质结构元素周期律
第一节 原子结构元素周期表
第2课时元素周期表
1. 了解元素周期表的发展历程。
2.掌握元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
重点:元素周期表的编排规则及结构。
难点:根据原子结构确定元素原子在元素周期 表中的位置。
学习目标 重点难点
九九乘法口诀表 牛顿定律
(选择一项定律来开始)
第二定律 第三定律
计
3x5=1
三六十八
3x6=18
七二十
3x7=21
三八二十四
3x8=24
三九二十t
3x9=27
x4=
-五得五
1x5=5
一六得六 1×6=6
-七得七
1x7=7
-八得八
1x8=8
一九得九
1x9=9
4×5=20
六二+
4×6=2
四七二十八
4x7=28
四八三十二
4×8=32
四九三十六
4x9=3
五一
2×5=10
十二
2×6=12
二七十四
2×7=14
二八十大
2×8=16
二九十八
2x9=18
三十
7=39
八四十 8=4(
沈 a 十
9=
第一定律
九
光 热 氧 氮 氢 硫 磷 碳 铋 钼
镁氧
盐酸基 钴 镍
硅石
氟基 铜 金
石灰
硼酸基 锡 铂
钡土
锑 铁 铅
矾土
银 锰 钨
砷 汞 锌
1789年,法国化学家拉瓦锡在专著《化学概要》里,运用分类
比较法列出了第一张化学元素表,开创了元素分类研究的先河。
一、元素周期表的发展历程 法国 拉瓦锡
拉瓦锡的化学元素表
1829年,德国化学家德贝莱纳根据元素性质的相似性提出了“三素
组”学说。指出同组类三个元素不仅性质相似,而且中间元素原子量 也等于前后两元素原子量的平均值。
Li Na K Ca Sr Ba
原 子 量 7 23 39 40 88 137
(7+39)/2=23 (40+137)/2=88.5
Cl Br 1 S Se Te
原子量35.5 80 127 32 79 128
(35.5+127)2=81 (32+128)2=80
德国德贝莱纳“三素组”学说
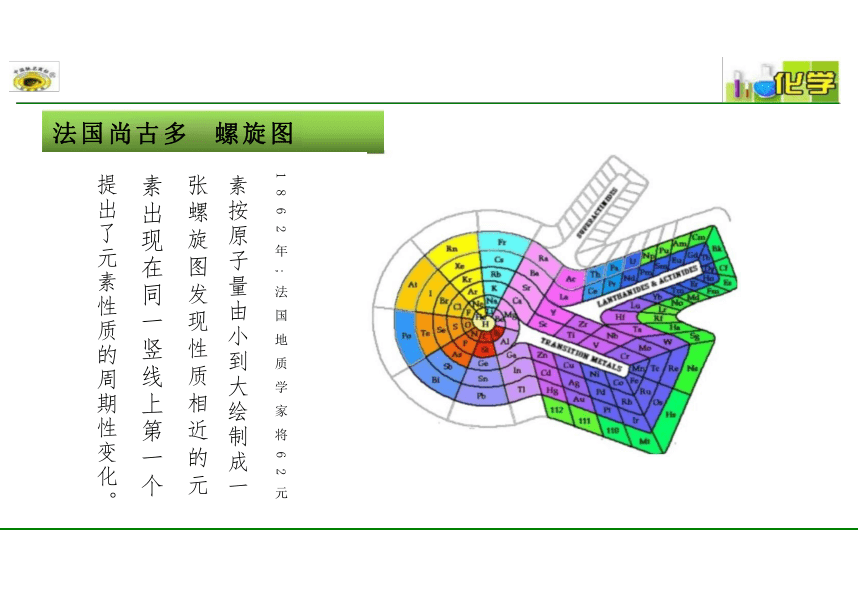
素按原子量由小到大绘制成一
张螺旋图发现性质相近的元 素出现在同一竖线上第一个 提出了元素性质的周期性变化。
法国尚古多 螺旋图
1 8 6 2 年 ; 法 国 地 质 学 家 将 6 2 元
1864年,德国化学家迈耶尔按原子量由小到大排出了六元素表,该
表对元素进行了分族,有了周期的雏形,向元素周期律迈出了第一步。
4价 C 12.0 16.5 Si 28.5 44.5591) 44. Sn 117.6
3价 2 价
N 14.4
16.95
P 31.0
44.0
As 75.0
45.6
Sb 120.6
1价
Li 7.03
16.02
Na 23.5
16.08
K 39.13
46.3
Rb 85.4
47.6
Cs 133.0
35.5
(TI 204.07) 1 价
Cu 63.5
德国迈尔六元素表
1价
F 19.0 16.46
CI 35.46
44.51
Br 79.97
46.8
I 126.8
2 价
Zn 65.0
迈 耶 尔 的 《 六 元 素 事
2价
(Be 9.3)
(14.7) Mg 24.0 16.0
Ca 40.0
47.0 Sr 87.0
49.0
Ba 137.1
差值
差值
差值
差值
差值
16.00 16.07 32.0
46.7
78.8
49.5
128.3
Bi 208.0 4价
Ni 58.7
4价 Co 58.7
437(874)
207.0 4价
Pb
Te
Se
s
0
1865年,英国人纽兰兹发现按元素原子量由小到大的顺序排列中,
每8种元素之后,会重复出现相似的性质。他把他的发现称为“八音 律”。揭示了元素性质与原子量之间密切关系。
H F Cl Co/Ni Br Pd I
Pt/Ir
Li Na K Cu Rb Ag Cs
TI
G Mg Ca Zn Sr Cd Ba/V
Pb
Bo Al Cr Y Ce/La U Ta
Th
C Si Ti In Zn Sn W
Hg
N P Mn AS DiMo Sb Nb
Bi
0 S Fe Se Ro/Ru Te Au
Os
纽兰兹“八音律”
Newlands'Arranged Elements in Octaves:
20up eid TU W W
H=1
2 Li=7 Be=9.4 B=11 C=12 N=14 O=16 F=19
3 Na=23 Mg=24 Al=27.3 Si=28 P=31 S=32 C1=35.5
4 K=39 Ca=40 2=44 Ti=48 V=51 Cr=52 Mn=55
Fe-56,Co-59
NH-59
5 Cu=63 Zn=65 =68 =72 As=75 Se=78 Br=80
6 Rb=85 Sr=87 Yt=88 Zr=90 Nb=94 Mo=96 =100
Ru-104,Rh-104
Pd-106
7 Ag=108 Cd=112 In=113 Sn=118 Sb=122 Te=125 J=127
8 Cs=133 Ba=137 Di=138 Ce=140
9
10 Er=178 La=180 Ta=182 W=184
Os-195hr-197
Pi198
1工 Au=199 Hg=200 Tl=204 Pb=207 Bi=208
1 Th=231 U=240
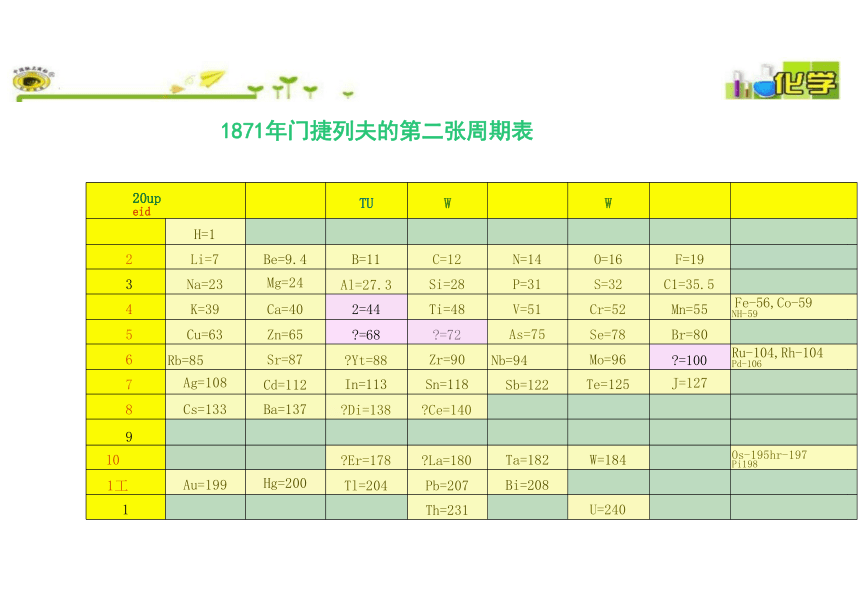
1871年门捷列夫的第二张周期表
元素周期表的后期演化
在门捷列夫周期表的指引下,科学家们经过不断探索和研究,新 的元素不断被发现,周期表中的空位先后被填满,20世纪后随着原子 结构的奥秘被揭示,证实了元素的核电荷数决定元素的化学性质,元 素周期表中的排序依据由相对原子质量变为核电荷数。周期表就逐渐 完善和演变成我们现在的元素周期表。
周期 IA 元 素 周 期 表 0 电子层
0
电子数
1 1 H Is 1.008 2 He 氮 4.003 K
2
目 A 2 原子序数 元素名称 注*的是 人造元素 92 U 铀 516d'7 238.0 元素符号, 色 指放射性元素 非 会 国 元 素 金属元率 田A 13 IVA 14 VA 15 VIA 16 YA 17 份层电子排布。括号 指可能的电子排有 相 对 罩 子 质 量 ( 加 括 号 的 数 过渡元素 稀有气体元素 据为该放射性元素半章期最 长同使素的或量数) 2 3Li 锂 6.941 4 Be 坡 s 9.012 5 B 磷 s o 10.81 6C 碳 Yp 12.0t 7 N 14.0t 80 氧 7p 16.00 9 F 氯 22p 19.00 Ne 20.18 1 K
3 11 Na 钠 22.99 12 Mg 镁 24.31 13AI 铝 26.98 14 Si 硅 p 28.09 15 P 30.97 16S 碱 sg 32.06 17 CI 35.45 18Ar 39.95 【
8 8
ⅢB 3 rVB 4 VB 5 MIB 6 VIIB 7 8 9 10 1B 11 DB 12 4 19 K 钾 4e 39.10 20 Ca 15 4 40.08 21 Se 筑 44.96 12 T 钛 304 47.87 23 W 钒 '4 50.94 24 Cr 铬 4 52.00 25.Mn 54.94 16 Fe 铁 d 55.85 27 Co 钻 3d4 58.93 28 Ni 58.69 Cu 29 铜 63.55 30 Zn 锌 d 65.38 1Ga 镓 p 69.72 32 Ge 锗 4p 72.63 33 As 砷 w4p 74.92 34 Se 硒 '4p 78.96 35 Br 79.90 Kr p 83.8 【 K
。 通事的
5 37 Rb 物 85.47 38 Sr 锶 87.62 39 Y 钇 4d 88.91 40 Zr 结 4d 91.22 41 Nb 铌 5 92.91 42 Mo 钼 ds 95.96 43 Te 98] 44 Ru 钌 101.1 45 Rh 铑 4dss 102.9 46 Pd 语 106.4 47 Ag 银 d 107.9 48 Cd 镉 4d7 112.4 49 In 铟 5s55p 114.8 50 Sn 锡 3 118.7 51 Sb 锑 34'5p 121.8 52 Te 127.6 53 126.9 54 Xe 131.3 黑 【 参 子
8事
6 55 Cs 铯 s 132.9 56 Ba 钡 37.3 57-71 La~Lu 镧系 72 H 给 sd8 178.5 73 Ta 钽 506 180.9 74 W 钨 183.8 75 Re 铼 56 186.2 76 Os 钱 sft 190.2 77 Ir 铱 Sf6g 1922 78 Pt 铂 195. 6e 79 Au 金 d t 197.0 80 Hg 汞 200.6 81 T 铊 hcnp 204.4 82 Pb 铅 207.2 83 Bi 钝 s'op 209.0 84 Po 钋 06or [209] 85 At 砹 6it [210] 80 氧 [222] g
。言谓器。的
7 87 Fr 钫 [223] 88 Ra 错 [226] 89-103 Ac-1r 啊系 104 Rf 护 16d7 [265] 10s Db 继* 16d7 [268] 106 S 镇* (271) 107 Bh 该* [270] 10s Hs 锂* [277] 109 Mt 钱* [2761 110 )s 话* (2811 111 Rg 纶 [280] 112 Cn * [285] 113 Nh 你* [284] 114 铁* [289] 115 Me 馍* [2881 116 Lw 位* [2931 117 Ts 础* [294] IEi0 [294] fl nnpd
之 要 a 心
1 Lu 馅 41sd6e 175.0 系 571a 6 138.9 58 Ce 41sd 140.1 59 Pr 错 41 1409 60 Nd 钕 4(% 144.2 Pn 钷* [145] Sm 钐 40h 150.4 63 Eu 铕 4(6 152.0 64 Gd 钆 Csd 157.3 65 Tb 域 4m 1589 66 Dy 镝 426 162.5 67 Ho 钬 416 164.9 68 Er 饵 416 167.3 69 Tm 铥 4r't 168.9 70 Yb 地 4rte 173.1 钢系 89 Ac 钢 6d' [2271 Th 社 232.0 91 P 锁 SF6d 7y 2310 92 U 镇 31nd 238.0 93 Np 5(md [237] 94 Pu 钚 5r7 [244] 95 Am 5 [2431 96Cm 锡* sT6' [247] 97 jsk 铬 17 [2471 98Cf 钢* s0N [251] 99 Fs 镇 5707w [2521 ton Fm 项* 5F7 [257] 101 Md 们* (S4° [258] 102 No 锗 SrM [259] 1031 捞* (5Pkd83 [2621
墨
领
溴
你有什么启示
与感悟呢
科学精神 科学态度 科学方法
氢 ( H )
氪 ( H e )
(Li) 铍 ( B e ) 硬 ( B ) 碳 ( C ) 氮 ( N ) 氧 ( O ) 氟(F)
(Ne)
钠 O N a ) 镁 ( M g ) 8(A1) 4 (P) 硫 ( S ) 叙(c1)
氙 ( A r )
硅(Si) 钾(K) 钙 ( C a )
请同学们练习写出1-20号元素原子的结构示意图
1 — — 2 0 号 元 素 的 名 称 、 符 号 、 原 子 结 构 示 意 图
周期 IA 元 素 周 期 表 0 电子层
0
电子数
1 1 H Is 1.008 2 He 氮 4.003 K
2
目 A 2 原子序数 元素名称 注*的是 人造元素 92 U 铀 516d'7 238.0 元素符号, 色 指放射性元素 非 会 国 元 素 金属元率 田A 13 IVA 14 VA 15 VIA 16 YA 17 份层电子排布。括号 指可能的电子排有 相 对 罩 子 质 量 ( 加 括 号 的 数 过渡元素 稀有气体元素 据为该放射性元素半章期最 长同使素的或量数) 2 3Li 锂 6.941 4 Be 坡 s 9.012 5 B 磷 s o 10.81 6C 碳 Yp 12.0t 7 N 14.0t 80 氧 7p 16.00 9 F 氯 22p 19.00 Ne 20.18 1 K
3 11 Na 钠 22.99 12 Mg 镁 24.31 13AI 铝 26.98 14 Si 硅 p 28.09 15 P 30.97 16S 碱 sg 32.06 17 CI 35.45 18Ar 39.95 【
8 8
ⅢB 3 rVB 4 VB 5 MIB 6 VIIB 7 8 9 10 1B 11 DB 12 4 19 K 钾 4e 39.10 20 Ca 15 4 40.08 21 Se 筑 44.96 12 T 钛 304 47.87 23 W 钒 '4 50.94 24 Cr 铬 4 52.00 25.Mn 54.94 16 Fe 铁 d 55.85 27 Co 钻 3d4 58.93 28 Ni 58.69 Cu 29 铜 63.55 30 Zn 锌 d 65.38 1Ga 镓 p 69.72 32 Ge 锗 4p 72.63 33 As 砷 w4p 74.92 34 Se 硒 '4p 78.96 35 Br 79.90 Kr p 83.8 【 K
。 通事的
5 37 Rb 物 85.47 38 Sr 锶 87.62 39 Y 钇 4d 88.91 40 Zr 结 4d 91.22 41 Nb 铌 5 92.91 42 Mo 钼 ds 95.96 43 Te 98] 44 Ru 钌 101.1 45 Rh 铑 4dss 102.9 46 Pd 语 106.4 47 Ag 银 d 107.9 48 Cd 镉 4d7 112.4 49 In 铟 5s55p 114.8 50 Sn 锡 3 118.7 51 Sb 锑 34'5p 121.8 52 Te 127.6 53 126.9 54 Xe 131.3 黑 【 参 子
8事
6 55 Cs 铯 s 132.9 56 Ba 钡 37.3 57-71 La~Lu 镧系 72 H 给 sd8 178.5 73 Ta 钽 506 180.9 74 W 钨 183.8 75 Re 铼 56 186.2 76 Os 钱 sft 190.2 77 Ir 铱 Sf6g 1922 78 Pt 铂 195. 6e 79 Au 金 d t 197.0 80 Hg 汞 200.6 81 T 铊 hcnp 204.4 82 Pb 铅 207.2 83 Bi 钝 s'op 209.0 84 Po 钋 06or [209] 85 At 砹 6it [210] 80 氧 [222] g
。言谓器。的
7 87 Fr 钫 [223] 88 Ra 错 [226] 89-103 Ac-1r 啊系 104 Rf 护 16d7 [265] 10s Db 继* 16d7 [268] 106 S 镇* (271) 107 Bh 该* [270] 10s Hs 锂* [277] 109 Mt 钱* [2761 110 )s 话* (2811 111 Rg 纶 [280] 112 Cn * [285] 113 Nh 你* [284] 114 铁* [289] 115 Me 馍* [2881 116 Lw 位* [2931 117 Ts 础* [294] IEi0 [294] fl nnpd
之 要 a 心
1 Lu 馅 41sd6e 175.0 系 571a 6 138.9 58 Ce 41sd 140.1 59 Pr 错 41 1409 60 Nd 钕 4(% 144.2 Pn 钷* [145] Sm 钐 40h 150.4 63 Eu 铕 4(6 152.0 64 Gd 钆 Csd 157.3 65 Tb 域 4m 1589 66 Dy 镝 426 162.5 67 Ho 钬 416 164.9 68 Er 饵 416 167.3 69 Tm 铥 4r't 168.9 70 Yb 地 4rte 173.1 钢系 89 Ac 钢 6d' [2271 Th 社 232.0 91 P 锁 SF6d 7y 2310 92 U 镇 31nd 238.0 93 Np 5(md [237] 94 Pu 钚 5r7 [244] 95 Am 5 [2431 96Cm 锡* sT6' [247] 97 jsk 铬 17 [2471 98Cf 钢* s0N [251] 99 Fs 镇 5707w [2521 ton Fm 项* 5F7 [257] 101 Md 们* (S4° [258] 102 No 锗 SrM [259] 1031 捞* (5Pkd83 [2621
墨
领
溴
(1)按原子序数的递增顺序从左到右排列
(2)将电子层数相同的元素排列成一个横行
(3)将最外层电子数相同的元素排成一个纵行。
2.根据前20号元素的原子结构示意图及位置。尝试总结出元素周期
表的编排规则
原子序数 = 核电荷数(质子数)=(原子)核外电子数
1.什么叫原子序数 原子序数与元素原子结构间有什么内在联系
周期序数 起止元素 元素种数
电子层数
1 H~ He 2
1
2 Li~Ne 8
2
第一周 期:8种 种=2×3 =2×42。 期的元 九周期 7 期:2种=2 =2×22; 2;第六、 以此规 素种类应 的元素被 Fr~Og ×12;第二、三周 第四、五周期:18 七周期:32种 律递推,第八、九周 该50种=2×52;第八 全部发现会有50种。 32
7
问题:
1.周期元素的编排原则是什么
2.同周期元素原子结构有什么共同 点和不同点
3.周期是如何分类,分类依据是什 么
4.根据周期的元素种类数,你能预 测出第八、九周期会有多少种元素
对下表中的项目进行讨论交流,并将讨论结果填写在表中。 思考回答相关问题。
【思考交流】
第一周期
第二周期
第三周期 第四周期: 第五周期:
第六周期:
第七周期:
二 、元素周期表的周期结构:
三短四长
2种元素
8种元素 8种元素
18种元素 18种元素 32种元素 32种元素
短周期
长周期
周期
periods
(横向)
三 、元素周期表的族结构:
请同学们认真阅读教材89-90页的教学内容,思考回答下列问题。
1.元素周期表有18列,分为16个族,是哪些族
是1个零族,1个第VⅢ族(3个纵列)7个主族,7个副族。
2.族的分类依据是什么 如何表示
由长周期和短周期共同组成的族为主族,主族用A表示,
完全由长周期元素组成的族为副族,副族用B表示
族序数用罗马数字I 、IⅡ 、Ⅲ 、IV 、V 、VI 、VⅡ 、I表示 比如:IVA族表示第四主族;VIB族表示第六副族
第VIⅢ族为8、9、10三个纵列。
稀有气体元素叫0族。
同一主族元素原子的最外层电子数相同,电子层数 由上到下依次增多。
4.同一主族元素原子的结构有什么共同点和不同点
3.主族序数与元素的原子结构之间有什么的关系
主族序数=原子最外层电子数
0 IA 主 LIA 族 主族序数=最外层 副 族7 个第 八 族 电子 TW 数 AVA 零 VIA 族 0 电子层
1 H 氢 1s 1.008 K
2
VH4 2 3 Li 锂 2s 6.941 4 Be 铍 2s2 9.012 Ag 硼 2s 2p 10.81 C 碳 2s 2p2 12.01 N 2 4.01 0 氧 2s-2p 16.00 -F 氟 2s 2p 19.00 L K
8
2
3 11 Na 钠 3s 22.99 ]12 Mg 镁 3s2 24.31 13 Al 铝 3s 3p 26.98 4 Si 硅 3s3sp 28.09 P 磷 3s 30.97 S 硫 3s sp 32.07 7.CI 氯 3s 35.45 M L K
8
8
2
HI W VB VI VII B VIII IB HB 4 19 K 钾 4s 39.40 20 Ca 钙 4s 40.08 B se 钪 sd-4s 44.96 B Ti 钛 3d24s 47.87 23 v 钒 3d 4s2 50.94 B Cr 铬 3d54s1 52.00 25 Mn 锰 3d 4s2 54.94 26 Fe 铁 3d 4s2 55.85 27 Co 钴 3d 4s2 58.93 23 Ni[ 镍 3d 4s2 58.69 29 Cu 铜 3d104:1 63.55 30 Zr 锌 3d44s 65.39 31 Ga 镓 4s 4p 09.72 32 Ge 锗 4s 4p 72.61 33 As 砷 4s-4p 74.92 54.Se 硒 4s-4p 78.98 Br 溴 4s 4p 79.90 NN1K
8
18
5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42Mo l43 Te l44 Ru 45 Rh 46 Pd l47 Agl 48 Cdl 49 Iu s Sn si Sh 52 Te 0N M K
8
18
18
8
2
主 族 元 素由 长 周 期 和 短 周 期 元 素 共 同 构 成 6 d ● N 2 工 天
8
18
32
18
8
铯 钡 La-Lu 铪 钽 钨 铼 锇 铱 铂 金 汞 | 铊 铅 铋 。 钋 副族元 素由长周 7 期元素构成 223 7s2 26.0 锏系 (6d 7s-9 2641 (6d 7s-(6d*7s-| (6d 7s-1(6d7s4(6d'7s4 2821 lpeal aa2l s5] [26al 注 : 4 0 4 西 乙 县
族 用罗马数字表示序数
28
——2 种
——8种
——8种
周期序数=电子层数
-18
——18种
——32种
——32种
主族序数=原子最外层电子数
稀有气体元素
主族 7个主族,包括短周期和长周期元素
副族 7个副族,只包括在长周期中
第一周期
第二周期 第三周期
第四周期 第五周期 第六周期 第七周期
周期
(7个)
族 (16个)
短周期
长周期
第VIII 族
0族
周 期 表
第五周期第VIIA族
Y:I
第三周期第IA族
X:Na
1. 已知某主族元素的原子结构示意图如下,判
断它们在周期表中位置,元素符号
【练习1】
X
Y
【练习2】
2. 已知某主族元素在元素周期表的第三周期第VIIA族,写出它 的原子结构示意图
【试一试】
3. 同周期ⅡA族与IIA族元素原子序数的差值有哪些可能 为什么
二、三周期差1;四、五周期差11;因为从第四周期开始每个期 周多了7个副族和一个第VⅢ族,即10个纵列。第六、七周期差25。 因为第六、七周期的第ⅢB族分别容纳一个镧系和锕系各为15种
元素。
【试一试】
4.试推算出88号元素在周期表的位置。
88-2-8-8-18-18-32……2,
第七周期第IⅡA族
课堂小结
一、元素周期表的发展历程
二、元素周期表的结构
1.原子序数=核电荷数=质子数=核外电子数。
2.周期序数=电子层数,主族序数=最外层电子数 3.元素周期表的结构:
周期表有7周期(3短4长)、16族(7A、7B、1VⅢ、1 零)
感谢聆听
新人教版高中化学必修1(2019)
第四章物质结构元素周期律
第一节 原子结构元素周期表
第2课时元素周期表
1. 了解元素周期表的发展历程。
2.掌握元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
重点:元素周期表的编排规则及结构。
难点:根据原子结构确定元素原子在元素周期 表中的位置。
学习目标 重点难点
九九乘法口诀表 牛顿定律
(选择一项定律来开始)
第二定律 第三定律
计
3x5=1
三六十八
3x6=18
七二十
3x7=21
三八二十四
3x8=24
三九二十t
3x9=27
x4=
-五得五
1x5=5
一六得六 1×6=6
-七得七
1x7=7
-八得八
1x8=8
一九得九
1x9=9
4×5=20
六二+
4×6=2
四七二十八
4x7=28
四八三十二
4×8=32
四九三十六
4x9=3
五一
2×5=10
十二
2×6=12
二七十四
2×7=14
二八十大
2×8=16
二九十八
2x9=18
三十
7=39
八四十 8=4(
沈 a 十
9=
第一定律
九
光 热 氧 氮 氢 硫 磷 碳 铋 钼
镁氧
盐酸基 钴 镍
硅石
氟基 铜 金
石灰
硼酸基 锡 铂
钡土
锑 铁 铅
矾土
银 锰 钨
砷 汞 锌
1789年,法国化学家拉瓦锡在专著《化学概要》里,运用分类
比较法列出了第一张化学元素表,开创了元素分类研究的先河。
一、元素周期表的发展历程 法国 拉瓦锡
拉瓦锡的化学元素表
1829年,德国化学家德贝莱纳根据元素性质的相似性提出了“三素
组”学说。指出同组类三个元素不仅性质相似,而且中间元素原子量 也等于前后两元素原子量的平均值。
Li Na K Ca Sr Ba
原 子 量 7 23 39 40 88 137
(7+39)/2=23 (40+137)/2=88.5
Cl Br 1 S Se Te
原子量35.5 80 127 32 79 128
(35.5+127)2=81 (32+128)2=80
德国德贝莱纳“三素组”学说
素按原子量由小到大绘制成一
张螺旋图发现性质相近的元 素出现在同一竖线上第一个 提出了元素性质的周期性变化。
法国尚古多 螺旋图
1 8 6 2 年 ; 法 国 地 质 学 家 将 6 2 元
1864年,德国化学家迈耶尔按原子量由小到大排出了六元素表,该
表对元素进行了分族,有了周期的雏形,向元素周期律迈出了第一步。
4价 C 12.0 16.5 Si 28.5 44.5591) 44. Sn 117.6
3价 2 价
N 14.4
16.95
P 31.0
44.0
As 75.0
45.6
Sb 120.6
1价
Li 7.03
16.02
Na 23.5
16.08
K 39.13
46.3
Rb 85.4
47.6
Cs 133.0
35.5
(TI 204.07) 1 价
Cu 63.5
德国迈尔六元素表
1价
F 19.0 16.46
CI 35.46
44.51
Br 79.97
46.8
I 126.8
2 价
Zn 65.0
迈 耶 尔 的 《 六 元 素 事
2价
(Be 9.3)
(14.7) Mg 24.0 16.0
Ca 40.0
47.0 Sr 87.0
49.0
Ba 137.1
差值
差值
差值
差值
差值
16.00 16.07 32.0
46.7
78.8
49.5
128.3
Bi 208.0 4价
Ni 58.7
4价 Co 58.7
437(874)
207.0 4价
Pb
Te
Se
s
0
1865年,英国人纽兰兹发现按元素原子量由小到大的顺序排列中,
每8种元素之后,会重复出现相似的性质。他把他的发现称为“八音 律”。揭示了元素性质与原子量之间密切关系。
H F Cl Co/Ni Br Pd I
Pt/Ir
Li Na K Cu Rb Ag Cs
TI
G Mg Ca Zn Sr Cd Ba/V
Pb
Bo Al Cr Y Ce/La U Ta
Th
C Si Ti In Zn Sn W
Hg
N P Mn AS DiMo Sb Nb
Bi
0 S Fe Se Ro/Ru Te Au
Os
纽兰兹“八音律”
Newlands'Arranged Elements in Octaves:
20up eid TU W W
H=1
2 Li=7 Be=9.4 B=11 C=12 N=14 O=16 F=19
3 Na=23 Mg=24 Al=27.3 Si=28 P=31 S=32 C1=35.5
4 K=39 Ca=40 2=44 Ti=48 V=51 Cr=52 Mn=55
Fe-56,Co-59
NH-59
5 Cu=63 Zn=65 =68 =72 As=75 Se=78 Br=80
6 Rb=85 Sr=87 Yt=88 Zr=90 Nb=94 Mo=96 =100
Ru-104,Rh-104
Pd-106
7 Ag=108 Cd=112 In=113 Sn=118 Sb=122 Te=125 J=127
8 Cs=133 Ba=137 Di=138 Ce=140
9
10 Er=178 La=180 Ta=182 W=184
Os-195hr-197
Pi198
1工 Au=199 Hg=200 Tl=204 Pb=207 Bi=208
1 Th=231 U=240
1871年门捷列夫的第二张周期表
元素周期表的后期演化
在门捷列夫周期表的指引下,科学家们经过不断探索和研究,新 的元素不断被发现,周期表中的空位先后被填满,20世纪后随着原子 结构的奥秘被揭示,证实了元素的核电荷数决定元素的化学性质,元 素周期表中的排序依据由相对原子质量变为核电荷数。周期表就逐渐 完善和演变成我们现在的元素周期表。
周期 IA 元 素 周 期 表 0 电子层
0
电子数
1 1 H Is 1.008 2 He 氮 4.003 K
2
目 A 2 原子序数 元素名称 注*的是 人造元素 92 U 铀 516d'7 238.0 元素符号, 色 指放射性元素 非 会 国 元 素 金属元率 田A 13 IVA 14 VA 15 VIA 16 YA 17 份层电子排布。括号 指可能的电子排有 相 对 罩 子 质 量 ( 加 括 号 的 数 过渡元素 稀有气体元素 据为该放射性元素半章期最 长同使素的或量数) 2 3Li 锂 6.941 4 Be 坡 s 9.012 5 B 磷 s o 10.81 6C 碳 Yp 12.0t 7 N 14.0t 80 氧 7p 16.00 9 F 氯 22p 19.00 Ne 20.18 1 K
3 11 Na 钠 22.99 12 Mg 镁 24.31 13AI 铝 26.98 14 Si 硅 p 28.09 15 P 30.97 16S 碱 sg 32.06 17 CI 35.45 18Ar 39.95 【
8 8
ⅢB 3 rVB 4 VB 5 MIB 6 VIIB 7 8 9 10 1B 11 DB 12 4 19 K 钾 4e 39.10 20 Ca 15 4 40.08 21 Se 筑 44.96 12 T 钛 304 47.87 23 W 钒 '4 50.94 24 Cr 铬 4 52.00 25.Mn 54.94 16 Fe 铁 d 55.85 27 Co 钻 3d4 58.93 28 Ni 58.69 Cu 29 铜 63.55 30 Zn 锌 d 65.38 1Ga 镓 p 69.72 32 Ge 锗 4p 72.63 33 As 砷 w4p 74.92 34 Se 硒 '4p 78.96 35 Br 79.90 Kr p 83.8 【 K
。 通事的
5 37 Rb 物 85.47 38 Sr 锶 87.62 39 Y 钇 4d 88.91 40 Zr 结 4d 91.22 41 Nb 铌 5 92.91 42 Mo 钼 ds 95.96 43 Te 98] 44 Ru 钌 101.1 45 Rh 铑 4dss 102.9 46 Pd 语 106.4 47 Ag 银 d 107.9 48 Cd 镉 4d7 112.4 49 In 铟 5s55p 114.8 50 Sn 锡 3 118.7 51 Sb 锑 34'5p 121.8 52 Te 127.6 53 126.9 54 Xe 131.3 黑 【 参 子
8事
6 55 Cs 铯 s 132.9 56 Ba 钡 37.3 57-71 La~Lu 镧系 72 H 给 sd8 178.5 73 Ta 钽 506 180.9 74 W 钨 183.8 75 Re 铼 56 186.2 76 Os 钱 sft 190.2 77 Ir 铱 Sf6g 1922 78 Pt 铂 195. 6e 79 Au 金 d t 197.0 80 Hg 汞 200.6 81 T 铊 hcnp 204.4 82 Pb 铅 207.2 83 Bi 钝 s'op 209.0 84 Po 钋 06or [209] 85 At 砹 6it [210] 80 氧 [222] g
。言谓器。的
7 87 Fr 钫 [223] 88 Ra 错 [226] 89-103 Ac-1r 啊系 104 Rf 护 16d7 [265] 10s Db 继* 16d7 [268] 106 S 镇* (271) 107 Bh 该* [270] 10s Hs 锂* [277] 109 Mt 钱* [2761 110 )s 话* (2811 111 Rg 纶 [280] 112 Cn * [285] 113 Nh 你* [284] 114 铁* [289] 115 Me 馍* [2881 116 Lw 位* [2931 117 Ts 础* [294] IEi0 [294] fl nnpd
之 要 a 心
1 Lu 馅 41sd6e 175.0 系 571a 6 138.9 58 Ce 41sd 140.1 59 Pr 错 41 1409 60 Nd 钕 4(% 144.2 Pn 钷* [145] Sm 钐 40h 150.4 63 Eu 铕 4(6 152.0 64 Gd 钆 Csd 157.3 65 Tb 域 4m 1589 66 Dy 镝 426 162.5 67 Ho 钬 416 164.9 68 Er 饵 416 167.3 69 Tm 铥 4r't 168.9 70 Yb 地 4rte 173.1 钢系 89 Ac 钢 6d' [2271 Th 社 232.0 91 P 锁 SF6d 7y 2310 92 U 镇 31nd 238.0 93 Np 5(md [237] 94 Pu 钚 5r7 [244] 95 Am 5 [2431 96Cm 锡* sT6' [247] 97 jsk 铬 17 [2471 98Cf 钢* s0N [251] 99 Fs 镇 5707w [2521 ton Fm 项* 5F7 [257] 101 Md 们* (S4° [258] 102 No 锗 SrM [259] 1031 捞* (5Pkd83 [2621
墨
领
溴
你有什么启示
与感悟呢
科学精神 科学态度 科学方法
氢 ( H )
氪 ( H e )
(Li) 铍 ( B e ) 硬 ( B ) 碳 ( C ) 氮 ( N ) 氧 ( O ) 氟(F)
(Ne)
钠 O N a ) 镁 ( M g ) 8(A1) 4 (P) 硫 ( S ) 叙(c1)
氙 ( A r )
硅(Si) 钾(K) 钙 ( C a )
请同学们练习写出1-20号元素原子的结构示意图
1 — — 2 0 号 元 素 的 名 称 、 符 号 、 原 子 结 构 示 意 图
周期 IA 元 素 周 期 表 0 电子层
0
电子数
1 1 H Is 1.008 2 He 氮 4.003 K
2
目 A 2 原子序数 元素名称 注*的是 人造元素 92 U 铀 516d'7 238.0 元素符号, 色 指放射性元素 非 会 国 元 素 金属元率 田A 13 IVA 14 VA 15 VIA 16 YA 17 份层电子排布。括号 指可能的电子排有 相 对 罩 子 质 量 ( 加 括 号 的 数 过渡元素 稀有气体元素 据为该放射性元素半章期最 长同使素的或量数) 2 3Li 锂 6.941 4 Be 坡 s 9.012 5 B 磷 s o 10.81 6C 碳 Yp 12.0t 7 N 14.0t 80 氧 7p 16.00 9 F 氯 22p 19.00 Ne 20.18 1 K
3 11 Na 钠 22.99 12 Mg 镁 24.31 13AI 铝 26.98 14 Si 硅 p 28.09 15 P 30.97 16S 碱 sg 32.06 17 CI 35.45 18Ar 39.95 【
8 8
ⅢB 3 rVB 4 VB 5 MIB 6 VIIB 7 8 9 10 1B 11 DB 12 4 19 K 钾 4e 39.10 20 Ca 15 4 40.08 21 Se 筑 44.96 12 T 钛 304 47.87 23 W 钒 '4 50.94 24 Cr 铬 4 52.00 25.Mn 54.94 16 Fe 铁 d 55.85 27 Co 钻 3d4 58.93 28 Ni 58.69 Cu 29 铜 63.55 30 Zn 锌 d 65.38 1Ga 镓 p 69.72 32 Ge 锗 4p 72.63 33 As 砷 w4p 74.92 34 Se 硒 '4p 78.96 35 Br 79.90 Kr p 83.8 【 K
。 通事的
5 37 Rb 物 85.47 38 Sr 锶 87.62 39 Y 钇 4d 88.91 40 Zr 结 4d 91.22 41 Nb 铌 5 92.91 42 Mo 钼 ds 95.96 43 Te 98] 44 Ru 钌 101.1 45 Rh 铑 4dss 102.9 46 Pd 语 106.4 47 Ag 银 d 107.9 48 Cd 镉 4d7 112.4 49 In 铟 5s55p 114.8 50 Sn 锡 3 118.7 51 Sb 锑 34'5p 121.8 52 Te 127.6 53 126.9 54 Xe 131.3 黑 【 参 子
8事
6 55 Cs 铯 s 132.9 56 Ba 钡 37.3 57-71 La~Lu 镧系 72 H 给 sd8 178.5 73 Ta 钽 506 180.9 74 W 钨 183.8 75 Re 铼 56 186.2 76 Os 钱 sft 190.2 77 Ir 铱 Sf6g 1922 78 Pt 铂 195. 6e 79 Au 金 d t 197.0 80 Hg 汞 200.6 81 T 铊 hcnp 204.4 82 Pb 铅 207.2 83 Bi 钝 s'op 209.0 84 Po 钋 06or [209] 85 At 砹 6it [210] 80 氧 [222] g
。言谓器。的
7 87 Fr 钫 [223] 88 Ra 错 [226] 89-103 Ac-1r 啊系 104 Rf 护 16d7 [265] 10s Db 继* 16d7 [268] 106 S 镇* (271) 107 Bh 该* [270] 10s Hs 锂* [277] 109 Mt 钱* [2761 110 )s 话* (2811 111 Rg 纶 [280] 112 Cn * [285] 113 Nh 你* [284] 114 铁* [289] 115 Me 馍* [2881 116 Lw 位* [2931 117 Ts 础* [294] IEi0 [294] fl nnpd
之 要 a 心
1 Lu 馅 41sd6e 175.0 系 571a 6 138.9 58 Ce 41sd 140.1 59 Pr 错 41 1409 60 Nd 钕 4(% 144.2 Pn 钷* [145] Sm 钐 40h 150.4 63 Eu 铕 4(6 152.0 64 Gd 钆 Csd 157.3 65 Tb 域 4m 1589 66 Dy 镝 426 162.5 67 Ho 钬 416 164.9 68 Er 饵 416 167.3 69 Tm 铥 4r't 168.9 70 Yb 地 4rte 173.1 钢系 89 Ac 钢 6d' [2271 Th 社 232.0 91 P 锁 SF6d 7y 2310 92 U 镇 31nd 238.0 93 Np 5(md [237] 94 Pu 钚 5r7 [244] 95 Am 5 [2431 96Cm 锡* sT6' [247] 97 jsk 铬 17 [2471 98Cf 钢* s0N [251] 99 Fs 镇 5707w [2521 ton Fm 项* 5F7 [257] 101 Md 们* (S4° [258] 102 No 锗 SrM [259] 1031 捞* (5Pkd83 [2621
墨
领
溴
(1)按原子序数的递增顺序从左到右排列
(2)将电子层数相同的元素排列成一个横行
(3)将最外层电子数相同的元素排成一个纵行。
2.根据前20号元素的原子结构示意图及位置。尝试总结出元素周期
表的编排规则
原子序数 = 核电荷数(质子数)=(原子)核外电子数
1.什么叫原子序数 原子序数与元素原子结构间有什么内在联系
周期序数 起止元素 元素种数
电子层数
1 H~ He 2
1
2 Li~Ne 8
2
第一周 期:8种 种=2×3 =2×42。 期的元 九周期 7 期:2种=2 =2×22; 2;第六、 以此规 素种类应 的元素被 Fr~Og ×12;第二、三周 第四、五周期:18 七周期:32种 律递推,第八、九周 该50种=2×52;第八 全部发现会有50种。 32
7
问题:
1.周期元素的编排原则是什么
2.同周期元素原子结构有什么共同 点和不同点
3.周期是如何分类,分类依据是什 么
4.根据周期的元素种类数,你能预 测出第八、九周期会有多少种元素
对下表中的项目进行讨论交流,并将讨论结果填写在表中。 思考回答相关问题。
【思考交流】
第一周期
第二周期
第三周期 第四周期: 第五周期:
第六周期:
第七周期:
二 、元素周期表的周期结构:
三短四长
2种元素
8种元素 8种元素
18种元素 18种元素 32种元素 32种元素
短周期
长周期
周期
periods
(横向)
三 、元素周期表的族结构:
请同学们认真阅读教材89-90页的教学内容,思考回答下列问题。
1.元素周期表有18列,分为16个族,是哪些族
是1个零族,1个第VⅢ族(3个纵列)7个主族,7个副族。
2.族的分类依据是什么 如何表示
由长周期和短周期共同组成的族为主族,主族用A表示,
完全由长周期元素组成的族为副族,副族用B表示
族序数用罗马数字I 、IⅡ 、Ⅲ 、IV 、V 、VI 、VⅡ 、I表示 比如:IVA族表示第四主族;VIB族表示第六副族
第VIⅢ族为8、9、10三个纵列。
稀有气体元素叫0族。
同一主族元素原子的最外层电子数相同,电子层数 由上到下依次增多。
4.同一主族元素原子的结构有什么共同点和不同点
3.主族序数与元素的原子结构之间有什么的关系
主族序数=原子最外层电子数
0 IA 主 LIA 族 主族序数=最外层 副 族7 个第 八 族 电子 TW 数 AVA 零 VIA 族 0 电子层
1 H 氢 1s 1.008 K
2
VH4 2 3 Li 锂 2s 6.941 4 Be 铍 2s2 9.012 Ag 硼 2s 2p 10.81 C 碳 2s 2p2 12.01 N 2 4.01 0 氧 2s-2p 16.00 -F 氟 2s 2p 19.00 L K
8
2
3 11 Na 钠 3s 22.99 ]12 Mg 镁 3s2 24.31 13 Al 铝 3s 3p 26.98 4 Si 硅 3s3sp 28.09 P 磷 3s 30.97 S 硫 3s sp 32.07 7.CI 氯 3s 35.45 M L K
8
8
2
HI W VB VI VII B VIII IB HB 4 19 K 钾 4s 39.40 20 Ca 钙 4s 40.08 B se 钪 sd-4s 44.96 B Ti 钛 3d24s 47.87 23 v 钒 3d 4s2 50.94 B Cr 铬 3d54s1 52.00 25 Mn 锰 3d 4s2 54.94 26 Fe 铁 3d 4s2 55.85 27 Co 钴 3d 4s2 58.93 23 Ni[ 镍 3d 4s2 58.69 29 Cu 铜 3d104:1 63.55 30 Zr 锌 3d44s 65.39 31 Ga 镓 4s 4p 09.72 32 Ge 锗 4s 4p 72.61 33 As 砷 4s-4p 74.92 54.Se 硒 4s-4p 78.98 Br 溴 4s 4p 79.90 NN1K
8
18
5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42Mo l43 Te l44 Ru 45 Rh 46 Pd l47 Agl 48 Cdl 49 Iu s Sn si Sh 52 Te 0N M K
8
18
18
8
2
主 族 元 素由 长 周 期 和 短 周 期 元 素 共 同 构 成 6 d ● N 2 工 天
8
18
32
18
8
铯 钡 La-Lu 铪 钽 钨 铼 锇 铱 铂 金 汞 | 铊 铅 铋 。 钋 副族元 素由长周 7 期元素构成 223 7s2 26.0 锏系 (6d 7s-9 2641 (6d 7s-(6d*7s-| (6d 7s-1(6d7s4(6d'7s4 2821 lpeal aa2l s5] [26al 注 : 4 0 4 西 乙 县
族 用罗马数字表示序数
28
——2 种
——8种
——8种
周期序数=电子层数
-18
——18种
——32种
——32种
主族序数=原子最外层电子数
稀有气体元素
主族 7个主族,包括短周期和长周期元素
副族 7个副族,只包括在长周期中
第一周期
第二周期 第三周期
第四周期 第五周期 第六周期 第七周期
周期
(7个)
族 (16个)
短周期
长周期
第VIII 族
0族
周 期 表
第五周期第VIIA族
Y:I
第三周期第IA族
X:Na
1. 已知某主族元素的原子结构示意图如下,判
断它们在周期表中位置,元素符号
【练习1】
X
Y
【练习2】
2. 已知某主族元素在元素周期表的第三周期第VIIA族,写出它 的原子结构示意图
【试一试】
3. 同周期ⅡA族与IIA族元素原子序数的差值有哪些可能 为什么
二、三周期差1;四、五周期差11;因为从第四周期开始每个期 周多了7个副族和一个第VⅢ族,即10个纵列。第六、七周期差25。 因为第六、七周期的第ⅢB族分别容纳一个镧系和锕系各为15种
元素。
【试一试】
4.试推算出88号元素在周期表的位置。
88-2-8-8-18-18-32……2,
第七周期第IⅡA族
课堂小结
一、元素周期表的发展历程
二、元素周期表的结构
1.原子序数=核电荷数=质子数=核外电子数。
2.周期序数=电子层数,主族序数=最外层电子数 3.元素周期表的结构:
周期表有7周期(3短4长)、16族(7A、7B、1VⅢ、1 零)
感谢聆听
