铁的重要化合物高一上学期化学人教版(2019)必修第一册(共25张PPT)
文档属性
| 名称 | 铁的重要化合物高一上学期化学人教版(2019)必修第一册(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:15:38 | ||
图片预览








文档简介
(共25张PPT)
人教版(2019)必修1
第三章铁金属材料
第一节:铁及其化合物
第2课时铁的重要化合物
(1)掌握铁的氧化物、氢氧化物的主要性质
(2)通过实验探究了解Fe + 、Fe +的检验方法
(3)从氧化还原的角度,掌握铁的化合物的相互转化关系
(4)初步学会从物质类别和元素价态去预测物质的性质及设计物 质间的转化途径
【学习目标】
解 读 :古代王公贵族的住宅大门大多用铁的氧化物漆成红色,表示 尊贵,称为“朱门”,后来借指豪富人家
【情境 ·思考】
铁的氧化物 氧化亚铁 氧化铁
四氧化三铁
化学式 FeO Fe O
Fe O
颜色、状态 黑色粉末 红棕色粉末
黑色晶体
俗名 铁红
磁性氧化铁
溶解性 均不溶于水
一、铁的氧化物P67 页
1、物理性质
四氧化三铁(磁铁矿)
氧化铁(赤铁矿)
氧化亚铁
一 、铁的氧化物
2、化学性质
思考1:从物质类别的角度分析,FeO 和Fe O 可能具有什么样的化学性质
思考2:Fe O 也能与酸反应,方程式为:Fe O +8H+==2Fe ++Fe +
+4H O, 如何理解该反应,Fe O 是否是碱性氧化物,为什么
Fe O 可写作FeO·Fe O , 与酸生成了两种盐,非碱性氧化
FeO+2H+=Fe ++H O
Fe O +6H+=2Fe ++3H O
碱性氧化物
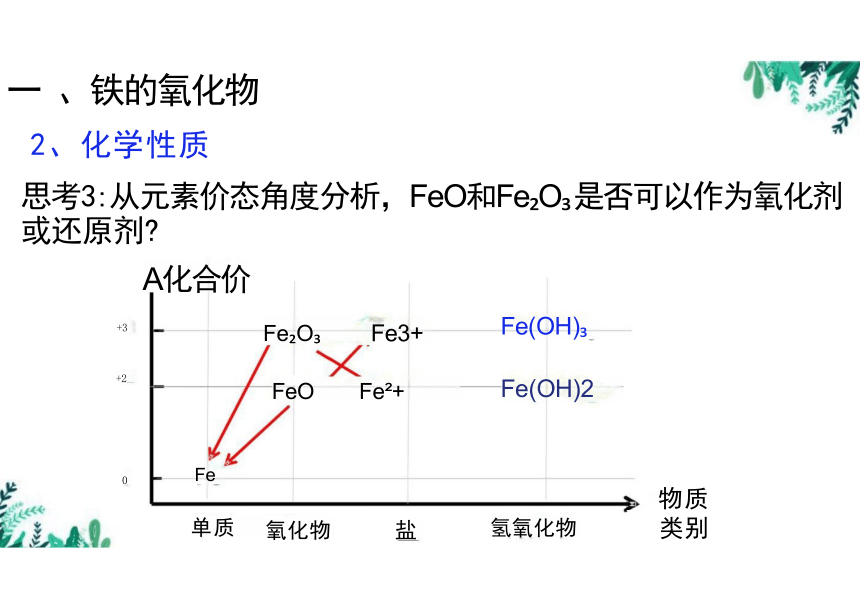
A化合价
Fe(OH)
Fe(OH)2
Fe
物质
氢氧化物
一 、铁的氧化物
2、化学性质
思考3:从元素价态角度分析,FeO和Fe O 是否可以作为氧化剂 或还原剂
Fe O
FeO
氧化物 盐
类别
单质
Fe3+
Fe +
+3
+2
0
化学名称 FeO Fe O
Fe O
稳定性 不稳定 稳定
稳定
氧化物类别 均为碱性氧化物
复杂氧化物
与盐酸反应 (用离子方程式表示) FeO+2H+=Fe ++H O Fe O +6H+=2Fe ++3H O Fe O +8H+=2Fe ++Fe ++4H O 氧化/还原性 FeO有氧化性和还原性,Fe O 只有氧化 性
用途 红色油漆和涂料、 炼铁原料(赤铁矿)
制录音磁带和电讯器材,
【小结】
思考:铁有哪些氢氧化物 如何制备铁的氢氧化物
方案一:能否通过铁和水反应制得
方案二:能否通过铁的氧化物和水反应得到
方案三:用可溶性铁盐、亚铁盐与碱溶液反应
二 、铁的氢氧化物
1、Fe(OH) 和Fe(OH)3的制备
【实验3-1】在两支试管中加入少量的FeCl 和FeSO 溶液,然后各滴 入NaOH 溶液。观察并描述发生的现象。
Fe(OH)
Fe(OH)
现象
产生 红褐色沉淀
产生 白色絮状沉淀,迅速 变为灰绿色,最终变为
红褐色。
离子方程式 Fe + +30H-=Fe(OH) ↓ 4
Fe ++20H-=Fe(OH) ↓
Fe(OH) +O +2H O=4Fe(OH)
【思考与讨论】由实验3-1可得,白色的Fe(OH) 会迅速被氧气氧化变 色。那么,在实验室中,如何更长时间的观察到白色的Fe(OH) 呢
联系生活与已有知识:
如何构造无氧的环境
解决问题的核心:
构造无氧的环境
NaOH
稀硫酸 溶液
FeSO
溶液
水
铁粉
情境1:向膨化食品包装袋中充氮气 以赶走空气,防止氧化。
方法一 :在制备Fe(OH) 的试管中充满氮 气或氢气以赶走空气。
【思维提升:Fe(OH) 制备方法改进】
方法二:可以采取加煤油或苯隔绝空气的方法,用 长胶头滴管吸取NaOH 溶液后,把滴管插入FeSO 溶液底部,再挤出NaOH 溶液。
情 境 2 :金属钠保存在石蜡油或煤 油中,以隔绝空气
NaOH 溶液 苯
FeSO
_
溶液
方法三:将配置溶液的蒸馏水加 热煮沸,赶出溶解氧。
情境3:夏天温度高,水溶氧低,鱼容易缺氧而死
课后思考:还有哪些改进的方法能得到Fe(OH)
氢氧化亚铁Fe(OH)
氢氧化铁Fe(OH)
制 法 Fe ++2OH-=Fe(OH) ↓ 白色 →灰绿色→红褐色沉淀
Fe ++3OH-=Fe(OH) ↓
红褐色沉淀
颜 色 白 色
红褐色
溶解性 难溶于水
难溶于水
与酸 反应 Fe(OH) +2H+=Fe ++2H O
Fe(OHD +3H+=Fe ++3H O
稳定性 4Fe(OHD) +2H O+O =4Fe(OH)
难溶氢氧化物受热易分解成对应的氧化物和水
2、Fe(OH) 与Fe(OH) 的化学性质比较
FeCl 溶液
浅绿色
FeCl 溶液
棕黄色
三 、铁盐和亚铁盐
1、Fe + 和Fe +的鉴别
1、Fe +和Fe +的鉴别
思考1:若离子浓度较低,还能利用颜色的差异鉴别两种离子吗
【实验3-2】在两支试管中分别加入少量的FeCl 溶液和FeCl 溶液,各 滴入几滴KSCN溶液。观察并记录现象。
实验现象:FeCl 溶液变红, 而FeCl 溶液颜色无明显变 化。
实验结论:可以利用KSCN 溶液检验Fe +的存在。
离子鉴别
颜色法
棕黄色/浅绿色
K S C N 法
溶液变红/无明 显变化
碱液法
生成红褐色 沉淀/白色→ 灰绿色→红 褐色
思考2:结合本节课所学铁的化合物的知识,还能用什么方法鉴别
两种离子
思考3:如何实现Fe + 到Fe +的转化
2、Fe +和Fe +的转化
氧化剂
还原剂
Fe +
Fe +
【实验现象】
FeCl 溶液加入铁粉后溶液黄色变浅,再加入KSCN 溶液无明显变化。上 层清液中加入氯水,溶液又变为红色。
【反应原理】
2Fe3++Fe=3Fe2+ 2Fe ++Cl =2Fe ++2Cl-
2、Fe +和Fe +的转化
方案一:某溶液,先滴加氯水,再滴加KSCN 溶液,溶液变
成红色,说明原溶液中一定存在Fe +。
方案二:某溶液,滴加KSCN 溶液,无明显现象,再滴加氯
水,溶液变成红色,说明原溶液中一定存在Fe +。
2、Fe +和Fe +的转化
思考4:结合上述反应,溶液中的Fe + 还可以如何检验
FeCl 制作印刷电路板
印刷电路板由高分子材料和铜 箔复合而成,在覆铜板上设计好线 路,并涂上一层石蜡,把板浸到
FeCl 溶液中,没有被石蜡覆盖住 的铜就被反应掉,用此方法来刻制 印刷电路。
试一试:根据上述文字写出Cu与FeCl 溶液反应的离子方程式
Cu +2Fe3+=Cu2++2Fe2+
【情境 ·思考】
氧化剂如Cl
Fe +
还原剂如Fe、Cu
课后思考:还有哪些物质可以实现上述转化过程
2、Fe +和Fe +的转化
Fe +
个化合价
→ Fe(OH)
Fe(OH)
0 Fe
单质 氧化物 盐 氢氧化物
四 、铁的化合物的转化
Fe Oz Fe +
FeO—→ Fe +
物质 类别
+3
+2
感谢聆听!
人教版(2019)必修1
第三章铁金属材料
第一节:铁及其化合物
第2课时铁的重要化合物
(1)掌握铁的氧化物、氢氧化物的主要性质
(2)通过实验探究了解Fe + 、Fe +的检验方法
(3)从氧化还原的角度,掌握铁的化合物的相互转化关系
(4)初步学会从物质类别和元素价态去预测物质的性质及设计物 质间的转化途径
【学习目标】
解 读 :古代王公贵族的住宅大门大多用铁的氧化物漆成红色,表示 尊贵,称为“朱门”,后来借指豪富人家
【情境 ·思考】
铁的氧化物 氧化亚铁 氧化铁
四氧化三铁
化学式 FeO Fe O
Fe O
颜色、状态 黑色粉末 红棕色粉末
黑色晶体
俗名 铁红
磁性氧化铁
溶解性 均不溶于水
一、铁的氧化物P67 页
1、物理性质
四氧化三铁(磁铁矿)
氧化铁(赤铁矿)
氧化亚铁
一 、铁的氧化物
2、化学性质
思考1:从物质类别的角度分析,FeO 和Fe O 可能具有什么样的化学性质
思考2:Fe O 也能与酸反应,方程式为:Fe O +8H+==2Fe ++Fe +
+4H O, 如何理解该反应,Fe O 是否是碱性氧化物,为什么
Fe O 可写作FeO·Fe O , 与酸生成了两种盐,非碱性氧化
FeO+2H+=Fe ++H O
Fe O +6H+=2Fe ++3H O
碱性氧化物
A化合价
Fe(OH)
Fe(OH)2
Fe
物质
氢氧化物
一 、铁的氧化物
2、化学性质
思考3:从元素价态角度分析,FeO和Fe O 是否可以作为氧化剂 或还原剂
Fe O
FeO
氧化物 盐
类别
单质
Fe3+
Fe +
+3
+2
0
化学名称 FeO Fe O
Fe O
稳定性 不稳定 稳定
稳定
氧化物类别 均为碱性氧化物
复杂氧化物
与盐酸反应 (用离子方程式表示) FeO+2H+=Fe ++H O Fe O +6H+=2Fe ++3H O Fe O +8H+=2Fe ++Fe ++4H O 氧化/还原性 FeO有氧化性和还原性,Fe O 只有氧化 性
用途 红色油漆和涂料、 炼铁原料(赤铁矿)
制录音磁带和电讯器材,
【小结】
思考:铁有哪些氢氧化物 如何制备铁的氢氧化物
方案一:能否通过铁和水反应制得
方案二:能否通过铁的氧化物和水反应得到
方案三:用可溶性铁盐、亚铁盐与碱溶液反应
二 、铁的氢氧化物
1、Fe(OH) 和Fe(OH)3的制备
【实验3-1】在两支试管中加入少量的FeCl 和FeSO 溶液,然后各滴 入NaOH 溶液。观察并描述发生的现象。
Fe(OH)
Fe(OH)
现象
产生 红褐色沉淀
产生 白色絮状沉淀,迅速 变为灰绿色,最终变为
红褐色。
离子方程式 Fe + +30H-=Fe(OH) ↓ 4
Fe ++20H-=Fe(OH) ↓
Fe(OH) +O +2H O=4Fe(OH)
【思考与讨论】由实验3-1可得,白色的Fe(OH) 会迅速被氧气氧化变 色。那么,在实验室中,如何更长时间的观察到白色的Fe(OH) 呢
联系生活与已有知识:
如何构造无氧的环境
解决问题的核心:
构造无氧的环境
NaOH
稀硫酸 溶液
FeSO
溶液
水
铁粉
情境1:向膨化食品包装袋中充氮气 以赶走空气,防止氧化。
方法一 :在制备Fe(OH) 的试管中充满氮 气或氢气以赶走空气。
【思维提升:Fe(OH) 制备方法改进】
方法二:可以采取加煤油或苯隔绝空气的方法,用 长胶头滴管吸取NaOH 溶液后,把滴管插入FeSO 溶液底部,再挤出NaOH 溶液。
情 境 2 :金属钠保存在石蜡油或煤 油中,以隔绝空气
NaOH 溶液 苯
FeSO
_
溶液
方法三:将配置溶液的蒸馏水加 热煮沸,赶出溶解氧。
情境3:夏天温度高,水溶氧低,鱼容易缺氧而死
课后思考:还有哪些改进的方法能得到Fe(OH)
氢氧化亚铁Fe(OH)
氢氧化铁Fe(OH)
制 法 Fe ++2OH-=Fe(OH) ↓ 白色 →灰绿色→红褐色沉淀
Fe ++3OH-=Fe(OH) ↓
红褐色沉淀
颜 色 白 色
红褐色
溶解性 难溶于水
难溶于水
与酸 反应 Fe(OH) +2H+=Fe ++2H O
Fe(OHD +3H+=Fe ++3H O
稳定性 4Fe(OHD) +2H O+O =4Fe(OH)
难溶氢氧化物受热易分解成对应的氧化物和水
2、Fe(OH) 与Fe(OH) 的化学性质比较
FeCl 溶液
浅绿色
FeCl 溶液
棕黄色
三 、铁盐和亚铁盐
1、Fe + 和Fe +的鉴别
1、Fe +和Fe +的鉴别
思考1:若离子浓度较低,还能利用颜色的差异鉴别两种离子吗
【实验3-2】在两支试管中分别加入少量的FeCl 溶液和FeCl 溶液,各 滴入几滴KSCN溶液。观察并记录现象。
实验现象:FeCl 溶液变红, 而FeCl 溶液颜色无明显变 化。
实验结论:可以利用KSCN 溶液检验Fe +的存在。
离子鉴别
颜色法
棕黄色/浅绿色
K S C N 法
溶液变红/无明 显变化
碱液法
生成红褐色 沉淀/白色→ 灰绿色→红 褐色
思考2:结合本节课所学铁的化合物的知识,还能用什么方法鉴别
两种离子
思考3:如何实现Fe + 到Fe +的转化
2、Fe +和Fe +的转化
氧化剂
还原剂
Fe +
Fe +
【实验现象】
FeCl 溶液加入铁粉后溶液黄色变浅,再加入KSCN 溶液无明显变化。上 层清液中加入氯水,溶液又变为红色。
【反应原理】
2Fe3++Fe=3Fe2+ 2Fe ++Cl =2Fe ++2Cl-
2、Fe +和Fe +的转化
方案一:某溶液,先滴加氯水,再滴加KSCN 溶液,溶液变
成红色,说明原溶液中一定存在Fe +。
方案二:某溶液,滴加KSCN 溶液,无明显现象,再滴加氯
水,溶液变成红色,说明原溶液中一定存在Fe +。
2、Fe +和Fe +的转化
思考4:结合上述反应,溶液中的Fe + 还可以如何检验
FeCl 制作印刷电路板
印刷电路板由高分子材料和铜 箔复合而成,在覆铜板上设计好线 路,并涂上一层石蜡,把板浸到
FeCl 溶液中,没有被石蜡覆盖住 的铜就被反应掉,用此方法来刻制 印刷电路。
试一试:根据上述文字写出Cu与FeCl 溶液反应的离子方程式
Cu +2Fe3+=Cu2++2Fe2+
【情境 ·思考】
氧化剂如Cl
Fe +
还原剂如Fe、Cu
课后思考:还有哪些物质可以实现上述转化过程
2、Fe +和Fe +的转化
Fe +
个化合价
→ Fe(OH)
Fe(OH)
0 Fe
单质 氧化物 盐 氢氧化物
四 、铁的化合物的转化
Fe Oz Fe +
FeO—→ Fe +
物质 类别
+3
+2
感谢聆听!
