物质的量高一上学期化学人教版(2019)必修第一册(共22张PPT)
文档属性
| 名称 | 物质的量高一上学期化学人教版(2019)必修第一册(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:16:22 | ||
图片预览





文档简介
(共22张PPT)
人教版高中化学必修第一册
第二章第三节第1课时
物质的量
了解物质的量的单位-摩尔、阿伏加德罗常数、摩尔质量的概念;
能建立物质的量与物质的粒子数、物质的质量之间的计算模型 进行简单的化学计算;
能结合实验或生产、生活中的实际数据,能运用模型进行相关 计算,认识物质的量在化学定量研究中的重要作用。
01
03
02
学习目标
问题二:这杯水里有多少个水分子呢
要求:小组合作,思考方法 站立讨论,用时3分钟
问 题 一 :如何快速的计量一杯米中米粒的个数
提示:烧杯称量前已去皮,假设 每颗米粒大小相同
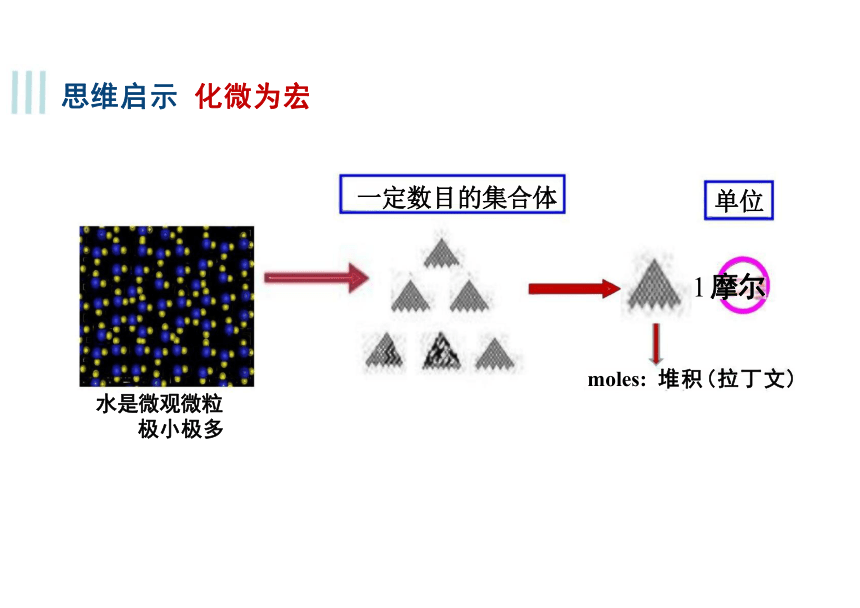
情景问题
一定数目的集合体 单位
1 摩尔
moles: 堆积(拉丁文)
水是微观微粒
思维启示 化微为宏
极小极多
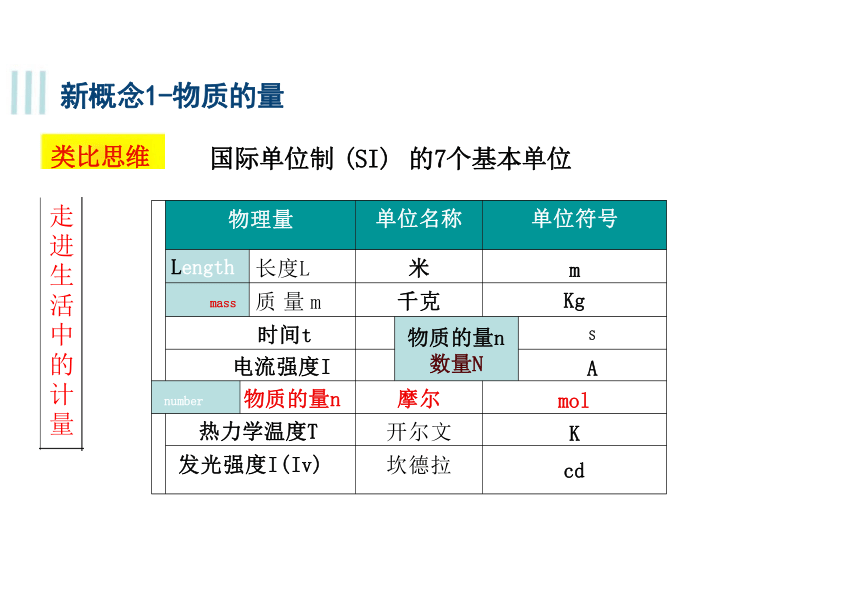
物理量 单位名称 单位符号
Length 长度L 米 m
mass 质 量 m 千克 Kg
时间t 物质的量n 数量N
S
电流强度I
A
number 物质的量n 摩尔 mol
热力学温度T 开尔文 K
发光强度I(Iv) 坎德拉 cd
新概念1-物质的量
类比思维 国际单位制 (SI) 的7个基本单位
走进生活中的计量
1.什么是物质的量
2.物质的量是用来计量什么的
3.物质的量的单位、符号
4.判断下列说法是否正确,从以下判断总结使用物质 的量时的注意事项
(1)1mol西瓜
(2)1mol氢
(3)物质的量是表示含有一定数目粒子的集合体,简称物质量
思考与交流
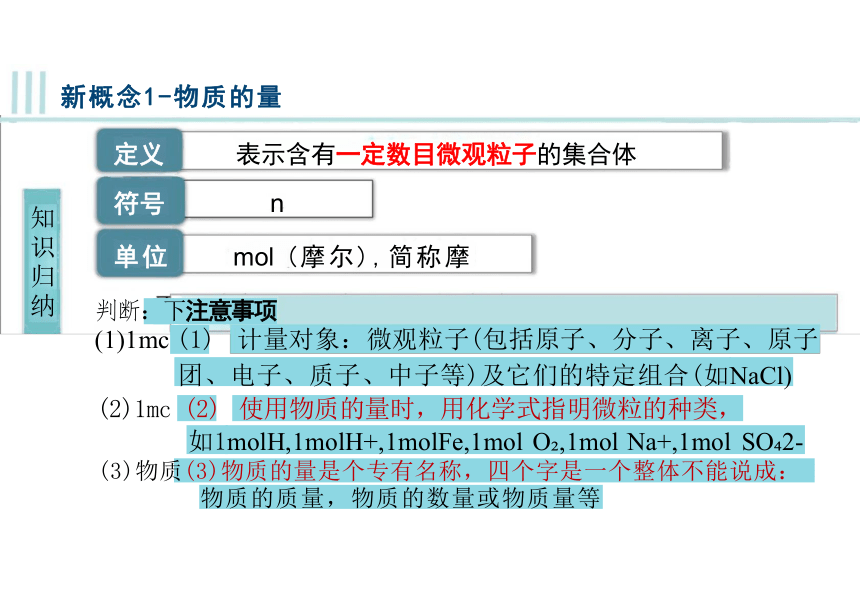
定义 表示含有一定数目微观粒子的集合体
符号 n
单位 mol (摩尔),简称摩
判断:下注意事项
(1)1mc (1) 计量对象:微观粒子(包括原子、分子、离子、原子
团、电子、质子、中子等)及它们的特定组合(如NaCl) (2)1mc (2) 使用物质的量时,用化学式指明微粒的种类,
如1molH,1molH+,1molFe,1mol O ,1mol Na+,1mol SO 2- (3)物质(3)物质的量是个专有名称,四个字是一个整体不能说成:
物质的质量,物质的数量或物质量等
新概念1-物质的量
知识归纳
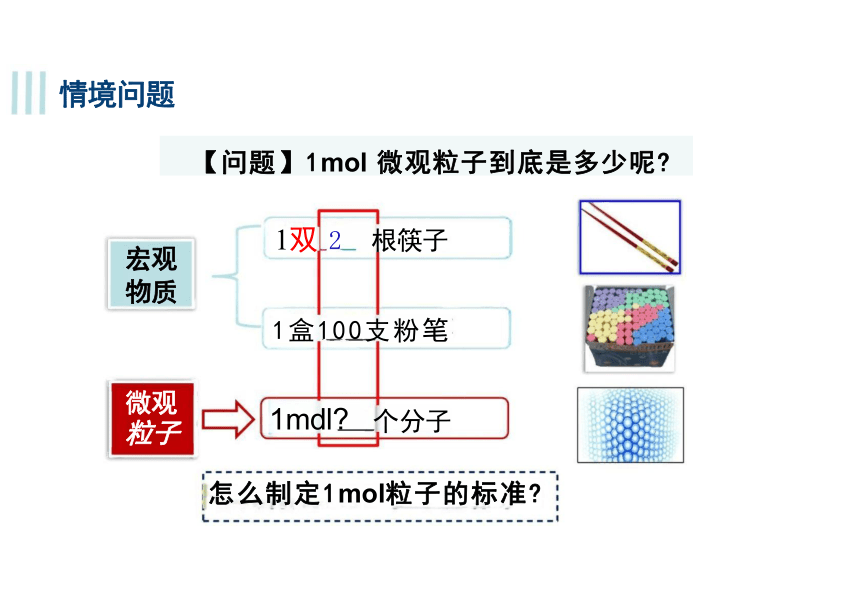
宏观 物质 1双 2 根筷子
1盒100支粉笔
微观 粒子
1mdl 个分子
怎么制定1mol粒子的标准
情境问题
【问题】1mol 微观粒子到底是多少呢
1971年第14届国际计量日大会通过
了以物质的量作为化学计量的基本物理 量,规定其单位为摩尔;2018年第26 届国际计量大会规定1mol 任何粒子的 粒子数为6.02214076x1023个。这个 值叫阿伏伽德罗常数,符号NA, 常用近 似值6.02×1023 mol-1 表示。
情境问题
定义)——1mol 粒子集合体中的粒子数 (单一/混合粒子) 符号) NA
知识归纳 数 值)— 约为6.02×1023 近 似 值
单位 mol-1
阿伏加德罗
正误判断,并说明理由。 (1)6.02×1023就是阿伏加德罗常数 × (2)1molH 0 含有6.02×1023个分子 ×
新 概 念 2 - 阿 伏 伽 德 罗 常 数 N A
注意事项
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯 数,不能误认为N 就是6.02×1023。
(2)在计算时采用近似值6.02×1023mol-
1mol = 1N ≈6.02×102 3
新概念2-阿伏伽德罗常数NA
(准确值) (近似值)
如果把6.02×1023个直径为2.5cm的 硬币排成一行,可以来回于地球与 太阳之间10亿次!
如果你一出生就有6.02×1023个一元 硬币,那你每分钟花掉一亿,直到 100岁那天,你还剩有99.9999%的钱 没有花完。
感悟:所以物质的量 的计量对象只能是微观 粒子及它们的特定组合
感受阿伏伽德罗常数的数值
归纳推理1
【思考】水的物质的量与水分子个数之间如何转换
物质的量( n)、阿伏加德罗常数( NA )、微粒数目( N )的关系 式 :
阿( 常数
)
罗
-1
德
mol
伏加
水的物质的量n
水分子个数N
微粒数目(个数)
简单理解:mol 变NA
N
NA
公式:N=nNA
n =
3mol
3NA
nmol
nNA
2mol
2NA
1mol
1NA
物质的量
(mol)
342 g蔗糖
物质的量为1mol的几种物质
32 g S 27 g A1 65 g Zn 58.5 g NaCI 56 gFe
粒子 符号 每个粒子的质量 (g/个) 1mol物质含有的 1mol物质 粒子数(个) 质量(g) 粒子的 相对分子质量
C 1.993×10-23 6.02×1023 12 12
H O 2.990×10-23 6.02×1023 18 18
OH- 2.824×10-23 6.02×1023 17 17
1mol 不同的微粒有多重
宏观辨识
微观探析
质量是18( g
约含有6.02×1023个水分子
1 mol H O
H O的相对分子质量为18
结 论 :1 mol 任何粒子的质量以克为单位时,其数值都与该粒子的相 对原子质量或者机对分子质量相等
单位物质的量的物质所具有的质量 摩尔质量
1mol 不同的微粒有多重
【微点拨】①质量的单位是g, 摩尔质量的单位是g/mol, 相对原子(分 子)质量的单位是1,摩尔质量在数值上与相对分子质量相等②对具体的 物质而言,其摩尔质量是确定的,不随物质的量的变化而变化,也不随 物质状态的变化而变化
单位物质的量的物质所具有的质量,叫做摩尔质量
新概念3-摩尔质量
在数值上等于该微粒的相对分子(或原子)质量
定 义
符号
g·mol-1 或g/mol
知 识 归 纳
单位
数值
M
(1) 1 molO 的质量是多少 1 mol×32g/mol
(2) 2 molO 的质量是多少 2 mol×32g/mol
(3) n molO 的质量是多少 nmol ×32g/mo l
由以上可以得出物质的质量(m)
与摩尔质量(M)、物质的量 (n) 有什么关系
m 质 量(g)
M 摩尔质量
归纳推理2
h 二
微观:粒子数N
难见 难称量
N 粒子数目(个)
NA 阿伏加德罗常数
宏观:质量m
可见
可计量
质量(g) M
摩尔质量 M g/mol
物质的量 将 宏观和 微观 联系在一起的桥梁。
首先要找到其核心物理量——物质的量,其次根据题目要求解其他物理量
物质的量 mol
二 h 二
课堂总结
典例分析 问题回归
36.0 gH O的物质的量是2 m o l ,含1.204×1024 个水分子。 (写出计算过程)
一口气喝了36克的水,一下子喝掉了
12千万亿亿个H O分子。
约1.204×1024
一口气呼出1千2百万亿亿个CO 分子。
约1.204×1023
困难,与勇者而言,
只是历练自己的一次机会。
我的收获
智慧源于生活
作业
1.以“摩尔”为第一人称,写一篇关于摩尔的自 述(400字左右)
2.查阅资料了解阿伏伽德罗这位科学家的贡献。
谢谢大家
22
人教版高中化学必修第一册
第二章第三节第1课时
物质的量
了解物质的量的单位-摩尔、阿伏加德罗常数、摩尔质量的概念;
能建立物质的量与物质的粒子数、物质的质量之间的计算模型 进行简单的化学计算;
能结合实验或生产、生活中的实际数据,能运用模型进行相关 计算,认识物质的量在化学定量研究中的重要作用。
01
03
02
学习目标
问题二:这杯水里有多少个水分子呢
要求:小组合作,思考方法 站立讨论,用时3分钟
问 题 一 :如何快速的计量一杯米中米粒的个数
提示:烧杯称量前已去皮,假设 每颗米粒大小相同
情景问题
一定数目的集合体 单位
1 摩尔
moles: 堆积(拉丁文)
水是微观微粒
思维启示 化微为宏
极小极多
物理量 单位名称 单位符号
Length 长度L 米 m
mass 质 量 m 千克 Kg
时间t 物质的量n 数量N
S
电流强度I
A
number 物质的量n 摩尔 mol
热力学温度T 开尔文 K
发光强度I(Iv) 坎德拉 cd
新概念1-物质的量
类比思维 国际单位制 (SI) 的7个基本单位
走进生活中的计量
1.什么是物质的量
2.物质的量是用来计量什么的
3.物质的量的单位、符号
4.判断下列说法是否正确,从以下判断总结使用物质 的量时的注意事项
(1)1mol西瓜
(2)1mol氢
(3)物质的量是表示含有一定数目粒子的集合体,简称物质量
思考与交流
定义 表示含有一定数目微观粒子的集合体
符号 n
单位 mol (摩尔),简称摩
判断:下注意事项
(1)1mc (1) 计量对象:微观粒子(包括原子、分子、离子、原子
团、电子、质子、中子等)及它们的特定组合(如NaCl) (2)1mc (2) 使用物质的量时,用化学式指明微粒的种类,
如1molH,1molH+,1molFe,1mol O ,1mol Na+,1mol SO 2- (3)物质(3)物质的量是个专有名称,四个字是一个整体不能说成:
物质的质量,物质的数量或物质量等
新概念1-物质的量
知识归纳
宏观 物质 1双 2 根筷子
1盒100支粉笔
微观 粒子
1mdl 个分子
怎么制定1mol粒子的标准
情境问题
【问题】1mol 微观粒子到底是多少呢
1971年第14届国际计量日大会通过
了以物质的量作为化学计量的基本物理 量,规定其单位为摩尔;2018年第26 届国际计量大会规定1mol 任何粒子的 粒子数为6.02214076x1023个。这个 值叫阿伏伽德罗常数,符号NA, 常用近 似值6.02×1023 mol-1 表示。
情境问题
定义)——1mol 粒子集合体中的粒子数 (单一/混合粒子) 符号) NA
知识归纳 数 值)— 约为6.02×1023 近 似 值
单位 mol-1
阿伏加德罗
正误判断,并说明理由。 (1)6.02×1023就是阿伏加德罗常数 × (2)1molH 0 含有6.02×1023个分子 ×
新 概 念 2 - 阿 伏 伽 德 罗 常 数 N A
注意事项
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯 数,不能误认为N 就是6.02×1023。
(2)在计算时采用近似值6.02×1023mol-
1mol = 1N ≈6.02×102 3
新概念2-阿伏伽德罗常数NA
(准确值) (近似值)
如果把6.02×1023个直径为2.5cm的 硬币排成一行,可以来回于地球与 太阳之间10亿次!
如果你一出生就有6.02×1023个一元 硬币,那你每分钟花掉一亿,直到 100岁那天,你还剩有99.9999%的钱 没有花完。
感悟:所以物质的量 的计量对象只能是微观 粒子及它们的特定组合
感受阿伏伽德罗常数的数值
归纳推理1
【思考】水的物质的量与水分子个数之间如何转换
物质的量( n)、阿伏加德罗常数( NA )、微粒数目( N )的关系 式 :
阿( 常数
)
罗
-1
德
mol
伏加
水的物质的量n
水分子个数N
微粒数目(个数)
简单理解:mol 变NA
N
NA
公式:N=nNA
n =
3mol
3NA
nmol
nNA
2mol
2NA
1mol
1NA
物质的量
(mol)
342 g蔗糖
物质的量为1mol的几种物质
32 g S 27 g A1 65 g Zn 58.5 g NaCI 56 gFe
粒子 符号 每个粒子的质量 (g/个) 1mol物质含有的 1mol物质 粒子数(个) 质量(g) 粒子的 相对分子质量
C 1.993×10-23 6.02×1023 12 12
H O 2.990×10-23 6.02×1023 18 18
OH- 2.824×10-23 6.02×1023 17 17
1mol 不同的微粒有多重
宏观辨识
微观探析
质量是18( g
约含有6.02×1023个水分子
1 mol H O
H O的相对分子质量为18
结 论 :1 mol 任何粒子的质量以克为单位时,其数值都与该粒子的相 对原子质量或者机对分子质量相等
单位物质的量的物质所具有的质量 摩尔质量
1mol 不同的微粒有多重
【微点拨】①质量的单位是g, 摩尔质量的单位是g/mol, 相对原子(分 子)质量的单位是1,摩尔质量在数值上与相对分子质量相等②对具体的 物质而言,其摩尔质量是确定的,不随物质的量的变化而变化,也不随 物质状态的变化而变化
单位物质的量的物质所具有的质量,叫做摩尔质量
新概念3-摩尔质量
在数值上等于该微粒的相对分子(或原子)质量
定 义
符号
g·mol-1 或g/mol
知 识 归 纳
单位
数值
M
(1) 1 molO 的质量是多少 1 mol×32g/mol
(2) 2 molO 的质量是多少 2 mol×32g/mol
(3) n molO 的质量是多少 nmol ×32g/mo l
由以上可以得出物质的质量(m)
与摩尔质量(M)、物质的量 (n) 有什么关系
m 质 量(g)
M 摩尔质量
归纳推理2
h 二
微观:粒子数N
难见 难称量
N 粒子数目(个)
NA 阿伏加德罗常数
宏观:质量m
可见
可计量
质量(g) M
摩尔质量 M g/mol
物质的量 将 宏观和 微观 联系在一起的桥梁。
首先要找到其核心物理量——物质的量,其次根据题目要求解其他物理量
物质的量 mol
二 h 二
课堂总结
典例分析 问题回归
36.0 gH O的物质的量是2 m o l ,含1.204×1024 个水分子。 (写出计算过程)
一口气喝了36克的水,一下子喝掉了
12千万亿亿个H O分子。
约1.204×1024
一口气呼出1千2百万亿亿个CO 分子。
约1.204×1023
困难,与勇者而言,
只是历练自己的一次机会。
我的收获
智慧源于生活
作业
1.以“摩尔”为第一人称,写一篇关于摩尔的自 述(400字左右)
2.查阅资料了解阿伏伽德罗这位科学家的贡献。
谢谢大家
22
