氧化剂、还原剂 高一上学期化学人教版(2019)必修第一册(共20张PPT)
文档属性
| 名称 | 氧化剂、还原剂 高一上学期化学人教版(2019)必修第一册(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 656.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:21:28 | ||
图片预览







文档简介
(共20张PPT)
氧化剂、还原剂
1.从宏观和微观相结合的角度认识常见的氧化剂、还原剂,熟悉
氧化还原反应概念间的关系。
2.依据氧化还原反应原理,预测物质的化学性质和变化,设计实 验初步验证,并能分析、解释有关实验现象。
3.理解物质的氧化性、还原性,建立判断物质氧化性、还原性强 弱的思维模型。
核心素养发展目标
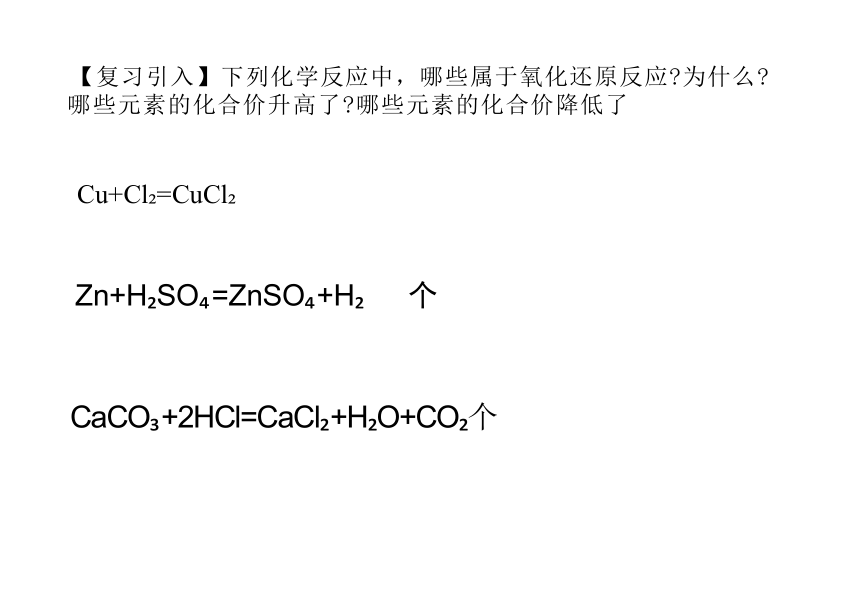
【复习引入】下列化学反应中,哪些属于氧化还原反应 为什么 哪些元素的化合价升高了 哪些元素的化合价降低了
Cu+Cl =CuCl
Zn+H SO =ZnSO +H 个
CaCO +2HCl=CaCl +H O+CO 个
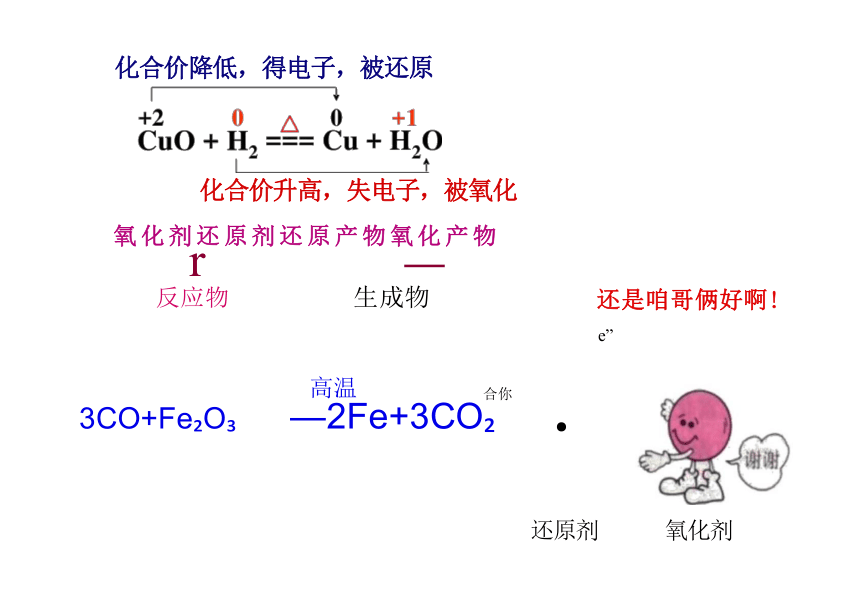
化合价升高,失电子,被氧化
氧化剂还原剂还原产物氧化产物
r
反应物 生成物 还是咱哥俩好啊!
e”
高温 合你
3CO+Fe O —2Fe+3CO
化合价降低,得电子,被还原
还原剂 氧化剂
●
二、氧化剂和还原剂
氧化剂:得到电子(或电子对偏向)的物质,在反应中所含元素
的化合价降低。
具有氧化性。
还 原 剂 :失去电子(或电子对偏离)的物质,在反应中所含元素
的化合价升高。
具有还原性。
二、氧化产物和还原产物
氧化产物:还原剂被_ 氧 化生成的物质。发生氧化反应的产物。 具有氧化性。
还原产物:氧化剂被_ 还 原 _生成的物质。发生还原反应的产物。 具有还原性。
三 、物质氧化性、还原性强弱的判断
氧化剂+还原剂—还原产物+氧化产物
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
例如:Fe+CuSO ===FeSO +Cu, 则有:
氧化性强弱: CuSO >FeSO ;
还原性强弱: Fe>Cu
四、氧化还原反应的规律
升、失、被氧化、作还原剂、得到氧化产物。 降、得、被还原、作氧化剂、得到还原产物。
练习1:指出下列反应的氧化剂、还原剂、氧化产物和 还原产物。
MnO +4HCI(浓) === MnCl +Cl 个+2H O
氧化剂 还原剂 还原产物 氧化产物
2H S +SO ==3S ↓+2H O
还原剂 氧化剂 还原产物
2KClO ===2KCl +30 个
氧 化 剂
还 原 产 物 氧 化 产 物
还 原 剂
氧化产物
氧化剂
还原剂
单质 O 、Cl 、Br
Na、Fe、H 、C
化 合 物 氧化物 MnO 、CO
CO、SO
盐 FeCl 、KMnO 、KClO
FeSO 、Na SO
含氧酸 HClO、HNO 、浓硫酸
H SO
无氧酸 HCl
H S、HCl
其 它 HClO、漂白粉、Na O
浓盐酸、NH
五、常见的氧化剂和还原剂
MnO >Cl >Br >Fe +>I > 稀硫酸>S
NO (H+)和浓硫酸都>Fe +
熟记两条强弱顺序:
还原性: Mn +氧化性:
练习
1 、R、X 、Y 和Z四种元素,在化学反应中化合价均 为 十 2 , 且X + 与 单 质R 不反应:
X ++Z=X+Z +;Y+Z +=Y ++Z。
这四种离子被还原成单质时表现的氧化性强弱为
(A)
A 、R2+>X2+>Z2+>Y2+
B 、X2+>R2+>Y2+>Z2+
C 、Y2+>Z2+>R2+>X2+
D 、Z2+>X2+>R2+>Y2+
2、已知还原性Cl-判断下列反应不能发生的是 ( C )
A.2Fe ++SO +2H O==SO 2-+4H++2Fe + B.I +SO +2H O==H SO +2HI
C.H O +2H++SO -==SO +O +2H O
D.2Fe ++2I-==2Fe ++I
3、已知反应:①Cl +2NaBr===2NaCl+Br ;
②2KI+Br ===2KBr+I ;③Na S+I ===2NaI+SJ, 则下列离子还原性由强到弱的排列中,正确的是(D)
A.CI->Br->I->S2— B.Br->CI->I->S2-
C.S2->Br->I->CI D.S2->I->Br->CI-
化合价升高,失去2×e ”, 被氧化
失去6×2 e-
2KClO ==2KCI +30 个
得2×6e-
A、箭头连接反应前后不同
价态的同种元素,且从
反应物指向生成物。
B、标得失
(得失电子总数相等)
C、电子转移的数目
m ×ne
m 反应中实际有多少个原子 发生了电子转移
n 1个原子转移的电子数目
(1)“双线桥”法
化合价降低,得到2e”, 被还原
六、氧化还原反应的表示方法:
注意:
得2×5e
K M nO +HCi==KCl+M nCl +C l 个+H O 氧化剂 还原剂
失10×e-
氧化剂与还原剂的物质的量之比:
盐酸的性质:
每生成1mol氯气转移的电子数:
0
+2
7
+
练习:用“双线桥”法表示下列氧化还原反应电子转 移的方向和数目,并指出氧化剂和还原剂。
练习:用 “双线桥”法表示下列氧化还原反应电子转 移的方向和数目,并指出氧化剂、还原剂和氧化产物、 还原产物。
Cu+HNO =Cu(NO ) +NO 个+ H O
氧化剂与还原剂的物质的量之比:
盐酸的性质:
每生成1molNO转移的电子数:
注意:A 、箭头由失电子元素指向得电子元素。
B、只须标明电子转移总数。
(2)“单线桥”法
【再来一刀】实验室中所用少量氯气是用下列方法 制取的:
4HCI(浓)+MnO 全Cl ^+MnCl +2H O 试回答下列问题:
(1)请指出MnO, 是氧化剂,HCI 是还原剂,
写出该反应的离子方程式:
4H++2CI 二士MnO ==Cl ^ 叶Mn ++2H O
(2)盐酸表现的性质是 还原性、酸性
(3)每生成1mol Cl ,转移的电子数为_ 2 mol。
氧化还原反应的规律
1.守恒规律
化合价有升必有降,电子有得必有失,对于一 个完整的氧化还原反应,化合价升高总数与降低总 数相等,失去电子总数与得到电子总数相等。此外 反应前后质量相等,电荷总数相等(离子反应)。
2. 价态规律
元素处于最高价态,只有氧化性(如Fe +、 KMnO 等);
元素处于最低价态,只有还原性(如S -、I-等);
元素处于中间价态,既有氧化性又有还原性 (如Fe + 等 ) 。
3. 先后规律:即在氧化还原反应中,遵循强者为
先,即谁的氧化性(或还原性)最强,谁就先发生反应。
4. 归中规律:“只靠近,不相交”规律,即同种元 素不同价态之间,相邻价态不反应,发生反应时化合 价向中间靠拢,但不交叉。
如:H S+H SO (浓)====S↓+SO 个+2H O 中 硫元素的价态变化为: , 而 非
O
我们从这里起航!
氧化剂、还原剂
1.从宏观和微观相结合的角度认识常见的氧化剂、还原剂,熟悉
氧化还原反应概念间的关系。
2.依据氧化还原反应原理,预测物质的化学性质和变化,设计实 验初步验证,并能分析、解释有关实验现象。
3.理解物质的氧化性、还原性,建立判断物质氧化性、还原性强 弱的思维模型。
核心素养发展目标
【复习引入】下列化学反应中,哪些属于氧化还原反应 为什么 哪些元素的化合价升高了 哪些元素的化合价降低了
Cu+Cl =CuCl
Zn+H SO =ZnSO +H 个
CaCO +2HCl=CaCl +H O+CO 个
化合价升高,失电子,被氧化
氧化剂还原剂还原产物氧化产物
r
反应物 生成物 还是咱哥俩好啊!
e”
高温 合你
3CO+Fe O —2Fe+3CO
化合价降低,得电子,被还原
还原剂 氧化剂
●
二、氧化剂和还原剂
氧化剂:得到电子(或电子对偏向)的物质,在反应中所含元素
的化合价降低。
具有氧化性。
还 原 剂 :失去电子(或电子对偏离)的物质,在反应中所含元素
的化合价升高。
具有还原性。
二、氧化产物和还原产物
氧化产物:还原剂被_ 氧 化生成的物质。发生氧化反应的产物。 具有氧化性。
还原产物:氧化剂被_ 还 原 _生成的物质。发生还原反应的产物。 具有还原性。
三 、物质氧化性、还原性强弱的判断
氧化剂+还原剂—还原产物+氧化产物
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
例如:Fe+CuSO ===FeSO +Cu, 则有:
氧化性强弱: CuSO >FeSO ;
还原性强弱: Fe>Cu
四、氧化还原反应的规律
升、失、被氧化、作还原剂、得到氧化产物。 降、得、被还原、作氧化剂、得到还原产物。
练习1:指出下列反应的氧化剂、还原剂、氧化产物和 还原产物。
MnO +4HCI(浓) === MnCl +Cl 个+2H O
氧化剂 还原剂 还原产物 氧化产物
2H S +SO ==3S ↓+2H O
还原剂 氧化剂 还原产物
2KClO ===2KCl +30 个
氧 化 剂
还 原 产 物 氧 化 产 物
还 原 剂
氧化产物
氧化剂
还原剂
单质 O 、Cl 、Br
Na、Fe、H 、C
化 合 物 氧化物 MnO 、CO
CO、SO
盐 FeCl 、KMnO 、KClO
FeSO 、Na SO
含氧酸 HClO、HNO 、浓硫酸
H SO
无氧酸 HCl
H S、HCl
其 它 HClO、漂白粉、Na O
浓盐酸、NH
五、常见的氧化剂和还原剂
MnO >Cl >Br >Fe +>I > 稀硫酸>S
NO (H+)和浓硫酸都>Fe +
熟记两条强弱顺序:
还原性: Mn +
练习
1 、R、X 、Y 和Z四种元素,在化学反应中化合价均 为 十 2 , 且X + 与 单 质R 不反应:
X ++Z=X+Z +;Y+Z +=Y ++Z。
这四种离子被还原成单质时表现的氧化性强弱为
(A)
A 、R2+>X2+>Z2+>Y2+
B 、X2+>R2+>Y2+>Z2+
C 、Y2+>Z2+>R2+>X2+
D 、Z2+>X2+>R2+>Y2+
2、已知还原性Cl-
A.2Fe ++SO +2H O==SO 2-+4H++2Fe + B.I +SO +2H O==H SO +2HI
C.H O +2H++SO -==SO +O +2H O
D.2Fe ++2I-==2Fe ++I
3、已知反应:①Cl +2NaBr===2NaCl+Br ;
②2KI+Br ===2KBr+I ;③Na S+I ===2NaI+SJ, 则下列离子还原性由强到弱的排列中,正确的是(D)
A.CI->Br->I->S2— B.Br->CI->I->S2-
C.S2->Br->I->CI D.S2->I->Br->CI-
化合价升高,失去2×e ”, 被氧化
失去6×2 e-
2KClO ==2KCI +30 个
得2×6e-
A、箭头连接反应前后不同
价态的同种元素,且从
反应物指向生成物。
B、标得失
(得失电子总数相等)
C、电子转移的数目
m ×ne
m 反应中实际有多少个原子 发生了电子转移
n 1个原子转移的电子数目
(1)“双线桥”法
化合价降低,得到2e”, 被还原
六、氧化还原反应的表示方法:
注意:
得2×5e
K M nO +HCi==KCl+M nCl +C l 个+H O 氧化剂 还原剂
失10×e-
氧化剂与还原剂的物质的量之比:
盐酸的性质:
每生成1mol氯气转移的电子数:
0
+2
7
+
练习:用“双线桥”法表示下列氧化还原反应电子转 移的方向和数目,并指出氧化剂和还原剂。
练习:用 “双线桥”法表示下列氧化还原反应电子转 移的方向和数目,并指出氧化剂、还原剂和氧化产物、 还原产物。
Cu+HNO =Cu(NO ) +NO 个+ H O
氧化剂与还原剂的物质的量之比:
盐酸的性质:
每生成1molNO转移的电子数:
注意:A 、箭头由失电子元素指向得电子元素。
B、只须标明电子转移总数。
(2)“单线桥”法
【再来一刀】实验室中所用少量氯气是用下列方法 制取的:
4HCI(浓)+MnO 全Cl ^+MnCl +2H O 试回答下列问题:
(1)请指出MnO, 是氧化剂,HCI 是还原剂,
写出该反应的离子方程式:
4H++2CI 二士MnO ==Cl ^ 叶Mn ++2H O
(2)盐酸表现的性质是 还原性、酸性
(3)每生成1mol Cl ,转移的电子数为_ 2 mol。
氧化还原反应的规律
1.守恒规律
化合价有升必有降,电子有得必有失,对于一 个完整的氧化还原反应,化合价升高总数与降低总 数相等,失去电子总数与得到电子总数相等。此外 反应前后质量相等,电荷总数相等(离子反应)。
2. 价态规律
元素处于最高价态,只有氧化性(如Fe +、 KMnO 等);
元素处于最低价态,只有还原性(如S -、I-等);
元素处于中间价态,既有氧化性又有还原性 (如Fe + 等 ) 。
3. 先后规律:即在氧化还原反应中,遵循强者为
先,即谁的氧化性(或还原性)最强,谁就先发生反应。
4. 归中规律:“只靠近,不相交”规律,即同种元 素不同价态之间,相邻价态不反应,发生反应时化合 价向中间靠拢,但不交叉。
如:H S+H SO (浓)====S↓+SO 个+2H O 中 硫元素的价态变化为: , 而 非
O
我们从这里起航!
