2.1钠及其化合物-高一上学期化学人教版(2019)必修第一册(共50张PPT)
文档属性
| 名称 | 2.1钠及其化合物-高一上学期化学人教版(2019)必修第一册(共50张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-04 00:00:00 | ||
图片预览








文档简介
(共50张PPT)
第一节
钠及其化合物
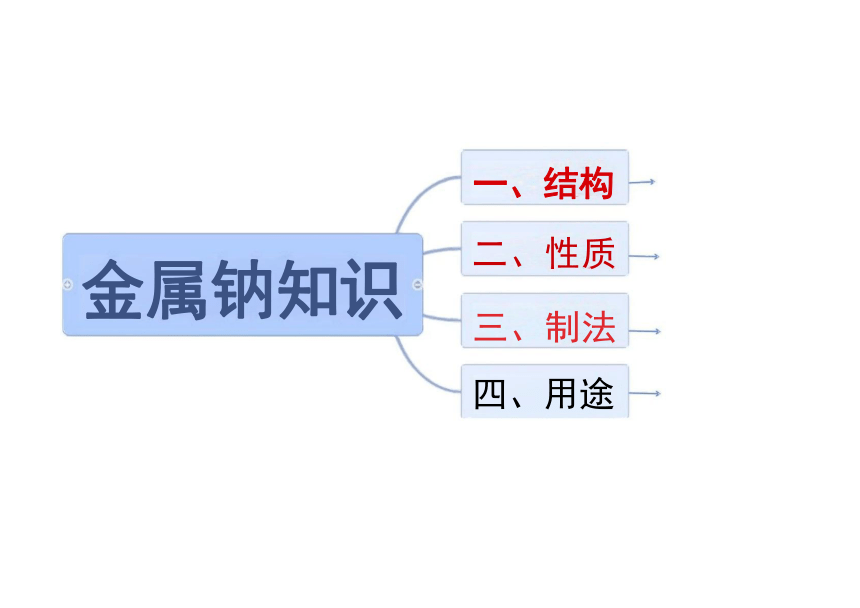
一、结构
金属钠知识
二、性质
三、制法
四、用途
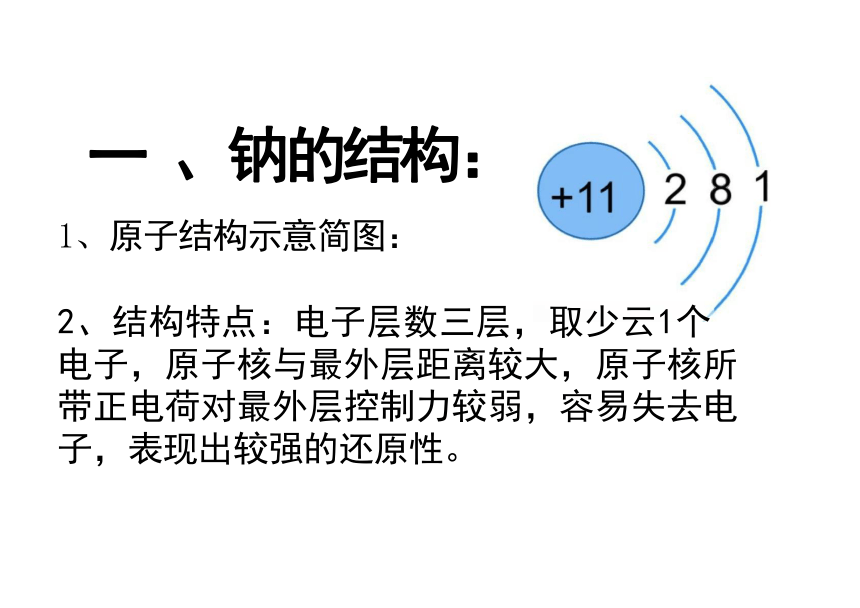
一 、钠的结构:
1、原子结构示意简图:
2、结构特点:电子层数三层,取少云1个 电子,原子核与最外层距离较大,原子核所 带正电荷对最外层控制力较弱,容易失去电 子,表现出较强的还原性。
3、比较钾和钠谁的失去电子能力更强
思路:主要考虑因素,一是最外层电子多 少。二是原子核与最外层的距离大小,主要 看电子层数多少。
可以得出金属钠很容易失去电子,表现出
强还原性,其氧化产物为
Na+
二、金属钠的性质
一)物性:无需死记(投影仪展示样品与切割)
颜色 状态 硬度
气味 溶解性 导电传热
密度
二)化性(重点关键)、
紧紧抓住一个还原性,容易失去电子。
得电子的物质多种多样,概括而言就是与不同类 单质、氧化物、酸、碱、盐反应,有不同化学性 质。
1、单质:只和非金属单质反应,例如和氧气、 氯气、硫、
2Na+0 ≌Na O _ → 淡黄色固体
2Na+O =2Na 0— 白色固体
对于化学反应而言,反应条件不同, 产物也可能会有所不同。
钠在空气中燃烧
2、氧化物:金属氧化物一般不考虑,非金属氧
化物和水、二氧化碳、二氧化硫
4Na+CO 点燃 2Na O+C
2Mg+CO 点燃2MgO+C
2Na+2H O=2Na++20H +H
2001年07月07~09日,神秘“水雷”惊现珠江,几个飘在水面 上的铁桶内蹿出亮红色的火苗,紧接着一声巨响,水柱冲天, 炸起千层浪,但所幸无人员伤亡。
据查,“水雷”为装满金属钠的铁桶。祸首到底是谁 是铁还
是钠呢
生活中我们常用铁壶来烧水,说明即使是热水,铁也是不与
其作用的。
那么真正的元凶可能就是钠了。
资料卡片
认识钠
问题:为什么会出现水雷
【实验】
模拟事故现场,试探究钠与水反应生成的物质。
在烧杯中加入一些水,滴加几滴酚酞溶液然后把一块绿 豆大的钠放入水中。
演示【实验钠与水反应】
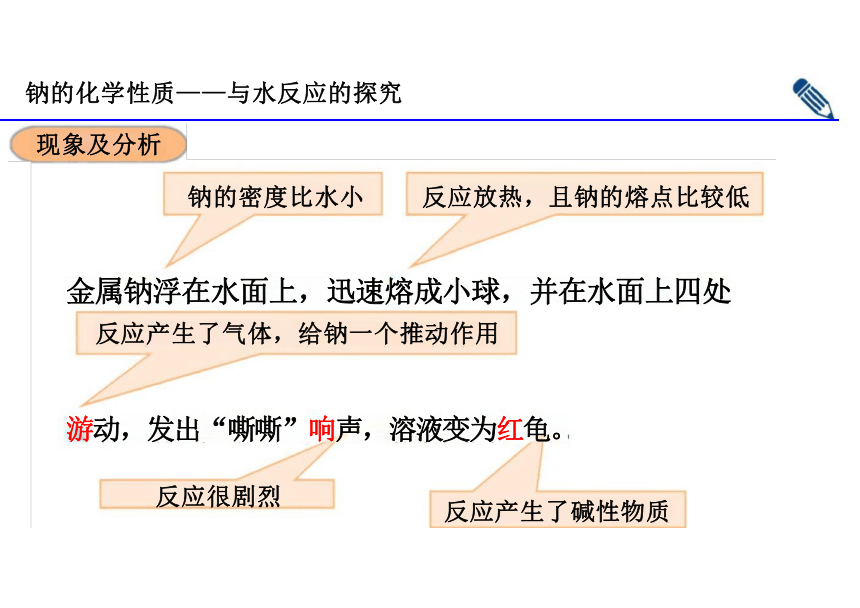
钠的化学性质——与水反应的探究
现象及分析
钠的密度比水小 反应放热,且钠的熔点比较低
金属钠浮在水面上,迅速熔成小球,并在水面上四处 反应产生了气体,给钠一个推动作用
游动,发出“嘶嘶”响声,溶液变为红龟。
钠的化学性质——与水反应的探究
反应产生了碱性物质
反应很剧烈
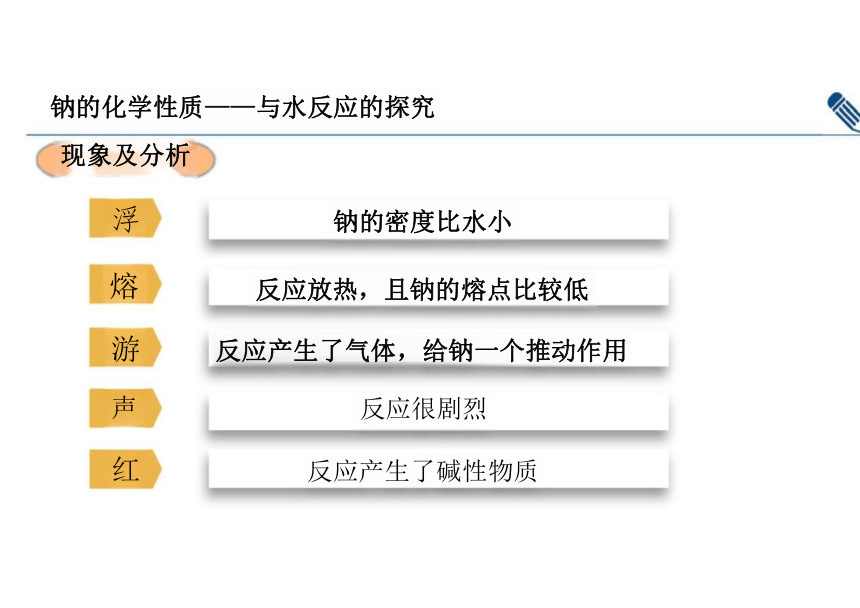
钠的化学性质——与水反应的探究
现象及分析
浮 钠的密度比水小
熔 反应放热,且钠的熔点比较低
游 反应产生了气体,给钠一个推动作用 声 反应很剧烈
红 反应产生了碱性物质
3、和酸反应:酸—般是水溶液,有大量的水分子, 它也能产生极少量的 ,酸本身产生的比水+ 的多得多,所以和酸反应:
2Na+2H+=2Na+H
4、和碱反应
5、和盐反应
出 现 白 色 固 体
( 生 成NaOH)
③ 吸 H O
表 面 变 成 溶 液 (NaOH 潮 解 )
讨论:金属钠露置在空气中会发生怎样的变化呢
Na 长 时 间 暴 露 空 气 , 最 后 生 成 什 么 物 质
发 生 主 要 变 化 的 化 学 方 程 式
(1)4Na+O =2Na O
(3)2NaOH+CO =Na CO +H O
(4)Na CO -10H O=Na CO +10H O
风化 白 色 块 状 物 ( 生
⑤ 成Na CO -10H O)
(2)Na O+H O=2NaOH
Na CO +10H O=Na CO -10H O
白 色 粉 末 状 物 质
( 生 成Na CO )
银 白 色 金 属
钠 (Na)
表 面 变 暗 ( 生 成Na,O)
与CO
反 应
④
与O 反 应 ①
反 应
②
与H O
但自然界中并不存在游离
的钠,钠元素都以化合物的形 式存在,大多储存在海水中。
19世纪初(1807年),英 国化学家戴维解开了这个谜
团,在实验室中首次制得了
钠。
19世纪初 实验室中首次制得了金属钠
汉弗莱 ·戴维 4Na+O t+2H O
三、制法
认识钠
1、做贵金属还原 剂(Ha Ta Nb)
2、高压钠灯光 (透雾力强)
3、做原子核反应 堆导热剂
4、做过氧化钠
作业:学法第一 课时
四、用途
氧化钠 Na O 碱性氧化物
过氧化钠 不是碱性氧化物
NaCl。
盐 NaHCO Na CO 3
氧化物
氢氧化物
二、钠的化合物
钠的化合物
千奇百怪的海底生物吸引着我
们不断的去探索海底的神秘世界,然 而作为哺乳动物的人类,要怎样才能 在海底自由自在的呼吸呢
呼吸面具的出现让这一切变得 可能,带上面具的人类如同美人鱼一 般穿梭于海水中,与奇妙的海洋生物 亲密接触。
过氧化钠
过氧化钠——呼吸面具下的秘密
钠和氧元素化合时可以生成两种化合物——氧化钠和过氧化
钠。它们的称呼虽然只有一字之差,但是结构却截然不同。
Na O 和Na O 化学性质大比拼
Na+{oo) Na+
氧化钠和过氧化钠差异如下图:
Na+[OjNar
Na O和Na O 化学性质大比拼
O -
Na+
Na+
:1
2
2
1
Na O+H O=2NaOH
Na O+CO =Na CO
Na O+2HCl=2NaCl+H O
2Na O +2H O=4NaOH+0 个 2Na O +2CO =2Na CO +0 个
2Na O +4HCl=4NaCl+2H 0+0 个
性质
化学性质
碱性氧化 物的通性
与酸、水、 二氧化碳 发生氧化 还原反应
决定
物理性质
白色的固
体
淡黄色固
体
结构
氧化钠
过氧化钠
Na O 和Na O 化学性质大比拼
2Na O +2H O=4NaOH+O 个
2Na O +2CO =2Na CO +O
2Na O +4HCl=4NaCl+2H O+O 个
Na O+H O=2NaOH
Na O+CO =Na CO
Na O+2HCI=2NaCl+H O
Na O 和Na O 化学性质大比拼
Na O和Na O 反应产物比较
名称 氧化钠
过氧化钠
化学式 Na20
Na202
颜色 白色
淡黄色
生成条件 常温
燃烧
氧的价态 -2
-1
阳、阴离 子个数比 2:1
2:1
类别 碱性氧化物
氧化物
与水反应 Na O+H O—2NaOH
2Na O +2H O — 4NaOH +0 个
与C02反应 Na 0+CO —Na CO
2Na O +2C0 ——2Na CO +0,
|知识小结
失去2xe-
-2 0
0. 十 H ——4NaOH 十 0 个
得到2xe-
既是氧化剂
又是还原剂
0
0
2
L
·过氧化钠与水反应
|思考与讨论
名称 碳酸钠
碳酸氢钠
化学式 0Na CO
2NaHCO
色态 白色粉末
细小白色晶体
俗称 3纯碱、苏打
4小苏打
二、碳酸钠和碳酸氢钠
1.碳酸钠、碳酸氢钠物理性质的比较
(1)化学式、色态及俗称
课本P36 碳酸钠
碳酸氢钠
【实验2 -4】
化学式 Na CO
NaHCO
俗 名 纯碱、苏打
小苏打
(1)观察外观 白色粉末
细小白色晶体
【实验2 -4】 Na2CO3
NaHCO3
(2)加入几滴水, 结块,变成成晶体;
加水部分溶解;
插入温度计 温度上升
温度下降
(3)再加5mL水 溶解
固体量减少
(4)再加1~2滴酚 酞溶液 变红(较深)
变红(较浅)
结论 1、Na CO 溶于水放热,NaHCO 溶于水吸热 2、溶解度:Na CO 大于NaHCO 3、碱性:Na CO 强于NaHCO
过量 过量
NH CO
NaCl饱液。 氨化液 固液混合
NaHCO 固体然 Na CO
执
NaCI
NH Cl 溶液 NH Cl(S)
加
侯德榜制碱法流程示意图
过滤
2、碳酸钠与碳酸氢钠的化学性质:
A、热稳定性
B、和酸反应
C、和碱反应
D、和盐反应
【结论】4、稳定性:Na CO 大 于NaHCO
|实验2-5
碳酸钠、碳酸氢钠溶液与酸反应:
操作1:在盛有Na CO ,NaHCO 约2ml的试管中,分别 滴加同浓度的盐酸,观察
操作2:在盛有各约2ml的盐酸中,分别加入
Na CO ,NaHCO 溶液约2ml, 观察
操作3:在盛有Na CO ,NaHCO 溶液约2ml 中滴加醋酸, 观察
酸与盐反应规律:强酸+盐1 弱酸+盐2
强酸与弱酸是相对的,前者可以是强酸,也可以是弱酸, 只要比生成的酸强就可以。
和碱(OH-) 反应
Na CO ,NaHCO 中可以电离产生H+的就可以和OH- 反 应,其中可以与碱反应的是
思考1:Na CO ,NaHCO 溶液中加入BaCl (aq)有何现 象
思考2:Na CO ,NaHCO 溶液中分别加入Ba(OH) (aq)有
和盐反应:
盐1+盐2 —→ 盐3+盐4
规律:反应物溶于水,生成物有沉淀
思考:Na CO ,NaHCO 溶液中加入哪些盐溶液,可能有 反应的举例。
Na CO
NaHCO
现象 白色沉淀
白色沉淀
Na CO +Ca(OH) =CaCO ++2N
aOH
反应方程式 Ca(OH)2+
2NaHCO =CaCO ++2H O+Na
思考与讨论
5.与Ca(OH)2溶液反应
CO
思考与讨论
观察P36图2-6碳酸钠与碳酸氢钠的主要用途,思考以下几个问题:
1、为什么碳酸氢钠可以用来制作糕点
碳酸氢钠与固体酸性材料反应生成气体具有膨松效果
2、为什么碳酸氢钠可以用来做胃药,碳酸钠不可以
碳酸氢钠碱性弱,对人体伤害小,而且与盐酸反应快,见效迅 速。但胃溃疡患者慎用。
3、为什么用碳酸钠来制肥皂,不用碳酸氢钠
碳酸钠碱性更强
1、产生能使石灰水变浑浊的气体——NaHCO
2、固体质量减轻——NaHCO
思考与讨论
【想一想】如何鉴别Na2C03 与NaHC03
溶液 1、沉淀法:BaCl 、CaCl
2、气体法:逐滴滴入稀盐酸
固体
加热法
思考与讨论
【想一想】如何实现Na2C03与NaHC03之间的转化
(1)固体:加热
(2)溶液:NaOH
NaHCO
CO +H O
Na CO
请思考:
大家知道节日燃放的五彩缤纷的烟花是
怎么来的吗 https://v./x/page/a0805lyarpd.html
三 、焰色试验
三、焰色试验
注意事项:
1.焰色反应是金属元素的性质,可以是游离态(单质),
也可以是化合态(化合物),如Na 和NaCl、Na2CO3 等焰 色反应都为黄色。
2.并非所有金属元素都能发生焰色反应,如Fe、Al、Pt 等金属元素均不发生焰色反应,故可用铂丝或铁丝来蘸取 待检溶液做焰色反应。
3.钾的焰色为紫色,但在观察钾的焰色时,要透过蓝色 钴玻璃,以滤去钠的黄光,避免钠盐造成干扰。
4.利用焰色反应可以检验某些用常规化学方法不能鉴别 的金属元素(主要是钠和钾)。
5.将铂丝或铁丝用盐酸洗净后放在火焰上灼烧至与原火 焰颜色相同,是为了除去上面沾有的杂质。
1.下列叙述正确的是( D )
①Na O与Na O 都能和水反应生成碱,它们都是碱性氧化物
②Na O 与CO 发生化合反应生成Na CO ,Na O 与CO 发生置换 反应生成O
③Na O主要作氧化剂,Na O 主要作还原剂
④Na O 可作供氧剂,而Na O 不行
⑤Na O2 是强氧化剂,Na O 是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D 、④⑤
2. 下列说法中不正确的是 ( D )
A 、Na CO 比NaHCO 易溶于水
B 、Na CO 比NaHCO 稳定
C 、Na CO 和NaHCO 都能跟石灰水反应得到白色沉淀
D 、物质的量相等的Na CO 和NaHCO 分别与盐酸反应得CO 的 物 质的量之比为2:1
3. 不能用来鉴别Na CO 和NaHCO 两种白色固体的实验操作是( D ) A、加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水
4.有 关Na CO 和NaHCO 的性质,下列叙述错误的是( C
A、等质量的Na CO 和NaHCO 与足量的盐酸反应,在相同的条件下 NaHCO 产生的CO 气体体积大
B、同一温度下,与等浓度的盐酸反应时,NaHCO 比Na CO 剧烈 C、与同种酸反应生成等量的CO 时,所消耗的酸的量相等
D、将石灰水加入到NaHCO 溶液中将会产生沉淀
点燃酒精灯加热,能观察到的实验现象是小试管中 棉花球变蓝色,B 烧杯中澄清石灰水变浑浊,A 中有少 量气泡冒出,澄清石灰水不变浑浊。
NaHCO, 棉花球
Na CO, 澄清
A B
二、碳酸钠和碳酸氢钠
2. 碳酸钠、碳酸氢钠的热稳定性
(1)如图所示实验为“套管实验”,小试管内塞有沾 有白色无水硫酸铜粉末的棉花球。
石灰水
(2)实验结论:Na CO 受 热 ;NaHCO 受
热易分解,生成物中含有 。由此可知, Na CO 的热稳定性比NaHCO 。NaHCO 受热 分解的化学方程式为
(3)Na2CO3 和NaHCO3 与盐酸的反应 Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2
① +②:Na2CO3+2HC1=2NaCl+H2O+CO2
二 、碳酸钠和碳酸氢钠
CO32-+H 十 =HCO3- ①
HCO3-+H+=H2O+CO2 个 ②
① +②:CO32-+2H+=H2O+CO2 个
① 个 ②
个
写出下列物质的电离方程式
Fe (SO ) KMnO KAl(SO )
根据化学方程式书写离子方程式
(1)Na CO +Ca(OH) =CaCO l+2NaOH (2)MgSO +Ba(OH) =BaSO ↓+Mg(OH) ↓ (3)2HCl+BaCO =BaCl +H O+CO 个
根据离子方程式书写其中一个化学方程式
(1)Ba ++2OH-+2H++SO -=BaSO ↓+2H O
(2)Ca ++CO -=CaCO ↓
(3)CO 2-+2H+=H O+CO T
□ 思维拓展作业:在密闭容器中加入NaHCO 和 NaOH的混合物共23g, 加热至250℃,经充分反应后 排出气体,冷却得到剩余固体质量为15.9g, 试计算原 固体混合物中两种组分的质量(写出必要的计算过
程 ) .
[
解:加热过程中可能发生的反应为
NaHCO +NaOH —△-Na CO +H O ①、
2NaHCO —△-Na CO +H O+CO 个 ② ,
加热冷却后,固体减少的质量=23g-15.9g=7.1g,
如果NaHCO 和NaOH恰好反应或NaOH过量,则发生① 的反应,如果NaHCO 过量,发生①②的反应,
如果恰好反应,设生成水的质量为xg
设NaOH质量为y, 则凶aHCO 质量为23-y
NaHCO +NaOH————Na CO + H O
84g 40g 106g 18g 84y/40 y 106y/40
NaHCO +NaOH ————Na CO +H O 124g 18g 23g X
124g:18g=23g:x
X=18g×23g/124g=3.34g<7.1g, 则 NaHCO 过量,
①
①
最后剩余固体肯定是Na CO , 来自于两部分,一是反应 ①,其质量为106y/40, 还有就是来自反应②分解产生的, 其质量=106*(23g-84y/40-y)/168
2NaHCO —△-H O+CO 个+Na CO ② ,
168g 106g
(23g-84y/40-y) 106*(23g-84y/40-y)/168 根据题意:106*(23g-84y/40-y)/168+106y/40=15.9 可以解方程得y=2g
则NaHCO 质量=23-2=21g
第一节
钠及其化合物
一、结构
金属钠知识
二、性质
三、制法
四、用途
一 、钠的结构:
1、原子结构示意简图:
2、结构特点:电子层数三层,取少云1个 电子,原子核与最外层距离较大,原子核所 带正电荷对最外层控制力较弱,容易失去电 子,表现出较强的还原性。
3、比较钾和钠谁的失去电子能力更强
思路:主要考虑因素,一是最外层电子多 少。二是原子核与最外层的距离大小,主要 看电子层数多少。
可以得出金属钠很容易失去电子,表现出
强还原性,其氧化产物为
Na+
二、金属钠的性质
一)物性:无需死记(投影仪展示样品与切割)
颜色 状态 硬度
气味 溶解性 导电传热
密度
二)化性(重点关键)、
紧紧抓住一个还原性,容易失去电子。
得电子的物质多种多样,概括而言就是与不同类 单质、氧化物、酸、碱、盐反应,有不同化学性 质。
1、单质:只和非金属单质反应,例如和氧气、 氯气、硫、
2Na+0 ≌Na O _ → 淡黄色固体
2Na+O =2Na 0— 白色固体
对于化学反应而言,反应条件不同, 产物也可能会有所不同。
钠在空气中燃烧
2、氧化物:金属氧化物一般不考虑,非金属氧
化物和水、二氧化碳、二氧化硫
4Na+CO 点燃 2Na O+C
2Mg+CO 点燃2MgO+C
2Na+2H O=2Na++20H +H
2001年07月07~09日,神秘“水雷”惊现珠江,几个飘在水面 上的铁桶内蹿出亮红色的火苗,紧接着一声巨响,水柱冲天, 炸起千层浪,但所幸无人员伤亡。
据查,“水雷”为装满金属钠的铁桶。祸首到底是谁 是铁还
是钠呢
生活中我们常用铁壶来烧水,说明即使是热水,铁也是不与
其作用的。
那么真正的元凶可能就是钠了。
资料卡片
认识钠
问题:为什么会出现水雷
【实验】
模拟事故现场,试探究钠与水反应生成的物质。
在烧杯中加入一些水,滴加几滴酚酞溶液然后把一块绿 豆大的钠放入水中。
演示【实验钠与水反应】
钠的化学性质——与水反应的探究
现象及分析
钠的密度比水小 反应放热,且钠的熔点比较低
金属钠浮在水面上,迅速熔成小球,并在水面上四处 反应产生了气体,给钠一个推动作用
游动,发出“嘶嘶”响声,溶液变为红龟。
钠的化学性质——与水反应的探究
反应产生了碱性物质
反应很剧烈
钠的化学性质——与水反应的探究
现象及分析
浮 钠的密度比水小
熔 反应放热,且钠的熔点比较低
游 反应产生了气体,给钠一个推动作用 声 反应很剧烈
红 反应产生了碱性物质
3、和酸反应:酸—般是水溶液,有大量的水分子, 它也能产生极少量的 ,酸本身产生的比水+ 的多得多,所以和酸反应:
2Na+2H+=2Na+H
4、和碱反应
5、和盐反应
出 现 白 色 固 体
( 生 成NaOH)
③ 吸 H O
表 面 变 成 溶 液 (NaOH 潮 解 )
讨论:金属钠露置在空气中会发生怎样的变化呢
Na 长 时 间 暴 露 空 气 , 最 后 生 成 什 么 物 质
发 生 主 要 变 化 的 化 学 方 程 式
(1)4Na+O =2Na O
(3)2NaOH+CO =Na CO +H O
(4)Na CO -10H O=Na CO +10H O
风化 白 色 块 状 物 ( 生
⑤ 成Na CO -10H O)
(2)Na O+H O=2NaOH
Na CO +10H O=Na CO -10H O
白 色 粉 末 状 物 质
( 生 成Na CO )
银 白 色 金 属
钠 (Na)
表 面 变 暗 ( 生 成Na,O)
与CO
反 应
④
与O 反 应 ①
反 应
②
与H O
但自然界中并不存在游离
的钠,钠元素都以化合物的形 式存在,大多储存在海水中。
19世纪初(1807年),英 国化学家戴维解开了这个谜
团,在实验室中首次制得了
钠。
19世纪初 实验室中首次制得了金属钠
汉弗莱 ·戴维 4Na+O t+2H O
三、制法
认识钠
1、做贵金属还原 剂(Ha Ta Nb)
2、高压钠灯光 (透雾力强)
3、做原子核反应 堆导热剂
4、做过氧化钠
作业:学法第一 课时
四、用途
氧化钠 Na O 碱性氧化物
过氧化钠 不是碱性氧化物
NaCl。
盐 NaHCO Na CO 3
氧化物
氢氧化物
二、钠的化合物
钠的化合物
千奇百怪的海底生物吸引着我
们不断的去探索海底的神秘世界,然 而作为哺乳动物的人类,要怎样才能 在海底自由自在的呼吸呢
呼吸面具的出现让这一切变得 可能,带上面具的人类如同美人鱼一 般穿梭于海水中,与奇妙的海洋生物 亲密接触。
过氧化钠
过氧化钠——呼吸面具下的秘密
钠和氧元素化合时可以生成两种化合物——氧化钠和过氧化
钠。它们的称呼虽然只有一字之差,但是结构却截然不同。
Na O 和Na O 化学性质大比拼
Na+{oo) Na+
氧化钠和过氧化钠差异如下图:
Na+[OjNar
Na O和Na O 化学性质大比拼
O -
Na+
Na+
:1
2
2
1
Na O+H O=2NaOH
Na O+CO =Na CO
Na O+2HCl=2NaCl+H O
2Na O +2H O=4NaOH+0 个 2Na O +2CO =2Na CO +0 个
2Na O +4HCl=4NaCl+2H 0+0 个
性质
化学性质
碱性氧化 物的通性
与酸、水、 二氧化碳 发生氧化 还原反应
决定
物理性质
白色的固
体
淡黄色固
体
结构
氧化钠
过氧化钠
Na O 和Na O 化学性质大比拼
2Na O +2H O=4NaOH+O 个
2Na O +2CO =2Na CO +O
2Na O +4HCl=4NaCl+2H O+O 个
Na O+H O=2NaOH
Na O+CO =Na CO
Na O+2HCI=2NaCl+H O
Na O 和Na O 化学性质大比拼
Na O和Na O 反应产物比较
名称 氧化钠
过氧化钠
化学式 Na20
Na202
颜色 白色
淡黄色
生成条件 常温
燃烧
氧的价态 -2
-1
阳、阴离 子个数比 2:1
2:1
类别 碱性氧化物
氧化物
与水反应 Na O+H O—2NaOH
2Na O +2H O — 4NaOH +0 个
与C02反应 Na 0+CO —Na CO
2Na O +2C0 ——2Na CO +0,
|知识小结
失去2xe-
-2 0
0. 十 H ——4NaOH 十 0 个
得到2xe-
既是氧化剂
又是还原剂
0
0
2
L
·过氧化钠与水反应
|思考与讨论
名称 碳酸钠
碳酸氢钠
化学式 0Na CO
2NaHCO
色态 白色粉末
细小白色晶体
俗称 3纯碱、苏打
4小苏打
二、碳酸钠和碳酸氢钠
1.碳酸钠、碳酸氢钠物理性质的比较
(1)化学式、色态及俗称
课本P36 碳酸钠
碳酸氢钠
【实验2 -4】
化学式 Na CO
NaHCO
俗 名 纯碱、苏打
小苏打
(1)观察外观 白色粉末
细小白色晶体
【实验2 -4】 Na2CO3
NaHCO3
(2)加入几滴水, 结块,变成成晶体;
加水部分溶解;
插入温度计 温度上升
温度下降
(3)再加5mL水 溶解
固体量减少
(4)再加1~2滴酚 酞溶液 变红(较深)
变红(较浅)
结论 1、Na CO 溶于水放热,NaHCO 溶于水吸热 2、溶解度:Na CO 大于NaHCO 3、碱性:Na CO 强于NaHCO
过量 过量
NH CO
NaCl饱液。 氨化液 固液混合
NaHCO 固体然 Na CO
执
NaCI
NH Cl 溶液 NH Cl(S)
加
侯德榜制碱法流程示意图
过滤
2、碳酸钠与碳酸氢钠的化学性质:
A、热稳定性
B、和酸反应
C、和碱反应
D、和盐反应
【结论】4、稳定性:Na CO 大 于NaHCO
|实验2-5
碳酸钠、碳酸氢钠溶液与酸反应:
操作1:在盛有Na CO ,NaHCO 约2ml的试管中,分别 滴加同浓度的盐酸,观察
操作2:在盛有各约2ml的盐酸中,分别加入
Na CO ,NaHCO 溶液约2ml, 观察
操作3:在盛有Na CO ,NaHCO 溶液约2ml 中滴加醋酸, 观察
酸与盐反应规律:强酸+盐1 弱酸+盐2
强酸与弱酸是相对的,前者可以是强酸,也可以是弱酸, 只要比生成的酸强就可以。
和碱(OH-) 反应
Na CO ,NaHCO 中可以电离产生H+的就可以和OH- 反 应,其中可以与碱反应的是
思考1:Na CO ,NaHCO 溶液中加入BaCl (aq)有何现 象
思考2:Na CO ,NaHCO 溶液中分别加入Ba(OH) (aq)有
和盐反应:
盐1+盐2 —→ 盐3+盐4
规律:反应物溶于水,生成物有沉淀
思考:Na CO ,NaHCO 溶液中加入哪些盐溶液,可能有 反应的举例。
Na CO
NaHCO
现象 白色沉淀
白色沉淀
Na CO +Ca(OH) =CaCO ++2N
aOH
反应方程式 Ca(OH)2+
2NaHCO =CaCO ++2H O+Na
思考与讨论
5.与Ca(OH)2溶液反应
CO
思考与讨论
观察P36图2-6碳酸钠与碳酸氢钠的主要用途,思考以下几个问题:
1、为什么碳酸氢钠可以用来制作糕点
碳酸氢钠与固体酸性材料反应生成气体具有膨松效果
2、为什么碳酸氢钠可以用来做胃药,碳酸钠不可以
碳酸氢钠碱性弱,对人体伤害小,而且与盐酸反应快,见效迅 速。但胃溃疡患者慎用。
3、为什么用碳酸钠来制肥皂,不用碳酸氢钠
碳酸钠碱性更强
1、产生能使石灰水变浑浊的气体——NaHCO
2、固体质量减轻——NaHCO
思考与讨论
【想一想】如何鉴别Na2C03 与NaHC03
溶液 1、沉淀法:BaCl 、CaCl
2、气体法:逐滴滴入稀盐酸
固体
加热法
思考与讨论
【想一想】如何实现Na2C03与NaHC03之间的转化
(1)固体:加热
(2)溶液:NaOH
NaHCO
CO +H O
Na CO
请思考:
大家知道节日燃放的五彩缤纷的烟花是
怎么来的吗 https://v./x/page/a0805lyarpd.html
三 、焰色试验
三、焰色试验
注意事项:
1.焰色反应是金属元素的性质,可以是游离态(单质),
也可以是化合态(化合物),如Na 和NaCl、Na2CO3 等焰 色反应都为黄色。
2.并非所有金属元素都能发生焰色反应,如Fe、Al、Pt 等金属元素均不发生焰色反应,故可用铂丝或铁丝来蘸取 待检溶液做焰色反应。
3.钾的焰色为紫色,但在观察钾的焰色时,要透过蓝色 钴玻璃,以滤去钠的黄光,避免钠盐造成干扰。
4.利用焰色反应可以检验某些用常规化学方法不能鉴别 的金属元素(主要是钠和钾)。
5.将铂丝或铁丝用盐酸洗净后放在火焰上灼烧至与原火 焰颜色相同,是为了除去上面沾有的杂质。
1.下列叙述正确的是( D )
①Na O与Na O 都能和水反应生成碱,它们都是碱性氧化物
②Na O 与CO 发生化合反应生成Na CO ,Na O 与CO 发生置换 反应生成O
③Na O主要作氧化剂,Na O 主要作还原剂
④Na O 可作供氧剂,而Na O 不行
⑤Na O2 是强氧化剂,Na O 是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D 、④⑤
2. 下列说法中不正确的是 ( D )
A 、Na CO 比NaHCO 易溶于水
B 、Na CO 比NaHCO 稳定
C 、Na CO 和NaHCO 都能跟石灰水反应得到白色沉淀
D 、物质的量相等的Na CO 和NaHCO 分别与盐酸反应得CO 的 物 质的量之比为2:1
3. 不能用来鉴别Na CO 和NaHCO 两种白色固体的实验操作是( D ) A、加热这两种固体物质,并将生成的气体通入澄清的石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水
4.有 关Na CO 和NaHCO 的性质,下列叙述错误的是( C
A、等质量的Na CO 和NaHCO 与足量的盐酸反应,在相同的条件下 NaHCO 产生的CO 气体体积大
B、同一温度下,与等浓度的盐酸反应时,NaHCO 比Na CO 剧烈 C、与同种酸反应生成等量的CO 时,所消耗的酸的量相等
D、将石灰水加入到NaHCO 溶液中将会产生沉淀
点燃酒精灯加热,能观察到的实验现象是小试管中 棉花球变蓝色,B 烧杯中澄清石灰水变浑浊,A 中有少 量气泡冒出,澄清石灰水不变浑浊。
NaHCO, 棉花球
Na CO, 澄清
A B
二、碳酸钠和碳酸氢钠
2. 碳酸钠、碳酸氢钠的热稳定性
(1)如图所示实验为“套管实验”,小试管内塞有沾 有白色无水硫酸铜粉末的棉花球。
石灰水
(2)实验结论:Na CO 受 热 ;NaHCO 受
热易分解,生成物中含有 。由此可知, Na CO 的热稳定性比NaHCO 。NaHCO 受热 分解的化学方程式为
(3)Na2CO3 和NaHCO3 与盐酸的反应 Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2
① +②:Na2CO3+2HC1=2NaCl+H2O+CO2
二 、碳酸钠和碳酸氢钠
CO32-+H 十 =HCO3- ①
HCO3-+H+=H2O+CO2 个 ②
① +②:CO32-+2H+=H2O+CO2 个
① 个 ②
个
写出下列物质的电离方程式
Fe (SO ) KMnO KAl(SO )
根据化学方程式书写离子方程式
(1)Na CO +Ca(OH) =CaCO l+2NaOH (2)MgSO +Ba(OH) =BaSO ↓+Mg(OH) ↓ (3)2HCl+BaCO =BaCl +H O+CO 个
根据离子方程式书写其中一个化学方程式
(1)Ba ++2OH-+2H++SO -=BaSO ↓+2H O
(2)Ca ++CO -=CaCO ↓
(3)CO 2-+2H+=H O+CO T
□ 思维拓展作业:在密闭容器中加入NaHCO 和 NaOH的混合物共23g, 加热至250℃,经充分反应后 排出气体,冷却得到剩余固体质量为15.9g, 试计算原 固体混合物中两种组分的质量(写出必要的计算过
程 ) .
[
解:加热过程中可能发生的反应为
NaHCO +NaOH —△-Na CO +H O ①、
2NaHCO —△-Na CO +H O+CO 个 ② ,
加热冷却后,固体减少的质量=23g-15.9g=7.1g,
如果NaHCO 和NaOH恰好反应或NaOH过量,则发生① 的反应,如果NaHCO 过量,发生①②的反应,
如果恰好反应,设生成水的质量为xg
设NaOH质量为y, 则凶aHCO 质量为23-y
NaHCO +NaOH————Na CO + H O
84g 40g 106g 18g 84y/40 y 106y/40
NaHCO +NaOH ————Na CO +H O 124g 18g 23g X
124g:18g=23g:x
X=18g×23g/124g=3.34g<7.1g, 则 NaHCO 过量,
①
①
最后剩余固体肯定是Na CO , 来自于两部分,一是反应 ①,其质量为106y/40, 还有就是来自反应②分解产生的, 其质量=106*(23g-84y/40-y)/168
2NaHCO —△-H O+CO 个+Na CO ② ,
168g 106g
(23g-84y/40-y) 106*(23g-84y/40-y)/168 根据题意:106*(23g-84y/40-y)/168+106y/40=15.9 可以解方程得y=2g
则NaHCO 质量=23-2=21g
