物质的分类及转化 第3课时+高一上学期化学人教版(2019)必修第一册(共45张PPT)
文档属性
| 名称 | 物质的分类及转化 第3课时+高一上学期化学人教版(2019)必修第一册(共45张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:25:50 | ||
图片预览






文档简介
(共45张PPT)
第一节物质的分类及转化
第3课时物质的转化
1.通过典型物质的性质,能对酸、碱、盐、氧化物及它们之间反应进行描述和符号表征,培养“宏 观辨识与微观探析”的核心素养。
2 .通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律,培养“变化观 念与模型认知”的核心素养。
1. 通过物质的宏观特征入手理解物质的性质及其转化。
2. 熟悉酸、碱、盐、氧化物间的转化关系。
学习目标
学习目标
素养目标
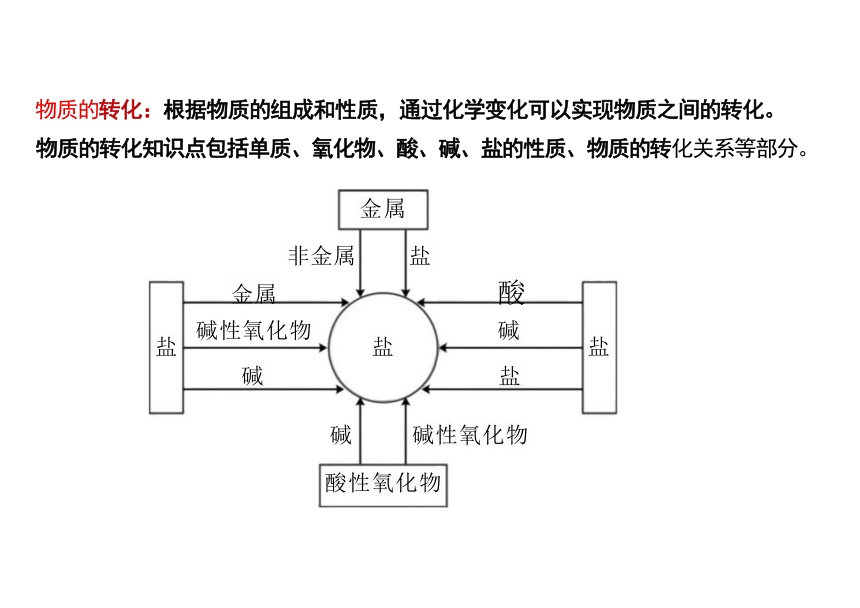
金属
非金属 盐
金属 酸
碱性氧化物 碱
碱 盐
碱 碱性氧化物
酸性氧化物
物质的转化:根据物质的组成和性质,通过化学变化可以实现物质之间的转化。
物质的转化知识点包括单质、氧化物、酸、碱、盐的性质、物质的转化关系等部分。
盐 盐
盐
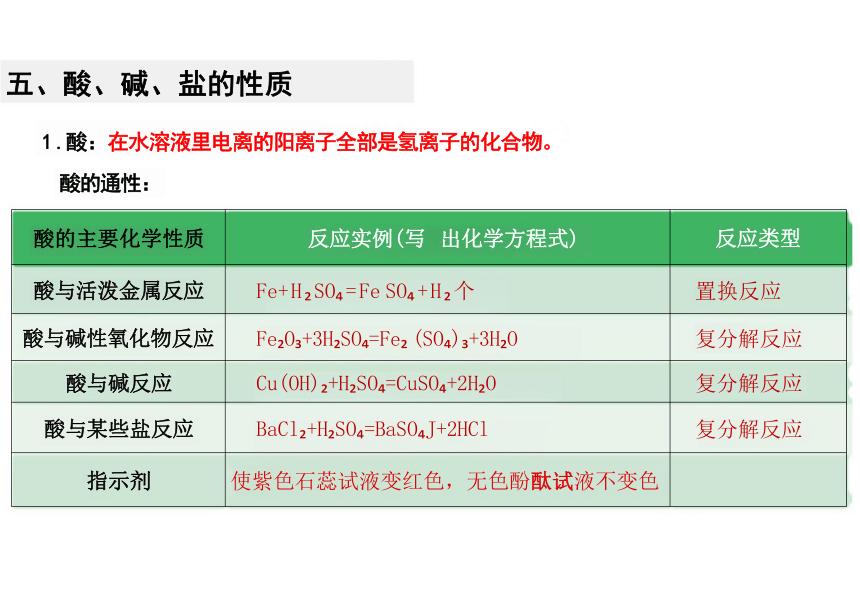
酸的主要化学性质 反应实例(写 出化学方程式)
反应类型
酸与活泼金属反应 Fe+H SO =Fe SO +H 个
置换反应
酸与碱性氧化物反应 Fe O +3H SO =Fe (SO ) +3H O
复分解反应
酸与碱反应 Cu(OH) +H SO =CuSO +2H O
复分解反应
酸与某些盐反应 BaCl +H SO =BaSO J+2HCl
复分解反应
指示剂 使紫色石蕊试液变红色,无色酚酞试液不变色
1 .酸:在水溶液里电离的阳离子全部是氢离子的化合物。
酸的通性:
五、酸、碱、盐的性质
①酸+活泼金属→盐十氢气(置换反应)
Fe+H SO =FeSO +H 个
②酸十碱性氧化物→盐十水(复分解反应)
Fe O +3H SO =Fe (SO ) +3H O
③酸+碱 →盐+水(中和反应) (复分解反应)
Cu(OH) +H SO =CuSO +2H O
④酸+盐→另一酸+另一盐(复分解反应)
BaCl +H SO =BaSO ↓+2HCl
⑤酸使石蕊溶液变红,使酚酞溶液不变色,使甲基橙溶液变红
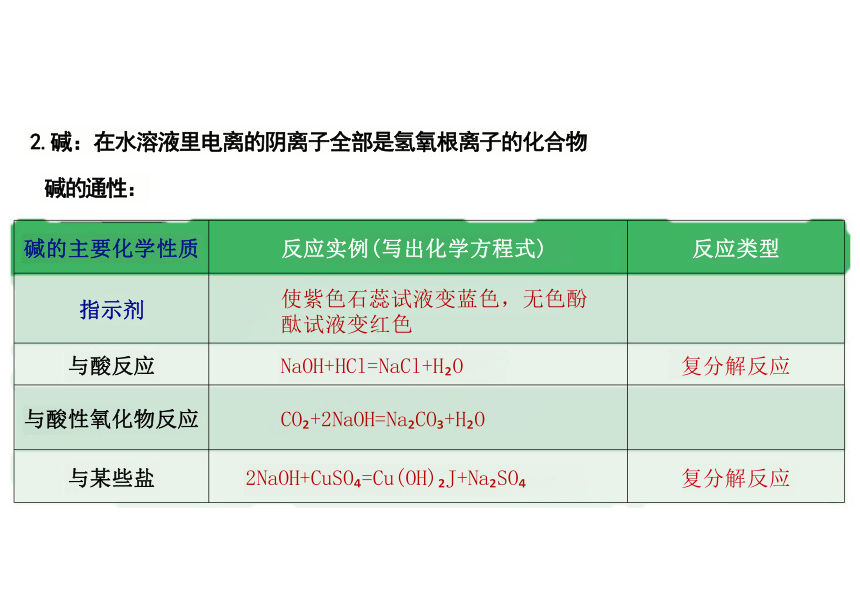
碱的主要化学性质 反应实例(写出化学方程式)
反应类型
指示剂 使紫色石蕊试液变蓝色,无色酚 酞试液变红色
与酸反应 NaOH+HCl=NaCl+H O
复分解反应
与酸性氧化物反应 CO +2NaOH=Na CO +H O
与某些盐 2NaOH+CuSO =Cu(OH) J+Na SO
复分解反应
2.碱:在水溶液里电离的阴离子全部是氢氧根离子的化合物
碱的通性:
①碱+酸性氧化物 → 盐+水
NaOH+HCl=NaCl+H O
②碱+酸 →盐+水(复分解反应)(中和反应)
CO +2NaOH=Na CO +H O
③碱+盐 → 另一碱+另一盐(复分解反应)
2NaOH+CuSO =Cu(OH) J+Na SO
④碱使石蕊溶液变蓝、酚酞变红、甲基橙变黄
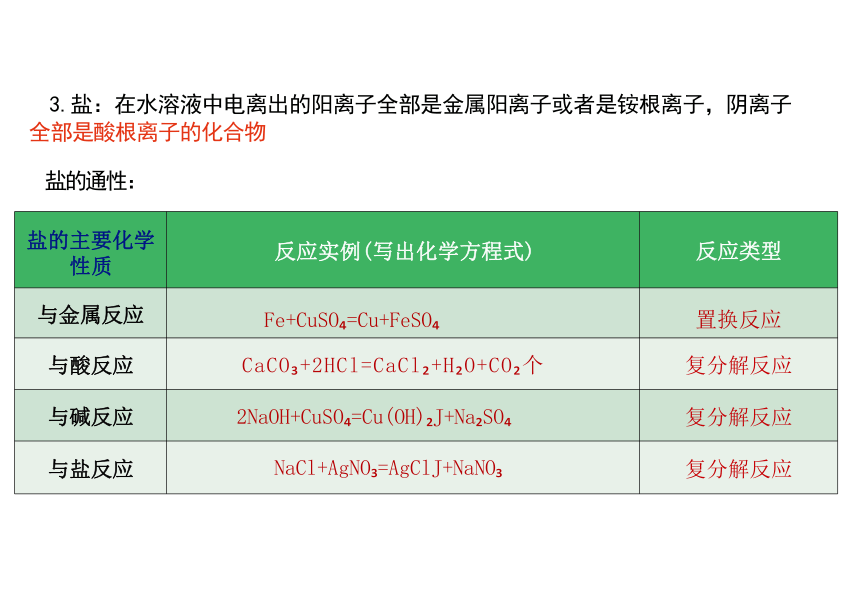
盐的主要化学 性质 反应实例(写出化学方程式)
反应类型
与金属反应 Fe+CuSO =Cu+FeSO
置换反应
与酸反应 CaCO +2HCl=CaCl +H O+CO 个
复分解反应
与碱反应 2NaOH+CuSO =Cu(OH) J+Na SO
复分解反应
与盐反应 NaCl+AgNO =AgClJ+NaNO
复分解反应
3.盐:在水溶液中电离出的阳离子全部是金属阳离子或者是铵根离子,阴离子
全部是酸根离子的化合物
盐的通性:
①盐+金属 → 另一盐+另一金属(置换反应)
Fe +CuSO =Cu+FeSO
②盐+酸 → 另一盐+另一酸(复分解反应)
CaCO +2HCl=CaCl +H O+CO 个
③盐+碱 → 另一盐+另一碱(复分解反应)
2NaOH+CuSO =Cu(OH) J+Na SO
④盐+盐 → 另两种盐(复分解反应)
NaCl+AgNO =AgClJ+NaNO
思考与讨论
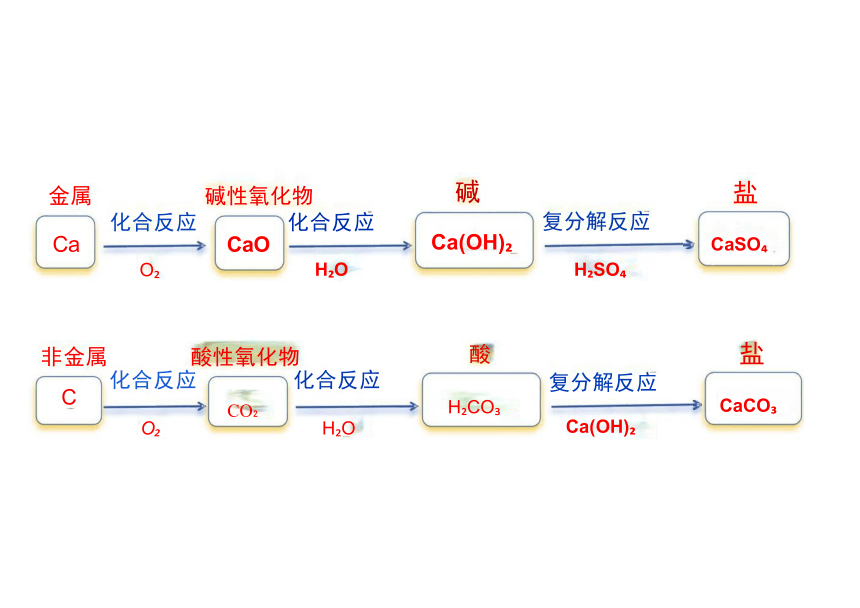
(1)写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属单质 到盐的转化关系。
Ca→CaO→Ca(OH) →CaSO
C→CO →H CO →CaCO
(2)对于上述转化关系,从物质分类的角度看,你发现了什么规律 将你的想 法与同学交流。
六、物质的转化
金属 碱性氧化物 化合反应 化合反应 Ca CaO 碱 Ca(OH)
盐
复分解反应
CaSO
O H O
H SO
非金属 酸性氧化物 化合反应 化合反应 CO O H O 酸 H CO
盐
复分解反应
CaCO
Ca(OH)
C
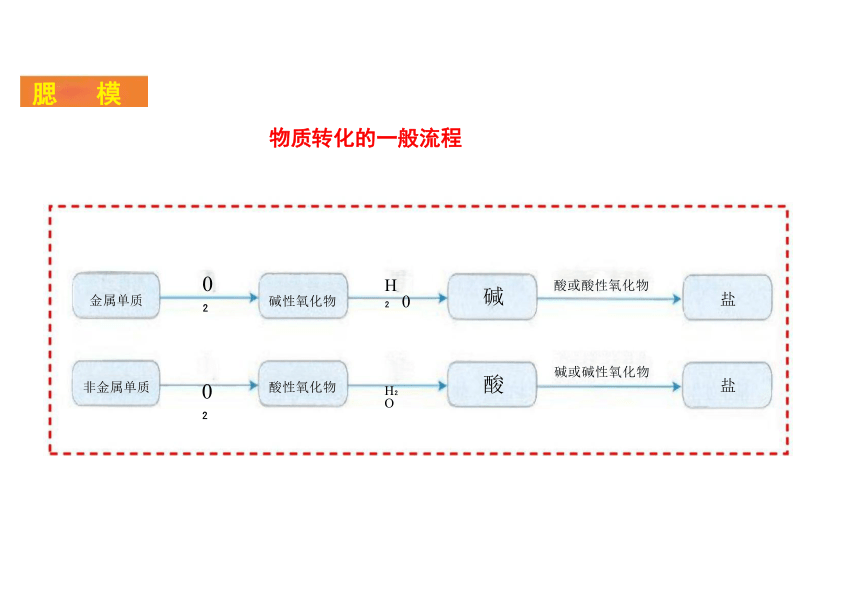
酸或酸性氧化物
碱或碱性氧化物
金属单质
非金属单质
碱性氧化物
酸性氧化物
物质转化的一般流程
腮 模
H 0
H O
碱 酸
盐
盐
0
0
1.单质→盐的转化关系:
①4Na+0 =2Na O
②Na O+H O=2NaOH
③2NaOH+CO =Na CO +H O
⑥SO +H O=H SO
⑦CuO+H SO =CuSO +H O
写出相关化学方程式
2.其他反应:
⑧2Na+S=Na S
⑨Na O+SO =Na SO
⑩Na O+H SO =Na SO +H O
2NaOH+SO =Na SO +H O
2NaOH+H SO =Na SO +H O
32NaOH+CuSO =Cu(OH) J+Na SO
Na CO +H SO =Na SO +CO 个+H O 5Na CO +CuSO =CuCO J+Na SO
写出相关化学方程式
非金属
盐
酸性氧化物
盐和
金属
碱 酸
碱和盐 酸和盐
两种新盐
盐 不 盐
金属
非金属 盐
金属 酸
碱性氧化物 碱
碱 盐
碱 碱性氧化物
酸性氧化物
1.单质、氧化物、酸(或碱)和盐的转化关系
盐 盐
碱性氧化物
盐和 氢气
盐和水
金属
盐
k
(1)金属单质—→碱性氧化物,如:4Na+O ===2Na O
(2)碱性氧化物—→碱,如:CaO+H O===Ca(OH)
(3)金属单质—→盐,如:Zn+H SO ===ZnSO +H 个
(4)碱性氧化物—→盐,如:CaO+2HCl===CaCl +H O
(5)碱—→盐,如:Ca(OH) +2HCl===CaCl +2H O
(6)非金属单质—→酸性氧化物,如:
(7)酸性氧化物—→酸,如:CO +H O===H CO
(8)非金属单质—→盐,如:
(9)酸性氧化物—→盐,如:CO +2NaOH===Na CO +H O
(10)酸—→盐,如:HCl+NaOH===NaCl+H O
(一)六种相互转化关系
①金属+O —→ 碱性氧化物(化合反应)
如:2Mg+0,点 燃
②碱性氧化物+H O— 碱(化合反应)
*只有四种可溶性碱KOH、NaOH、Ca(OH) 、Ba(OH) 对应的碱性氧化 物K O、Na O、CaO、Ba0可直接与水化合生成相应碱,其余不能
如:Na O+H,O= CaO+H,O=
故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH) 是 微溶碱外,其余都易溶。
④非金属+O —→ 酸性氧化物(化合反应)
⑤酸性氧化物+H O → 酸(含氧酸)(化合反应)
*a、除SiO 外,其余酸性氧化物一般都能直接与水化合生成相应酸
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
如:CO +H O H CO SO +H O=H SO
故:酸性氧化物溶于水时得到的都是相应酸的溶液。
③碱— →碱性氧化物+水(分解反应)
a、不溶性碱受热才能发生分解反应
b、反应前后元素的化合价不变(特别注意金属元素的化合价) 如:2Fe(OH) △ 十 o
⑥酸→酸性氧化物+水(分解反应)
*a、仅有含氧酸才能分解
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价) c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)
如:H,SO △ 十
练习:向滴有紫色石蕊试液的水中通入CO, 气体,溶液由 色变为 色;再将此溶 液加热,溶液又由 色变为 色,原因是(用化学方程式表示)
写出下列几种含氧酸的酸酐:
H,SO _HNO H PO H,SO
(二)十个相互反应的关系(表中有四个横向、四个交叉、两个远距离关系,共十个)
⑦碱性氧化物+酸性氧化物 →含氧酸盐(化合反应)
如:CaO+CO,= CaO+SiO,=
⑧碱性氧化物+酸 → 盐+水(复分解反应)
如:CuO+2HCl=CuCl,+
Fe,O +3 H,SO =Fe,(SO ) + 0
●
⑨酸性氧化物+碱 → 盐+水(不是基本反应类型)
*a、参加反应的碱必须可溶
b、注意生成的盐的化学式的书写
如:CO +Ca(OH) = ↓+H O
SO,+2NaOH=Na SO + SiO,+2NaOH = +H O
SO +2NaOH=Na,SO + 0
⑩碱+酸→盐+水(复分解反应)
*酸跟碱作用生成盐和水的反应叫 反应。该反应属于 反应的类型(填基本反应类型)。
如:Cu(OH),+H,SO = +2H 0
NaOH+HCl==NaCl+ 0
练习:凡是有盐和水生成的反应一定是中和反应,这种说法对吗 为什么 试举例说明。
如:CO +Ca(OH) =CaCO J+H O
碱+盐→另一种碱+另一种盐(复分解反应)
*a、参加反应的碱和盐必须都是可溶的
b、必须符合复分解反应发生的条件
c、可溶性碱跟铵盐一定能反应(原因是该反应一定有水和氨气 生成)
如:2NaOH+CuSO==Na,SO + ↓
3NaOH+FeCl ==3NaCl+
Ca(OH),+2NH Cl==CaCl + 十
酸+盐→另一种酸+另一种盐(复分解反应)
*a、只要符合复分解反应发生的条件即可
b 、碳酸盐跟酸一定能反应(原因是该反应一定有水和二氧化碳生成)
如:HCl+AgNO == ↓+HNO
H,SO +BaCl,==BaSO l+
2 HCl+CaCO ==CaCl,+ 十 个
盐+盐→另外两种新盐(复分解反应)
*a、参加反应的两种盐必须都是可溶的
b、符合复分解反应发生的条件
如:NaCl+AgNO = ↓+NaCl
K,SO +BaCl = ↓+2KCl
练习:KNO 、NaNO 一般不能参加复分解反应,原因是
--0
金属+酸→盐+氢气(置换反应)
*a、 这里的酸通常是指盐酸和稀硫酸(硝酸、浓硫酸跟金属反应
一般不产生氢气)
b、只有排在(氢)前面的金属才能置换出酸中的氢
c、铁跟盐酸和稀盐酸反应生成亚铁盐
如:Mg+2HCl= +H 个
Fe+H,SO =FeSO + 个
金属+盐→另一种金属+另一种盐(置换反应)
*a、盐必须是可溶的
b、参加反应的金属必须排在盐中金属的前面
c 、K.Ca.Na 等活泼金属放入盐溶液时,发生的反应有两个,但不能置换出 盐中的金属。如:把钠放入溶液中发生的反应为:
2Na+2H,O==2NaOH+ 个2NaOH+CuSO== J+Na SO d、铁跟盐反应生成的是亚铁盐。
如Fe+CuSO== +Cu Cu+Hg(NO ),==Cu(NO ),+
6金属+非金属→无氧酸盐(化合反应)
*a、这里的非金属不包括氧气
b、活泼金属跟活泼非金属在点燃或加热的条件下一般能反应
如:2Na+Cl
Fe+S
点 燃
①氧化钠与水反应
②碳酸钠与氢氧化钙反应
③电解饱和食盐水等
④盐(如Na CO )与碱[如 CalOH) ,]反应
反应的可能性、原料来源、成本高低、设备要求等方 面来选择物质制备的适宜方法。
2、物质的转化的应用
在工业生产中,除了要考虑反应进行的可能性,还要考虑原料来源、成本和设备 要求等因素,以选取最恰当的方法。
途径(方法)
选择因素
氢氧化钠 的制 备
电解饱和
食盐水
考虑成本
① ② ③
④
A NaCl K SO KCl
(NH ) SO
B Na SO K SO4 KCI
NH Cl
C NaCl K SO4 KCl
NH Cl
D Na SO K SO KCl
(NH ) SO
典 例 1 .奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满
足如图所示中阴影部分关系的是( )
【答案】B【解析】①中此盐既属于钠盐又属于硫酸盐。则可排除A、C两选项,④中
此盐既属于铵盐又属于盐酸盐,则B项中的NH Cl 正确,排除了D 项。
钠盐 钾盐 铵盐
硫酸盐 盐酸盐
课堂练习
课堂小结
酸+碱=盐+水;酸+活泼金属单质=盐+H ; 酸 +碱性
氧化物=盐+水;酸 +某些盐=盐+酸;
2、碱的通性 碱+酸=盐+水;碱+酸性氧化物=盐+水;碱+某些盐=盐+碱;
3、盐的通性 某些盐+酸=盐+酸;某些盐+碱=盐+碱;某些盐+某些盐=盐+盐;
酸或酸性氧化物
4、金属单质到盐 化 应 碱性氧化物 化 应 碱 酸 化物 盐
5、非金属单质到盐 化 应 酸性氧化物 化 应 酸 碱 化物 盐
碱或碱性氧化物
或碱
性氧
O
反
H
合
O
合
单质
非金属
或酸
性氧
O
反
H
合
O
合
单质
金属
1、酸的通性
课堂小结
盐和水
碱 酸
碱和盐 酸和盐
盐和
氢气
盐
非金属
金属
碱性氧化物
碱
碱
盐
酸 碱
盐
碱性氧化物
金属
碱性氧化物
非金属
酸性氧化物
酸性氧化物
盐和 金属
两种新盐
金属
盐
盐
盐
盐
盐
典例2 . 下图中,“—”表示相连的物质间在一定条件下可以反应,“→ ”
表示丁在一定条件下通过置换反应可以转化为乙。下列四组选项中,符合 图示要求的是()
选项 甲 乙 丙
丁
A H SO Na SO NaOH
NaCl
B BaCl K CO HCI
KOH
C O CO CuO
C
D Fe CuCl Zn
HCI
课堂练习
【答案】C
典 例 3 .甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面
有 一 层“绿锈”,该“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO 、
O 作用产生的,化学式为[Cu (OH) CO ], “铜绿”能跟酸反应生成铜盐、CO 和H O。某同学利用以下反应实现了“铜→铜绿→...→铜”的转化。
铜 ①→铜绿 ②→A ③→Cu(OH) ④→B ⑤→Cu
(1)从物质分类标准看,“铜绿”属于 (填字母)。
A. 酸 B.碱 C,盐 D. 氧化物
(2)写出B的化学式;________。
(3)请写出铜绿与盐酸反应的化学方程式:
(4)上述转化过程中属于化合反应的是 ,属于氧化还原反应的是
课堂练习
【答案】(1)C(2)CuO (3)Cu (OH) CO +4HCl—2CuCl +3H O+CO ↑(4①①⑤
【解析】根据题意,铜被腐蚀生成铜绿,铜绿溶于盐酸生成铜盐,然后加碱生成氢氧化铜,氢氧化铜受热
分解生成CuO, 最后氢气还原CuO得到Cu 。(1)“铜绿”是碱式碳酸铜,属于盐。(2)Cu(OH) ④- B 是氢 氧化铜受热分解生成氧化铜和水。(3)依据转化过程,知碱式碳酸铜和盐酸反应,生成氯化铜、水和二氧化 碳。(4)在反应过程中①铜一→铜绿发生了化合反应,也是氧化还原反应;②铜绿—→A 是铜绿跟酸反应生成 铜盐、CO 和 H O,A 为铜盐,是复分解反应;③A—→Cu(OH) 是铜盐和碱反应生成氢氧化铜沉淀,是复 分解反应;④Cu(OH) —→B是氢氧化铜受热分解生成氧化铜和水,是分解反应;⑤B—→Cu是氧化铜和氢 气反应生成铜和水,是置换反应也是氧化还原反应。
课堂练习
(1)请你帮助盐酸走出迷宫(请用“→”把图中物质前的序号连接起来表示所走的路线): 。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有 个,其中能“吃掉”盐酸的盐是 (写化 学式),写出该反应的化学方程式: 0 (3)在不能与盐酸反应的物质中,属于氧化物的 是 (填写物质序号,下同),属于单质的是_ 。 (4)如果将盐酸换成氧气,它能沿着盐酸所走的路线 “走出”这个迷宫吗 为什么
典 例 4 . “探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽
”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
①Zn ⑥Fe.O, ⑦Cu ⑨MgO
加
盐 酸
0
②Na.CO, ⑥NaCI ⑧Ca(OH),②Ag
③CO ④NaOH
H
课堂练习
0D0
5
【答案】(1)③→⑥→⑩→⑦→ → (2)2 Na CO Na CO +2HCl=2NaCl
+H O+CO 个 (3)③⑩ ⑦ (4)不能。因为氧气遇到CO等物质会被
“吃掉”【解析】该题考查盐酸的化学性质。盐酸能与①②④⑤⑧⑨发生反应,与③⑥⑦⑩
不能反应。(1)图中物质③⑥⑩⑦ 均不与盐酸反应,沿该路线可走出迷宫。(2)盐
酸与NaOH、Ca(OH) 的反应属于酸碱中和反应;能“吃掉”盐酸的盐是Na CO ,该反应 的化学方程式为Na CO +2HCl===CO T+H O+2NaCl 。(3)在不能与盐酸反应的物质中, 属于氧化物的是CO 、CO,属于单质的是Cu、Ag。(4)如果将盐酸换成氧气,它不能沿着盐 酸所走的路线“走出”这个迷宫,因为氧气遇到一氧化碳、铜、银等物质时会发生反应而被
“吃掉”。
课堂练习
选项 物质 分类
性质
A Na O 碱性氧化物
与酸反应生成盐和水
B Ca(C1O) 盐
其水溶液与二氧化碳反应生成 HC10
C Na CO 成 叹
与BaCl 溶液反应生成白色沉淀
D H SO 酸
与Ba(OH) 溶液只发生中和反应
【解析】Na O 为过氧化物,与酸反应生成盐、氧气和水,A 项错误;Ca(ClO) 为 盐,次氯酸的酸性弱于碳酸,则其水溶液与二氧化碳反应生成HClO,B 项正确;
Na CO 为盐,C 项错误;H SO 与Ba(OH) 溶液发生中和反应和生成硫酸钡沉淀,D 项错误;答案为B。
1.下列物质的分类以及性质分析正确的是( B )
【解析】铜与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜,硫酸铜溶 液与铁反应生成铜,故A 项不选;二氧化碳发生光合作用生成氧气,氧气与碳反应 可生成一氧化碳,CO 继续燃烧生成CO , 故 B项不选;碳酸钙高温分解生成氧化钙, 氧化钙与水反应生成氢氧化钙,氢氧化钙与CO 反应生成碳酸钙,故C 项不选;D.氢 氧化钠与盐酸反应生成氯化钠,氯化钠不能直接转化生成碳酸钠,故D 项选。故选D。
2.下列各选项中,不能满足如图一步关系选项是( D )
A.X 为铜、Y 为氧化铜、Z 为硫酸铜 B.X 为二氧化碳、
Y氧气、Z 为一氧化碳 C.X 为碳酸钙、Y 氧化 氢氧
化 钙 D.X 为氢氧化钠、Y 氯 化 钠 、Z 为碳酸
3.对于化学反应A+B===C 十D 的下列说法中,正确的是( B
)A. 若生成物C 、D有一种为单质,该反应一定是置换反应B. 若生 成物C 、D分别为两种沉淀,A 、B有可能为盐和碱C. 若生成物C 、D 是盐和水,则A、B 一定是酸和碱D. 若生成物C、D 是两种化合物,
则A、B 一定是化合物
【解析】由反应CO+CuO=CO +Cu 知 ,A 项错误;由反应Ba(OH) +
CuSO ===BaSO J+Cu(OH) J 知 ,B 项正确;由反应CuO+H SO ===CuSO + H O知 ,C 项错误;由反应CH +20 =CO +2H O 知,D 项错误。
【解析】盐酸不与硫酸铜反应,盐酸不能转化为氢氧化钡,氢氧化钡不与氧化铜反 应,故A 不符合题意;盐酸和氢氧化钠、碳酸钾都能反应,和硝酸银反应生成硝酸,
硝酸和氢氧化钠、碳酸钾都能反应,故B符合题意;氯化铁和碳酸钠均为盐,属于相 同类别的化合物,故C 不符合题意;盐酸不能转化为硝酸钡,盐酸不与硫酸反应,氢 氧化钠与硝酸钡不反应,故D 不符合题意;故答案:B。
能转化为另一种物质。若A、B、C 分别属于不同类别的化合物,则A、B、
C 可能是 ( B ) B
4. 构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的
知识网络图:“-”表示相连的两种物质能发生反应,“→”表示一种物质
A.CuO 、Ba(OH) 、CuSO B.NaOH 、HNO 、K CO
C.KOH 、FeCl 、Na CO D.NaOH 、Ba(NO ) 、H SO
HC1
Zn
C
A
1. (2020 ·南京市第十三中学高一月考)下列性质中,不属于碱
的通性的是
A. 能与酸反应生成盐和水
B. 能与酸性氧化物反应生成盐和水
C. 能与某些盐反应生成新碱和新盐
D. 能与金属反应放出氢气
答 案 】D
2. (2020 ·利辛县阚疃金石中学高一期中)下列关系式错误的是
( )
A .酸性氧化物+碱性氧化物→盐
B. 酸+碱性氧化物→盐+H
C. 酸+碱→盐+水
D. 难溶性碱→水+碱性氧化物
答 案 】B
3. (2021 ·北京师范大学珠海分校附属外国语学校高一期中)碳 及其化合物的转化关系:,其中涉及的基本反应类型依次是
A. 化合反应、置换反应、分解反应、复分解反应
B. 置换反应、复分解反应、化合反应、分解反应
C. 置换反应、化合反应、复分解反应、分解反应
D. 置换反应、化合反应、分解反应、复分解反应
答案:C
5. (2020 ·绥滨县第一中学高一期中)如图所列各组物质中,物
质之间按箭头方向不能通过一步反应实现如图所示转化的是
A. 甲为CuO、乙 为CO 、丙为H O
B. 甲为C、乙为CO、丙为CO
C. 甲为CaCO 、乙为CaO、丙为Ca(OH)
D. 甲为H SO 、乙为H O、丙为H
甲 乙 丙
答案:C
第一节物质的分类及转化
第3课时物质的转化
1.通过典型物质的性质,能对酸、碱、盐、氧化物及它们之间反应进行描述和符号表征,培养“宏 观辨识与微观探析”的核心素养。
2 .通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律,培养“变化观 念与模型认知”的核心素养。
1. 通过物质的宏观特征入手理解物质的性质及其转化。
2. 熟悉酸、碱、盐、氧化物间的转化关系。
学习目标
学习目标
素养目标
金属
非金属 盐
金属 酸
碱性氧化物 碱
碱 盐
碱 碱性氧化物
酸性氧化物
物质的转化:根据物质的组成和性质,通过化学变化可以实现物质之间的转化。
物质的转化知识点包括单质、氧化物、酸、碱、盐的性质、物质的转化关系等部分。
盐 盐
盐
酸的主要化学性质 反应实例(写 出化学方程式)
反应类型
酸与活泼金属反应 Fe+H SO =Fe SO +H 个
置换反应
酸与碱性氧化物反应 Fe O +3H SO =Fe (SO ) +3H O
复分解反应
酸与碱反应 Cu(OH) +H SO =CuSO +2H O
复分解反应
酸与某些盐反应 BaCl +H SO =BaSO J+2HCl
复分解反应
指示剂 使紫色石蕊试液变红色,无色酚酞试液不变色
1 .酸:在水溶液里电离的阳离子全部是氢离子的化合物。
酸的通性:
五、酸、碱、盐的性质
①酸+活泼金属→盐十氢气(置换反应)
Fe+H SO =FeSO +H 个
②酸十碱性氧化物→盐十水(复分解反应)
Fe O +3H SO =Fe (SO ) +3H O
③酸+碱 →盐+水(中和反应) (复分解反应)
Cu(OH) +H SO =CuSO +2H O
④酸+盐→另一酸+另一盐(复分解反应)
BaCl +H SO =BaSO ↓+2HCl
⑤酸使石蕊溶液变红,使酚酞溶液不变色,使甲基橙溶液变红
碱的主要化学性质 反应实例(写出化学方程式)
反应类型
指示剂 使紫色石蕊试液变蓝色,无色酚 酞试液变红色
与酸反应 NaOH+HCl=NaCl+H O
复分解反应
与酸性氧化物反应 CO +2NaOH=Na CO +H O
与某些盐 2NaOH+CuSO =Cu(OH) J+Na SO
复分解反应
2.碱:在水溶液里电离的阴离子全部是氢氧根离子的化合物
碱的通性:
①碱+酸性氧化物 → 盐+水
NaOH+HCl=NaCl+H O
②碱+酸 →盐+水(复分解反应)(中和反应)
CO +2NaOH=Na CO +H O
③碱+盐 → 另一碱+另一盐(复分解反应)
2NaOH+CuSO =Cu(OH) J+Na SO
④碱使石蕊溶液变蓝、酚酞变红、甲基橙变黄
盐的主要化学 性质 反应实例(写出化学方程式)
反应类型
与金属反应 Fe+CuSO =Cu+FeSO
置换反应
与酸反应 CaCO +2HCl=CaCl +H O+CO 个
复分解反应
与碱反应 2NaOH+CuSO =Cu(OH) J+Na SO
复分解反应
与盐反应 NaCl+AgNO =AgClJ+NaNO
复分解反应
3.盐:在水溶液中电离出的阳离子全部是金属阳离子或者是铵根离子,阴离子
全部是酸根离子的化合物
盐的通性:
①盐+金属 → 另一盐+另一金属(置换反应)
Fe +CuSO =Cu+FeSO
②盐+酸 → 另一盐+另一酸(复分解反应)
CaCO +2HCl=CaCl +H O+CO 个
③盐+碱 → 另一盐+另一碱(复分解反应)
2NaOH+CuSO =Cu(OH) J+Na SO
④盐+盐 → 另两种盐(复分解反应)
NaCl+AgNO =AgClJ+NaNO
思考与讨论
(1)写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属单质 到盐的转化关系。
Ca→CaO→Ca(OH) →CaSO
C→CO →H CO →CaCO
(2)对于上述转化关系,从物质分类的角度看,你发现了什么规律 将你的想 法与同学交流。
六、物质的转化
金属 碱性氧化物 化合反应 化合反应 Ca CaO 碱 Ca(OH)
盐
复分解反应
CaSO
O H O
H SO
非金属 酸性氧化物 化合反应 化合反应 CO O H O 酸 H CO
盐
复分解反应
CaCO
Ca(OH)
C
酸或酸性氧化物
碱或碱性氧化物
金属单质
非金属单质
碱性氧化物
酸性氧化物
物质转化的一般流程
腮 模
H 0
H O
碱 酸
盐
盐
0
0
1.单质→盐的转化关系:
①4Na+0 =2Na O
②Na O+H O=2NaOH
③2NaOH+CO =Na CO +H O
⑥SO +H O=H SO
⑦CuO+H SO =CuSO +H O
写出相关化学方程式
2.其他反应:
⑧2Na+S=Na S
⑨Na O+SO =Na SO
⑩Na O+H SO =Na SO +H O
2NaOH+SO =Na SO +H O
2NaOH+H SO =Na SO +H O
32NaOH+CuSO =Cu(OH) J+Na SO
Na CO +H SO =Na SO +CO 个+H O 5Na CO +CuSO =CuCO J+Na SO
写出相关化学方程式
非金属
盐
酸性氧化物
盐和
金属
碱 酸
碱和盐 酸和盐
两种新盐
盐 不 盐
金属
非金属 盐
金属 酸
碱性氧化物 碱
碱 盐
碱 碱性氧化物
酸性氧化物
1.单质、氧化物、酸(或碱)和盐的转化关系
盐 盐
碱性氧化物
盐和 氢气
盐和水
金属
盐
k
(1)金属单质—→碱性氧化物,如:4Na+O ===2Na O
(2)碱性氧化物—→碱,如:CaO+H O===Ca(OH)
(3)金属单质—→盐,如:Zn+H SO ===ZnSO +H 个
(4)碱性氧化物—→盐,如:CaO+2HCl===CaCl +H O
(5)碱—→盐,如:Ca(OH) +2HCl===CaCl +2H O
(6)非金属单质—→酸性氧化物,如:
(7)酸性氧化物—→酸,如:CO +H O===H CO
(8)非金属单质—→盐,如:
(9)酸性氧化物—→盐,如:CO +2NaOH===Na CO +H O
(10)酸—→盐,如:HCl+NaOH===NaCl+H O
(一)六种相互转化关系
①金属+O —→ 碱性氧化物(化合反应)
如:2Mg+0,点 燃
②碱性氧化物+H O— 碱(化合反应)
*只有四种可溶性碱KOH、NaOH、Ca(OH) 、Ba(OH) 对应的碱性氧化 物K O、Na O、CaO、Ba0可直接与水化合生成相应碱,其余不能
如:Na O+H,O= CaO+H,O=
故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除Ca(OH) 是 微溶碱外,其余都易溶。
④非金属+O —→ 酸性氧化物(化合反应)
⑤酸性氧化物+H O → 酸(含氧酸)(化合反应)
*a、除SiO 外,其余酸性氧化物一般都能直接与水化合生成相应酸
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价)
如:CO +H O H CO SO +H O=H SO
故:酸性氧化物溶于水时得到的都是相应酸的溶液。
③碱— →碱性氧化物+水(分解反应)
a、不溶性碱受热才能发生分解反应
b、反应前后元素的化合价不变(特别注意金属元素的化合价) 如:2Fe(OH) △ 十 o
⑥酸→酸性氧化物+水(分解反应)
*a、仅有含氧酸才能分解
b、反应前后元素的化合价一定不变(特别注意除氢、氧外的非金属元素的化合价) c、酸性氧化物又叫酸酐(原因是:酸性氧化物可看作是含氧酸脱水的产物)
如:H,SO △ 十
练习:向滴有紫色石蕊试液的水中通入CO, 气体,溶液由 色变为 色;再将此溶 液加热,溶液又由 色变为 色,原因是(用化学方程式表示)
写出下列几种含氧酸的酸酐:
H,SO _HNO H PO H,SO
(二)十个相互反应的关系(表中有四个横向、四个交叉、两个远距离关系,共十个)
⑦碱性氧化物+酸性氧化物 →含氧酸盐(化合反应)
如:CaO+CO,= CaO+SiO,=
⑧碱性氧化物+酸 → 盐+水(复分解反应)
如:CuO+2HCl=CuCl,+
Fe,O +3 H,SO =Fe,(SO ) + 0
●
⑨酸性氧化物+碱 → 盐+水(不是基本反应类型)
*a、参加反应的碱必须可溶
b、注意生成的盐的化学式的书写
如:CO +Ca(OH) = ↓+H O
SO,+2NaOH=Na SO + SiO,+2NaOH = +H O
SO +2NaOH=Na,SO + 0
⑩碱+酸→盐+水(复分解反应)
*酸跟碱作用生成盐和水的反应叫 反应。该反应属于 反应的类型(填基本反应类型)。
如:Cu(OH),+H,SO = +2H 0
NaOH+HCl==NaCl+ 0
练习:凡是有盐和水生成的反应一定是中和反应,这种说法对吗 为什么 试举例说明。
如:CO +Ca(OH) =CaCO J+H O
碱+盐→另一种碱+另一种盐(复分解反应)
*a、参加反应的碱和盐必须都是可溶的
b、必须符合复分解反应发生的条件
c、可溶性碱跟铵盐一定能反应(原因是该反应一定有水和氨气 生成)
如:2NaOH+CuSO==Na,SO + ↓
3NaOH+FeCl ==3NaCl+
Ca(OH),+2NH Cl==CaCl + 十
酸+盐→另一种酸+另一种盐(复分解反应)
*a、只要符合复分解反应发生的条件即可
b 、碳酸盐跟酸一定能反应(原因是该反应一定有水和二氧化碳生成)
如:HCl+AgNO == ↓+HNO
H,SO +BaCl,==BaSO l+
2 HCl+CaCO ==CaCl,+ 十 个
盐+盐→另外两种新盐(复分解反应)
*a、参加反应的两种盐必须都是可溶的
b、符合复分解反应发生的条件
如:NaCl+AgNO = ↓+NaCl
K,SO +BaCl = ↓+2KCl
练习:KNO 、NaNO 一般不能参加复分解反应,原因是
--0
金属+酸→盐+氢气(置换反应)
*a、 这里的酸通常是指盐酸和稀硫酸(硝酸、浓硫酸跟金属反应
一般不产生氢气)
b、只有排在(氢)前面的金属才能置换出酸中的氢
c、铁跟盐酸和稀盐酸反应生成亚铁盐
如:Mg+2HCl= +H 个
Fe+H,SO =FeSO + 个
金属+盐→另一种金属+另一种盐(置换反应)
*a、盐必须是可溶的
b、参加反应的金属必须排在盐中金属的前面
c 、K.Ca.Na 等活泼金属放入盐溶液时,发生的反应有两个,但不能置换出 盐中的金属。如:把钠放入溶液中发生的反应为:
2Na+2H,O==2NaOH+ 个2NaOH+CuSO== J+Na SO d、铁跟盐反应生成的是亚铁盐。
如Fe+CuSO== +Cu Cu+Hg(NO ),==Cu(NO ),+
6金属+非金属→无氧酸盐(化合反应)
*a、这里的非金属不包括氧气
b、活泼金属跟活泼非金属在点燃或加热的条件下一般能反应
如:2Na+Cl
Fe+S
点 燃
①氧化钠与水反应
②碳酸钠与氢氧化钙反应
③电解饱和食盐水等
④盐(如Na CO )与碱[如 CalOH) ,]反应
反应的可能性、原料来源、成本高低、设备要求等方 面来选择物质制备的适宜方法。
2、物质的转化的应用
在工业生产中,除了要考虑反应进行的可能性,还要考虑原料来源、成本和设备 要求等因素,以选取最恰当的方法。
途径(方法)
选择因素
氢氧化钠 的制 备
电解饱和
食盐水
考虑成本
① ② ③
④
A NaCl K SO KCl
(NH ) SO
B Na SO K SO4 KCI
NH Cl
C NaCl K SO4 KCl
NH Cl
D Na SO K SO KCl
(NH ) SO
典 例 1 .奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满
足如图所示中阴影部分关系的是( )
【答案】B【解析】①中此盐既属于钠盐又属于硫酸盐。则可排除A、C两选项,④中
此盐既属于铵盐又属于盐酸盐,则B项中的NH Cl 正确,排除了D 项。
钠盐 钾盐 铵盐
硫酸盐 盐酸盐
课堂练习
课堂小结
酸+碱=盐+水;酸+活泼金属单质=盐+H ; 酸 +碱性
氧化物=盐+水;酸 +某些盐=盐+酸;
2、碱的通性 碱+酸=盐+水;碱+酸性氧化物=盐+水;碱+某些盐=盐+碱;
3、盐的通性 某些盐+酸=盐+酸;某些盐+碱=盐+碱;某些盐+某些盐=盐+盐;
酸或酸性氧化物
4、金属单质到盐 化 应 碱性氧化物 化 应 碱 酸 化物 盐
5、非金属单质到盐 化 应 酸性氧化物 化 应 酸 碱 化物 盐
碱或碱性氧化物
或碱
性氧
O
反
H
合
O
合
单质
非金属
或酸
性氧
O
反
H
合
O
合
单质
金属
1、酸的通性
课堂小结
盐和水
碱 酸
碱和盐 酸和盐
盐和
氢气
盐
非金属
金属
碱性氧化物
碱
碱
盐
酸 碱
盐
碱性氧化物
金属
碱性氧化物
非金属
酸性氧化物
酸性氧化物
盐和 金属
两种新盐
金属
盐
盐
盐
盐
盐
典例2 . 下图中,“—”表示相连的物质间在一定条件下可以反应,“→ ”
表示丁在一定条件下通过置换反应可以转化为乙。下列四组选项中,符合 图示要求的是()
选项 甲 乙 丙
丁
A H SO Na SO NaOH
NaCl
B BaCl K CO HCI
KOH
C O CO CuO
C
D Fe CuCl Zn
HCI
课堂练习
【答案】C
典 例 3 .甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面
有 一 层“绿锈”,该“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO 、
O 作用产生的,化学式为[Cu (OH) CO ], “铜绿”能跟酸反应生成铜盐、CO 和H O。某同学利用以下反应实现了“铜→铜绿→...→铜”的转化。
铜 ①→铜绿 ②→A ③→Cu(OH) ④→B ⑤→Cu
(1)从物质分类标准看,“铜绿”属于 (填字母)。
A. 酸 B.碱 C,盐 D. 氧化物
(2)写出B的化学式;________。
(3)请写出铜绿与盐酸反应的化学方程式:
(4)上述转化过程中属于化合反应的是 ,属于氧化还原反应的是
课堂练习
【答案】(1)C(2)CuO (3)Cu (OH) CO +4HCl—2CuCl +3H O+CO ↑(4①①⑤
【解析】根据题意,铜被腐蚀生成铜绿,铜绿溶于盐酸生成铜盐,然后加碱生成氢氧化铜,氢氧化铜受热
分解生成CuO, 最后氢气还原CuO得到Cu 。(1)“铜绿”是碱式碳酸铜,属于盐。(2)Cu(OH) ④- B 是氢 氧化铜受热分解生成氧化铜和水。(3)依据转化过程,知碱式碳酸铜和盐酸反应,生成氯化铜、水和二氧化 碳。(4)在反应过程中①铜一→铜绿发生了化合反应,也是氧化还原反应;②铜绿—→A 是铜绿跟酸反应生成 铜盐、CO 和 H O,A 为铜盐,是复分解反应;③A—→Cu(OH) 是铜盐和碱反应生成氢氧化铜沉淀,是复 分解反应;④Cu(OH) —→B是氢氧化铜受热分解生成氧化铜和水,是分解反应;⑤B—→Cu是氧化铜和氢 气反应生成铜和水,是置换反应也是氧化还原反应。
课堂练习
(1)请你帮助盐酸走出迷宫(请用“→”把图中物质前的序号连接起来表示所走的路线): 。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有 个,其中能“吃掉”盐酸的盐是 (写化 学式),写出该反应的化学方程式: 0 (3)在不能与盐酸反应的物质中,属于氧化物的 是 (填写物质序号,下同),属于单质的是_ 。 (4)如果将盐酸换成氧气,它能沿着盐酸所走的路线 “走出”这个迷宫吗 为什么
典 例 4 . “探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽
”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
①Zn ⑥Fe.O, ⑦Cu ⑨MgO
加
盐 酸
0
②Na.CO, ⑥NaCI ⑧Ca(OH),②Ag
③CO ④NaOH
H
课堂练习
0D0
5
【答案】(1)③→⑥→⑩→⑦→ → (2)2 Na CO Na CO +2HCl=2NaCl
+H O+CO 个 (3)③⑩ ⑦ (4)不能。因为氧气遇到CO等物质会被
“吃掉”【解析】该题考查盐酸的化学性质。盐酸能与①②④⑤⑧⑨发生反应,与③⑥⑦⑩
不能反应。(1)图中物质③⑥⑩⑦ 均不与盐酸反应,沿该路线可走出迷宫。(2)盐
酸与NaOH、Ca(OH) 的反应属于酸碱中和反应;能“吃掉”盐酸的盐是Na CO ,该反应 的化学方程式为Na CO +2HCl===CO T+H O+2NaCl 。(3)在不能与盐酸反应的物质中, 属于氧化物的是CO 、CO,属于单质的是Cu、Ag。(4)如果将盐酸换成氧气,它不能沿着盐 酸所走的路线“走出”这个迷宫,因为氧气遇到一氧化碳、铜、银等物质时会发生反应而被
“吃掉”。
课堂练习
选项 物质 分类
性质
A Na O 碱性氧化物
与酸反应生成盐和水
B Ca(C1O) 盐
其水溶液与二氧化碳反应生成 HC10
C Na CO 成 叹
与BaCl 溶液反应生成白色沉淀
D H SO 酸
与Ba(OH) 溶液只发生中和反应
【解析】Na O 为过氧化物,与酸反应生成盐、氧气和水,A 项错误;Ca(ClO) 为 盐,次氯酸的酸性弱于碳酸,则其水溶液与二氧化碳反应生成HClO,B 项正确;
Na CO 为盐,C 项错误;H SO 与Ba(OH) 溶液发生中和反应和生成硫酸钡沉淀,D 项错误;答案为B。
1.下列物质的分类以及性质分析正确的是( B )
【解析】铜与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜,硫酸铜溶 液与铁反应生成铜,故A 项不选;二氧化碳发生光合作用生成氧气,氧气与碳反应 可生成一氧化碳,CO 继续燃烧生成CO , 故 B项不选;碳酸钙高温分解生成氧化钙, 氧化钙与水反应生成氢氧化钙,氢氧化钙与CO 反应生成碳酸钙,故C 项不选;D.氢 氧化钠与盐酸反应生成氯化钠,氯化钠不能直接转化生成碳酸钠,故D 项选。故选D。
2.下列各选项中,不能满足如图一步关系选项是( D )
A.X 为铜、Y 为氧化铜、Z 为硫酸铜 B.X 为二氧化碳、
Y氧气、Z 为一氧化碳 C.X 为碳酸钙、Y 氧化 氢氧
化 钙 D.X 为氢氧化钠、Y 氯 化 钠 、Z 为碳酸
3.对于化学反应A+B===C 十D 的下列说法中,正确的是( B
)A. 若生成物C 、D有一种为单质,该反应一定是置换反应B. 若生 成物C 、D分别为两种沉淀,A 、B有可能为盐和碱C. 若生成物C 、D 是盐和水,则A、B 一定是酸和碱D. 若生成物C、D 是两种化合物,
则A、B 一定是化合物
【解析】由反应CO+CuO=CO +Cu 知 ,A 项错误;由反应Ba(OH) +
CuSO ===BaSO J+Cu(OH) J 知 ,B 项正确;由反应CuO+H SO ===CuSO + H O知 ,C 项错误;由反应CH +20 =CO +2H O 知,D 项错误。
【解析】盐酸不与硫酸铜反应,盐酸不能转化为氢氧化钡,氢氧化钡不与氧化铜反 应,故A 不符合题意;盐酸和氢氧化钠、碳酸钾都能反应,和硝酸银反应生成硝酸,
硝酸和氢氧化钠、碳酸钾都能反应,故B符合题意;氯化铁和碳酸钠均为盐,属于相 同类别的化合物,故C 不符合题意;盐酸不能转化为硝酸钡,盐酸不与硫酸反应,氢 氧化钠与硝酸钡不反应,故D 不符合题意;故答案:B。
能转化为另一种物质。若A、B、C 分别属于不同类别的化合物,则A、B、
C 可能是 ( B ) B
4. 构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的
知识网络图:“-”表示相连的两种物质能发生反应,“→”表示一种物质
A.CuO 、Ba(OH) 、CuSO B.NaOH 、HNO 、K CO
C.KOH 、FeCl 、Na CO D.NaOH 、Ba(NO ) 、H SO
HC1
Zn
C
A
1. (2020 ·南京市第十三中学高一月考)下列性质中,不属于碱
的通性的是
A. 能与酸反应生成盐和水
B. 能与酸性氧化物反应生成盐和水
C. 能与某些盐反应生成新碱和新盐
D. 能与金属反应放出氢气
答 案 】D
2. (2020 ·利辛县阚疃金石中学高一期中)下列关系式错误的是
( )
A .酸性氧化物+碱性氧化物→盐
B. 酸+碱性氧化物→盐+H
C. 酸+碱→盐+水
D. 难溶性碱→水+碱性氧化物
答 案 】B
3. (2021 ·北京师范大学珠海分校附属外国语学校高一期中)碳 及其化合物的转化关系:,其中涉及的基本反应类型依次是
A. 化合反应、置换反应、分解反应、复分解反应
B. 置换反应、复分解反应、化合反应、分解反应
C. 置换反应、化合反应、复分解反应、分解反应
D. 置换反应、化合反应、分解反应、复分解反应
答案:C
5. (2020 ·绥滨县第一中学高一期中)如图所列各组物质中,物
质之间按箭头方向不能通过一步反应实现如图所示转化的是
A. 甲为CuO、乙 为CO 、丙为H O
B. 甲为C、乙为CO、丙为CO
C. 甲为CaCO 、乙为CaO、丙为Ca(OH)
D. 甲为H SO 、乙为H O、丙为H
甲 乙 丙
答案:C
