3.2金属材料--高一上学期化学人教版(2019)必修第一册(共25张PPT)
文档属性
| 名称 | 3.2金属材料--高一上学期化学人教版(2019)必修第一册(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:28:03 | ||
图片预览






文档简介
(共25张PPT)
第二节金属材料课时 一
人教版 ·高中化学 ·必修1
1.变化观念:
了解合金定义及性质、知道合金性质与金属性质不同的原因.
感受超级钢的研究前景,了解储氢合金树立自豪感及责任感。 知道铝及铝合金既能与酸反应,又能与碱反应。
2.科 学 探 究 :探究铝合金与酸和碱的反应情况。 能够根据生产、生活需求选择适合的合金.
核心素养
纯金属 80多种
金属材料
合金 数千种
一、合金的定义及性能
1.合金的定义
合金是由两种或两种以上的 熔合而成的 具有_ 金属 特性的物质。
2.合金与纯金属的性能差异
(1)合金的硬度比其成分金属大,机械性能一般 优于 各成分金
属。
(2)合金的熔点一般_ 低于 它的各成分金属。
(3)合金具有各成分金属的 化学性质 合金一定是 混合物
金 属 特性
(4)合金具有 ,如:导热性、导电性和延展性。
金属(或金属和非金属)
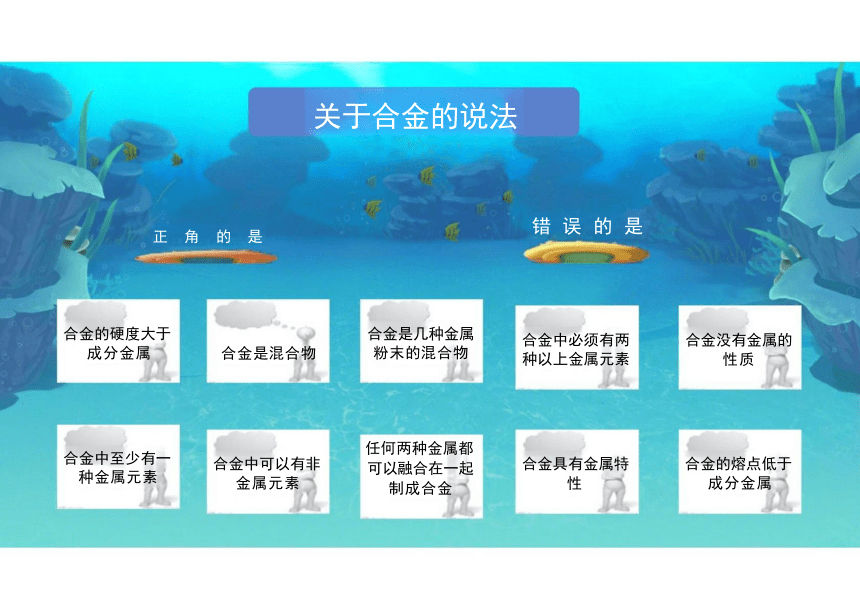
合金是几种金属 粉末的混合物
任何两种金属都
可以融合在一起
制成合金
合金的硬度大于 成分金属
合金中至少有一 种金属元素
合金中必须有两 种以上金属元素
合金具有金属特 性
合金没有金属的 性质
合金的熔点低于 成分金属
合金是混合物
合金中可以有非 金属元素
关于合金的说法
错 误 的 是
正 角 的 是
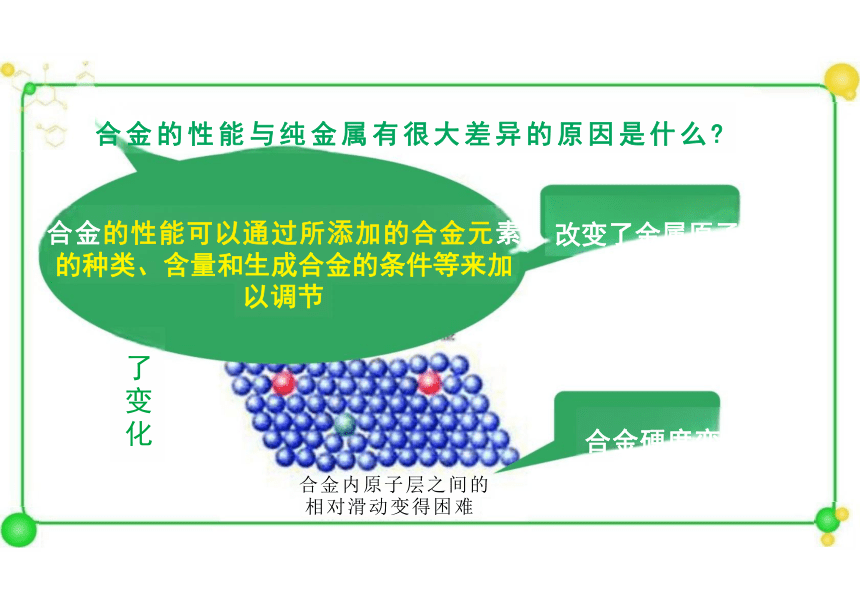
合金的性能与纯金属有很大差异的原因是什么
合金的性能可以通过所添加的合金元素
的种类、含量和生成合金的条件等来加 以调节
合金内原子层之间的 相对滑动变得困难
改变了金属原子
合金硬度变
了变化
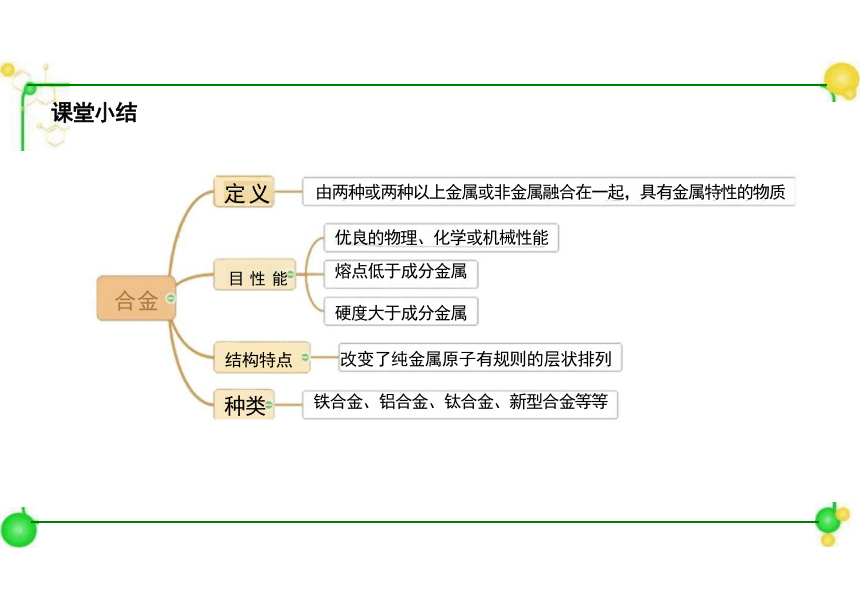
由两种或两种以上金属或非金属融合在一起,具有金属特性的物质
优良的物理、化学或机械性能
熔点低于成分金属
硬度大于成分金属
结构特点 改变了纯金属原子有规则的层状排列
种类 铁合金、铝合金、钛合金、新型合金等等
定义
目 性 能
课堂小结
合金
生铁
四 生铁铁锅
四 生铁拼装台
四 生铁铸件
低碳钢
(含碳量低于0.3%)
中碳钢
(含碳量0.3%--0.6%)
高碳钢
0
(含碳量高于0.6%)
不锈钢 自 超级钢
1 、铁合金
铁合金。
钢
碳素钢
合金钢
(特种钢)
钢
0
将产品拖拽到主要成分中
高硕钢 中碳钢 低碳钢 生铁
合金元素
主要作用
铬(Cr)
增加耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐磨性等
锰 ( M n )
防止硫引起的脆性;增强钢的强度和韧性
钼 ( M o )
降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
钨(W)
提高高温时的强度和硬度;增强工具钢的耐磨性
钴 ( C o )
提高红热时的硬度和耐磨性;用于制造磁性合金
镍 ( N i )
增强低温时的韧性;改变高铬钢的内部结构等
硅(Si)
提高低合金钢的强度和硬度;增强高温时的抗氧化性等
钢中合金元素的主要作用
思考与讨论
在碳素钢中,由于含碳量不同性能有很大差异
向碳素钢中加入不同的合金元素,可制的不同性能的合金钢。
这对你有咖些启示
密度小
优点
(2) 铝合金
科技前沿 中国制造.
常加入的合金元素
铜、镁、硅、锰、锌及稀土元素
成分:铜、镁、锰、硅
硬铝 四硬铝
镁铝合金
储氢合金中
作为能源的实际应用起到推动作用
新型合金 钛合金 耐热合金
应用于航空航天、生物工程、电子工业
形状记忆合金
3 、新型合金
定义
储氢合金粉
优点
记忆原理
记忆合金..
应用
四记忆合金… 形状记忆... 形状记忆 四形状记忆...
储氢合金
形状记忆合金
应用
日 储氢合金.
四 储氢罐
储氢原理
四 储氢合金1
储氢合金2
钛合金O
应用广泛
四 蛟龙号耐压球..
钛合金耐压球
四 钛台金耐压球.
日钛合金拷瓷牙
钛合金
特点
四钛合金
“亚洲第一环”
直径为5米的铝
合金特大环
铝及其合金的应用已经渗透
到我们生活的方方面面。下 面让我们一起去探讨和学习 铝的相关性质。
铝合金门窗材料
神七的铝制“外衣”
推测在一定条件下金属铝
可能具有的性质
与氯化镁溶 与氧化镁反
液反应
与氢氧化钠 溶液反应
与硫酸铜溶 液反应
与氧化铁反
铝原子结构示意图为 3,
原性。
1) 铝与氧气反应
铝的化学性质活泼,在空气中放置或加热条件下容易被氧气氧化为氧化铝,化学反应方程式为:
现象:铝箔熔化,失去光泽,但熔化的铝并不滴落。
解释:铝箔加热时与O 发生反应生成熔点很高的Al O 薄膜,而Al O 有着很高的熔点,使内部的铝被Al O 3包裹着,所以熔化的铝不易滴下。
除O 外,Cl 、S、Br 、I 等许多非金属单质也能在一定条件下与Al反应。
铝及铝合金
1、铝
2Al+6HCl=2AlCl +3H 个
2Al+6H+=2AI ++3H 个
(3)、写出铝和氢氧化钠溶液反应的方程式及离子反应
2Al+2NaOH+2H O=2NaAlO +3H 个
2Al+2OH~+2H O=2A1O -+3H 个
( 2) 、铝能和盐酸反应,写出化学方程式及离子反应方程式
A1, 。o 高温 10 O
2Al+Fe2O3 Al,03+ZFe
(5)铝与盐溶液发生置换反应
(4)、高温下铝与金属氧化物反应铝热反应
2、氧化铝
推测氧化铝可能具有的性质是
回收站 是碱性氧化物 是酸性氧化物 与水反应
与盐酸反应 与氢氧化钠溶液反应
可能具有的性质
铝的氧化物
氧化铝 (Al O ) 俗称:刚玉,宝石
(1)Al O 的物理性质
难溶于水、熔点很高,可做耐火材料。
(2)Al O 的两性
① 与酸反应: Al O +6HCl=2AlCl +3H O Al O +6H+=2Al ++3H O
Al O +2OH-=2AlO -+H O
②与碱反应: Al O +2NaOH=2NaA1O +H O
重点提示
Al O 只能与强酸、强碱发生化学反应。像Al O 这样既能与酸反应生成盐和水,又能 与碱反应生成盐和水的氧化物,称为两性氧化物。
写出图中有关反应的化学方程式或离子方程式:
① Al(OH) +3HCl=AlCl +3H O Al(OH) +3H+===Al ++3H O
②Al(OH) +NaOH=NaAlO + 2H O_ Al(OH) +OH-==A1O +2H O
③
4、氢氧化铝
(1)物理性质
白色胶状不溶于水的固体,有较强的吸附性。
(2)化学性质(用化学方程式表示)
Al O ③ Al(OH) ②强碱
受热分解 两性
Al +
AlO2
①强酸
铝、氧化铝和氢氧化铝均能与酸、碱反应,因此
铝制餐具不宜用来蒸煮或长时间存放酸性或碱性
食物
思考
目我国储量及开采
四稀土矿
尖端应用 冶金工业的维生素
稀土金属应用
17种元素
日 稀土金属
回 稀土金属在.
稀土金属
镝 镧系金属镝
稀土元素
谢谢
第二节金属材料课时 一
人教版 ·高中化学 ·必修1
1.变化观念:
了解合金定义及性质、知道合金性质与金属性质不同的原因.
感受超级钢的研究前景,了解储氢合金树立自豪感及责任感。 知道铝及铝合金既能与酸反应,又能与碱反应。
2.科 学 探 究 :探究铝合金与酸和碱的反应情况。 能够根据生产、生活需求选择适合的合金.
核心素养
纯金属 80多种
金属材料
合金 数千种
一、合金的定义及性能
1.合金的定义
合金是由两种或两种以上的 熔合而成的 具有_ 金属 特性的物质。
2.合金与纯金属的性能差异
(1)合金的硬度比其成分金属大,机械性能一般 优于 各成分金
属。
(2)合金的熔点一般_ 低于 它的各成分金属。
(3)合金具有各成分金属的 化学性质 合金一定是 混合物
金 属 特性
(4)合金具有 ,如:导热性、导电性和延展性。
金属(或金属和非金属)
合金是几种金属 粉末的混合物
任何两种金属都
可以融合在一起
制成合金
合金的硬度大于 成分金属
合金中至少有一 种金属元素
合金中必须有两 种以上金属元素
合金具有金属特 性
合金没有金属的 性质
合金的熔点低于 成分金属
合金是混合物
合金中可以有非 金属元素
关于合金的说法
错 误 的 是
正 角 的 是
合金的性能与纯金属有很大差异的原因是什么
合金的性能可以通过所添加的合金元素
的种类、含量和生成合金的条件等来加 以调节
合金内原子层之间的 相对滑动变得困难
改变了金属原子
合金硬度变
了变化
由两种或两种以上金属或非金属融合在一起,具有金属特性的物质
优良的物理、化学或机械性能
熔点低于成分金属
硬度大于成分金属
结构特点 改变了纯金属原子有规则的层状排列
种类 铁合金、铝合金、钛合金、新型合金等等
定义
目 性 能
课堂小结
合金
生铁
四 生铁铁锅
四 生铁拼装台
四 生铁铸件
低碳钢
(含碳量低于0.3%)
中碳钢
(含碳量0.3%--0.6%)
高碳钢
0
(含碳量高于0.6%)
不锈钢 自 超级钢
1 、铁合金
铁合金。
钢
碳素钢
合金钢
(特种钢)
钢
0
将产品拖拽到主要成分中
高硕钢 中碳钢 低碳钢 生铁
合金元素
主要作用
铬(Cr)
增加耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐磨性等
锰 ( M n )
防止硫引起的脆性;增强钢的强度和韧性
钼 ( M o )
降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
钨(W)
提高高温时的强度和硬度;增强工具钢的耐磨性
钴 ( C o )
提高红热时的硬度和耐磨性;用于制造磁性合金
镍 ( N i )
增强低温时的韧性;改变高铬钢的内部结构等
硅(Si)
提高低合金钢的强度和硬度;增强高温时的抗氧化性等
钢中合金元素的主要作用
思考与讨论
在碳素钢中,由于含碳量不同性能有很大差异
向碳素钢中加入不同的合金元素,可制的不同性能的合金钢。
这对你有咖些启示
密度小
优点
(2) 铝合金
科技前沿 中国制造.
常加入的合金元素
铜、镁、硅、锰、锌及稀土元素
成分:铜、镁、锰、硅
硬铝 四硬铝
镁铝合金
储氢合金中
作为能源的实际应用起到推动作用
新型合金 钛合金 耐热合金
应用于航空航天、生物工程、电子工业
形状记忆合金
3 、新型合金
定义
储氢合金粉
优点
记忆原理
记忆合金..
应用
四记忆合金… 形状记忆... 形状记忆 四形状记忆...
储氢合金
形状记忆合金
应用
日 储氢合金.
四 储氢罐
储氢原理
四 储氢合金1
储氢合金2
钛合金O
应用广泛
四 蛟龙号耐压球..
钛合金耐压球
四 钛台金耐压球.
日钛合金拷瓷牙
钛合金
特点
四钛合金
“亚洲第一环”
直径为5米的铝
合金特大环
铝及其合金的应用已经渗透
到我们生活的方方面面。下 面让我们一起去探讨和学习 铝的相关性质。
铝合金门窗材料
神七的铝制“外衣”
推测在一定条件下金属铝
可能具有的性质
与氯化镁溶 与氧化镁反
液反应
与氢氧化钠 溶液反应
与硫酸铜溶 液反应
与氧化铁反
铝原子结构示意图为 3,
原性。
1) 铝与氧气反应
铝的化学性质活泼,在空气中放置或加热条件下容易被氧气氧化为氧化铝,化学反应方程式为:
现象:铝箔熔化,失去光泽,但熔化的铝并不滴落。
解释:铝箔加热时与O 发生反应生成熔点很高的Al O 薄膜,而Al O 有着很高的熔点,使内部的铝被Al O 3包裹着,所以熔化的铝不易滴下。
除O 外,Cl 、S、Br 、I 等许多非金属单质也能在一定条件下与Al反应。
铝及铝合金
1、铝
2Al+6HCl=2AlCl +3H 个
2Al+6H+=2AI ++3H 个
(3)、写出铝和氢氧化钠溶液反应的方程式及离子反应
2Al+2NaOH+2H O=2NaAlO +3H 个
2Al+2OH~+2H O=2A1O -+3H 个
( 2) 、铝能和盐酸反应,写出化学方程式及离子反应方程式
A1, 。o 高温 10 O
2Al+Fe2O3 Al,03+ZFe
(5)铝与盐溶液发生置换反应
(4)、高温下铝与金属氧化物反应铝热反应
2、氧化铝
推测氧化铝可能具有的性质是
回收站 是碱性氧化物 是酸性氧化物 与水反应
与盐酸反应 与氢氧化钠溶液反应
可能具有的性质
铝的氧化物
氧化铝 (Al O ) 俗称:刚玉,宝石
(1)Al O 的物理性质
难溶于水、熔点很高,可做耐火材料。
(2)Al O 的两性
① 与酸反应: Al O +6HCl=2AlCl +3H O Al O +6H+=2Al ++3H O
Al O +2OH-=2AlO -+H O
②与碱反应: Al O +2NaOH=2NaA1O +H O
重点提示
Al O 只能与强酸、强碱发生化学反应。像Al O 这样既能与酸反应生成盐和水,又能 与碱反应生成盐和水的氧化物,称为两性氧化物。
写出图中有关反应的化学方程式或离子方程式:
① Al(OH) +3HCl=AlCl +3H O Al(OH) +3H+===Al ++3H O
②Al(OH) +NaOH=NaAlO + 2H O_ Al(OH) +OH-==A1O +2H O
③
4、氢氧化铝
(1)物理性质
白色胶状不溶于水的固体,有较强的吸附性。
(2)化学性质(用化学方程式表示)
Al O ③ Al(OH) ②强碱
受热分解 两性
Al +
AlO2
①强酸
铝、氧化铝和氢氧化铝均能与酸、碱反应,因此
铝制餐具不宜用来蒸煮或长时间存放酸性或碱性
食物
思考
目我国储量及开采
四稀土矿
尖端应用 冶金工业的维生素
稀土金属应用
17种元素
日 稀土金属
回 稀土金属在.
稀土金属
镝 镧系金属镝
稀土元素
谢谢
