物质的分类及转化 第1课时+高一上学期化学人教版(2019)必修第一册(共34张PPT)
文档属性
| 名称 | 物质的分类及转化 第1课时+高一上学期化学人教版(2019)必修第一册(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:30:32 | ||
图片预览








文档简介
(共34张PPT)
第一章物质及其变化
第二章海水中的重要元素—钠和氯 第三章铁金属材料
第四章物质结构元素周期律
第一章
物质及其变化
世界是由物质构成的,目前人类发现和合成的物质已 超过1亿种。对于这么多的物质和更为丰富的化学变化, 人们是怎样认识和研究的呢
分类是认识和研究物质及其变化的一种常用的科学方 法。通过分类,可以将纷繁复杂的物质分成不同的类别,
还可以从离子、电子等微观视角揭示化学反应的规律。依 据物质类别和元素价态,可以解释和预测物质的性质,设
第一章
物质及其变化
●物质的分类及转化
●离子反应
●氧化还原反应
人式素预社
第一节物质的分类及转化
第1课时物质的分类
1.感受分类方法对于化学科学研究和化学学习的重要作用。培养学生“科学精神和社会责 任”的学科素养。
2.通过对“物质分类”的学习,培养学生“宏观辨识和微观探析”的学科素养。
1.能从元素组成(宏观)和构成微粒(微观)的角度分析认识物质,并根据物质的组成和性质 对化学物质进行分类。
2.认识交叉分类法和树状分类法,能用不同的分类标准对酸、碱、盐、氧化物进行分类。
学习目标
素养目标
学习目标
名称:眉豆脊骨炖花生汤 12
功效:富含维生素E,润肺化痰,滋养 调气,去水肿健脾祛湿、街水利湿。
名称:银菜养生猪肺汤 12
功效:补虚、止血止咳、平喘润肠通
便、清肺热保养肺部常吸烟者可做调節。
饭类
9.9 剁椒嫩鸡饭 18
18 泡菜五花肉饭 18
名称:虫花乌鸡汤 10
功效:虫草花含有丰富的蛋白质,对增 强和调节人体免疫功能、提高人体抗病 能力有一定的作用,有益肝肾、补精酯、 之血化廣的功效、很健康的汤
冠于军201牛7年肉面
军的牛肉A.
清炖原汁牛肉面
,
a 的有牛
老坛酸菜牛肉面
江
面
18 鱼香茄子饭 梅菜扣肉饭
18
20
20 回锅肉饭
20
餐牌里的分类
uA24二r
功效:健脾祛湿、补虚损、强身体、 脾胃虚弱、高血压、糖尿病和胃清癌 者可做调节。
20 台式红烧肉饭 24
黑想鸡扒饭 Y24 香惧装鸣饭 24
川味麻辣牛肉面 32
。
南洋咖喱牛肉面 32
名称:准山排骨汤 10
功效:促进消化、补胃养精、润肺 止咳、强身健体。
在 波 地 工
满汉三宝牛肉面
4 , 牛 脑 是
证人以右仟的市
宝岛炸酱面
川味香拌面
32
32
32
面类
标的口味一代年的
12
12
35
n
分类法
分类是根据对象的共同点和差异性,将对象区分为不同 的种类,并形成有一定从属关系的不同等级的系统逻辑方 法;是研究和学习化学物质及其变化的一种常用科学方法。
在高中化学的学习中,对物质及其变化的分类标准将 从物质的组成和性质等宏观视角,拓展到物质的构成、结 构和参加化学反应的粒子等微观视角。
发现物质及其变化的规律,预测物质的性质及其可能发生 的变化。
一、物质的分类
含义
标准
意义
1、分类的含义、标准、意义
2、物质的分类方法
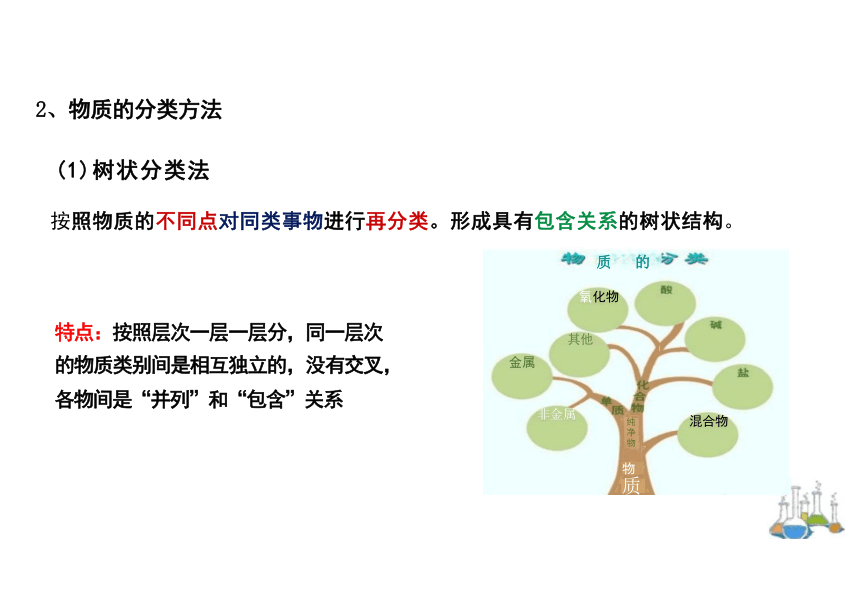
(1)树状分类法
按照物质的不同点对同类事物进行再分类。形成具有包含关系的树状结构。
特点:按照层次一层一层分,同一层次
的物质类别间是相互独立的,没有交叉, 各物间是“并列”和“包含”关系
质 的
氧化物
其他
金属
物
质
非金属
混合物
纯净物
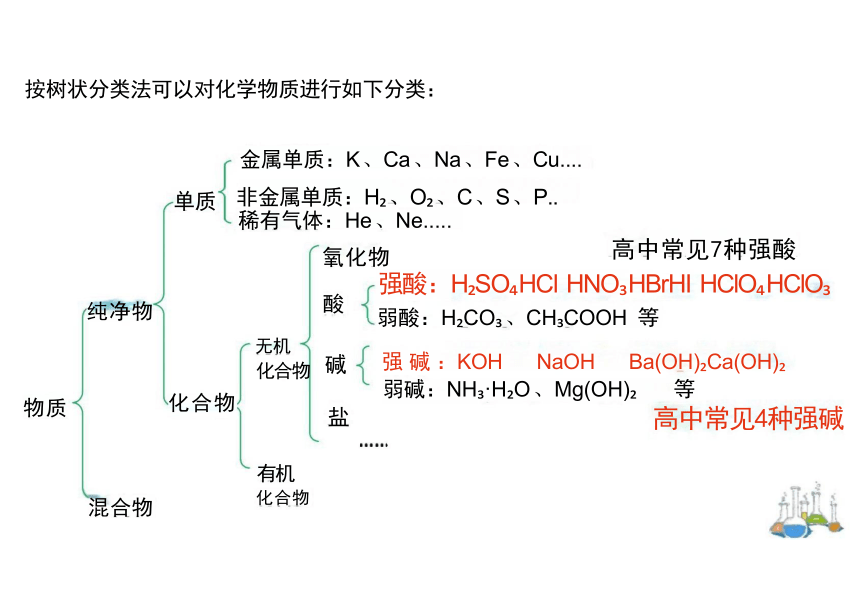
金属单质:K 、Ca 、Na 、Fe 、Cu....
单质 非金属单质:H 、O 、C 、S 、P..
稀有气体:He 、Ne.....
氧化物 高中常见7种强酸
强酸:H SO HCl HNO HBrHI HClO HClO
弱酸:H CO 、CH COOH 等
碱 强 碱 :KOH NaOH Ba(OH) Ca(OH) 弱碱:NH ·H O 、Mg(OH) 等
盐 高中常见4种强碱
纯净物
混合物
无机
化合物
化合物
按树状分类法可以对化学物质进行如下分类:
有机 化合物
物质
酸
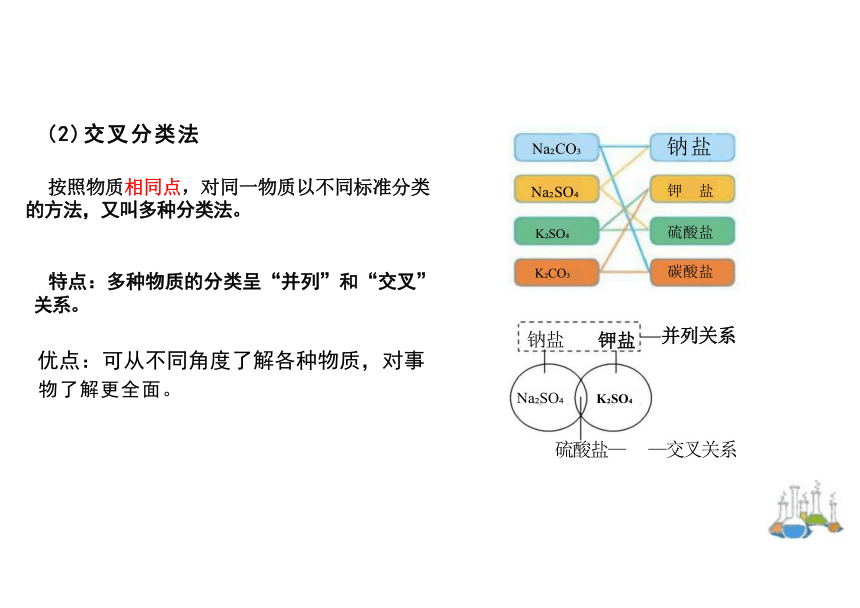
(2)交叉分类法
按照物质相同点,对同一物质以不同标准分类 的方法,又叫多种分类法。
特点:多种物质的分类呈“并列”和“交叉” 关系。
优点:可从不同角度了解各种物质,对事 物了解更全面。
Na CO Na SO K SO K CO
钠盐
钾 盐
硫酸盐
碳酸盐
钠盐 钾盐 并列关系
Na SO K SO
硫酸盐— —交叉关系
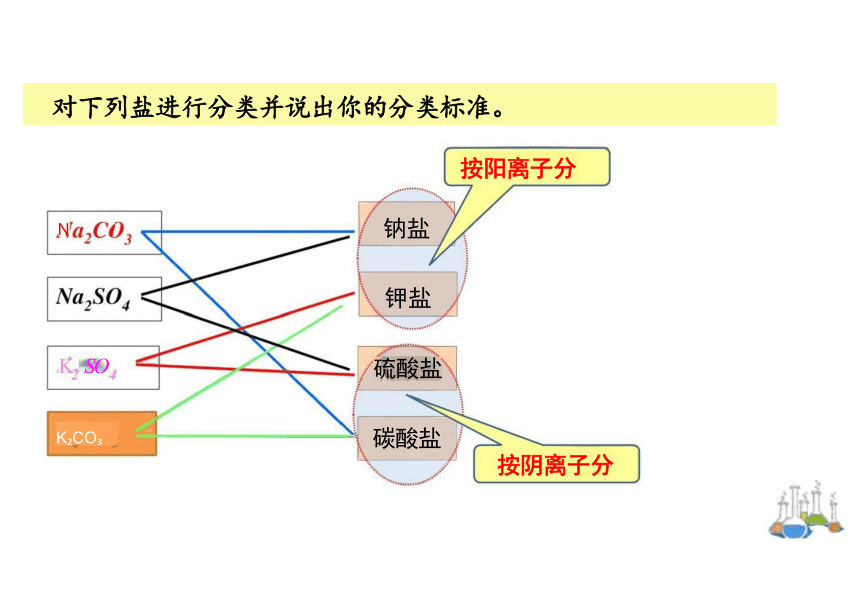
按阳离子分
钠盐
钾盐
硫酸盐
碳酸盐
按阴离子分
对下列盐进行分类并说出你的分类标准。
K SO
N
K CO
1、从物质组成的视角进行分类
任何物质都是由元素组成的,根据元素组成对物质进行分类是化学 研究的基础。
二、化学物质的分类
(1)单质、同素异形体
单质:由同种元素组成的纯净物;
同素异形体:由同种元素形成的几种性质不同的单质;
①实例:金刚石、石墨和C 0;O 和O ; 红磷和白磷。
②产生原因:
a组成分子的原子数目和成键方式不同,如:氧气(O ) 和臭氧(O )。 b原子的排列方式不同,如:金刚石和石墨。
由同种元素组成的物质,不一定是纯净物。
如氧气(O )和臭氧(O )的混合物。
由同种元素组成的物质, 一定是纯净物吗
易错提醒
(2)化合物: 由不同的元素形成的纯净物就是化合物。
如CO 、H O、NaCl等。
一组是(C)
A .CaO和CaS B.
C.C60 和C 0 D.HCNO 和HOCN
【练习】下列每组中的两种物质之间的关系为同素异形体的
H SO 、HNO 、HCl 、HCIO 、HI 、HBr
H SO 、H PO 、H C O
H CO 、CH COOH 、HCIO 、HF 、H S
HNO 、HCl 、HClO 、HI 、HBr 、CH COOH、
HClO 、HF
H SO 、H SO 、H C O 、H CO
H PO
HNO 、HClO 、H SO 、H PO 、H C O 、
CH CO0H 、HCIO 、H CO 、CH COOH 、HCIO
HCI 、HI 、HBr 、HF 、H S
强酸
中强酸 弱酸
一元酸 二元酸 多元酸 含氧酸
无氧酸
酸性强弱
电离出 H+数目
是否含
氧元素
(1)酸
酸
2、从物质性质的视角进行分类
NaOH 、KOH 、Ca(OH) 、Ba(OH)
Mg(OH)
NH H O 、Cu(OH) 、Fe(OH) 、Zn(OH)
NaOH 、KOH 、NH H O
Ca(OH) 、Ba(OH) 、Mg(OH) 、Cu(OHD) 、Zn(OH) Fe(OH)
NaOH 、KOH 、Ba(OH) 、NH H O
Ca(OH)
Mg(OH) 、Cu(OH) 、Fe(OH) 、Zn(OH)
强碱
中强碱 弱碱
一元碱 二元碱 多元碱 可溶碱 微溶碱 难溶酸
碱性强弱
电离出
OH- 数目
溶解性
(2)碱
碱
金属阳离子或铵根离子钠盐、钾盐、铵盐等
酸根离子硫酸盐、硝酸盐、碳酸盐等
可溶盐 NaCl 、K SO 、AgNO
微溶盐 CaSO 、Ag SO 、MgCO
难溶盐 BaCO AgCl BaSO
正盐 K SO 、Na CO
酸式盐 NaHCO 、NaHSO
碱式盐 Cu (OH) CO
组成
溶解性
性质
( 3 ) 盐
盐
注 :
正盐:是在酸跟碱完全中和生成的盐,不会有酸中的H+, 也不会有碱中的OH- , 如NaCl、K SO 等 ;
酸式盐:是指在水溶液中能电离出H+ 的盐,如NaHSO 、NaH PO 等 ;
碱式盐:在电离时生成的阴离子除了酸根离子外还有OH-的盐,如 Cu (OH) CO 等。
【练习】有以下几种物质:①液态氧②硝酸钾溶液③胆矾晶体④干冰
⑤生石灰⑥金刚石⑦纯碱⑧甲烷⑨熟石灰⑩食盐水 石灰水
KCIO H SO 碱式碳酸铜[Cu (OH) CO ] 硫酸氢钠。
其中,属于混合物的有 ,属于正盐的是 ③⑦ ;属于酸的有 , 属于碱的是 ⑨ ;属于氧化物的是④⑤ ;属于单质的是 ①⑥。
能与酸反应生成盐和水的氧化物CO 、SO 、 Mn O
能与碱反应生成盐和水的氧化物 CuO MgO CaO
既能与酸又能与碱起反应,且均生成 Al O
盐和水的氧化物
金属氧化物 CuO MgO CaO
非金属氧化物 CO 、SO 、NO
酸性氧化物
碱性氧化物
两性氧化物
组成
性质
成盐
不成盐氧化物 CO、NO
氧化物
(4)氧化物
①酸性氧化物:
与碱反应生成盐和水的氧化物,如CO 、SO 。
CO +Ca(OH) =CaCO ↓+H O SO +NaOH=Na SO +H O
【注】
①大部分非金属氧化物是酸性氧化物,但有些不是,如NO、CO等,它们不能与酸、碱 反应,属不成盐氧化物。
②部分酸性氧化物与水直接化合为相应的酸,如CO +H O=H CO ,
SO +H O=H 504 。但有些酸性氧化物如SiO等,不能与水反应生成相应的酸。
③酸性氧化物又叫酸酐。C O 、SO SO SiO H SiO 的酸酐。
分别是H CO H SO H SO
【注】
①大部分金属氧化物属于碱性氧化物,但有些不是,如Mn O 属于酸性氧化物。
②部分碱性氧化物与水反应生成碱,如K O+H O=2KOH,CaO+H O=Ca(OH)2,
Na O+H O=2NaO。大部分碱性氧化物不能与水反应生成碱,如CuO、Fe O 、MgO
等。
②碱性氧化物:
与酸反应生成盐和水的氧化物,如CaO 、Fe O 。
CaO+H SO =CaSO J+H O Fe O +6HCl=2FeCl +3H O
(1)酸性氧化物不一定是非金属氧化物,如Mn O 。
(2)非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物一定是金属氧化物。
(4)金属氧化物不一定是碱性氧化物,如Mn O 是酸性氧化物,Al O 是两性氧化物
(5)酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱, 如SiO 、Fe O 都不溶于水,也不与水反应。
(6)与碱反应生成盐和水的氧化物不一定是酸性氧化物,
如2NO +2NaOH===NaNO +NaNO +H O,NO 不是酸性氧化物。
★酸性氧化物和碱性氧化物的理解
分类原则:行之有效,简单易行。
目的和意义:了解各类物质的共性各类反应的本质
确定分类标准
选择分类方法
得出正确的分类
小结:
分类方法
树状分类法
交叉分类法
物质的分类
分类步骤
气体生液体 固体五 气体
春天 英语
春 天 (· 夏天 秋天 冬天
冬天 七
三 四 五 六 学 七
语文 ●数学 ·英语 物理物理 化学
【学习评价二】
15秒,谁记住的最多 学完本节内容,会使你更聪明
意义:能够提
高人们工作,
学习的效率, 使人们更快, 更便捷地达到
目的等。
【学习评价三】对下列酸用交叉分类法进行分类,并说出
你的分类标准。H SO 、HCl、H CO 、H PO
H SO
HCl
H CO
H PO
选项 酸性氧化物 碱性氧化物 酸 碱
盐
A CO Mn O H SO KOH
NaHCO
B CO Na O HCl NaOH
NaCl
C SO CuO CH COOH Na CO
CaF
D SO CaO HNO Ca(OH)
CaCO
课堂练习
【答案】D【 解析】Mn O 为酸性氧化物,A 项错误;CO既不能与酸反应生成盐和水,又不能与碱反应
生成盐和水,属于不成盐氧化物,B 项错误;Na CO 是 盐 ,C 项错误。
典 例 1 .下列物质分类正确的是()
典例2 .如图表示的一些物质或概念间的从属关系不正确的是()
A.X 为含氧酸、Y 为酸、Z 为化合物
B.X 为氧化物、Y 为化合物、Z 为纯净物
C.X 为强碱、Y 为碱、Z 为化合物
D.X 为非金属氧化物、Y 为酸性氧化物、Z 为氧化物
【答案】D【 解析】化合物可以分为酸、碱、盐、氧化物等,按分子组成中是否含氧元素,酸可分 为含氧酸和无氧酸,A 项正确;纯净物分为单质和化合物,化合物可以分为酸、碱、盐、氧化物等, B项正确;化合物可以分为酸、碱、盐、氧化物等,按解离程度不同,碱可分为强碱、弱碱等,C 项 正确;氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,酸性氧化物不一定 是非金属氧化物(如Mn O 等),非金属氧化物也不一定是酸性氧化物(如CO 等),酸性氧化物和非金 属氧化物属于交叉关系,D 项错误。
课堂练习
典 例 3 .2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的
身体健康。“84”消毒液(主要成分为NaClO)是人们常用的消毒剂。下列 关于“84”消毒液及其主要成分的说法正确的是()
A.“84” 消毒液是纯净物 B.NaClO 属于氧化物
C.NaClO 属于盐 D.NaClO 属于碱
【答案】C【 解析】 “84”消毒液的主要成分为NaClO,NaClO 属于盐。
课堂练习
典 例 4 .按照物质的交叉分类方法判断,HNO 属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸
⑥挥发性酸⑦一元酸 ⑧化合物 ⑨混合物
A.②④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①③⑤⑨ D.①④⑤⑦⑧
课堂练习
属于酸、含氧酸、挥发性酸、一元酸、化合物。
【答案】B
【解析】HNO
所有碳原子,如图)已在实验室成功合成。T 碳属于()
A. 混合物
B. 化合物
C. 氧化物
D. 单 质
【答案】D
【解析】该物质只由一种元素即碳元素组成,属于单质。
典例5 .我国科学家预言的T碳(四个碳原子构成的正四面体分别取代金刚石结构中
课堂练习
典例6 .科学家发现C o后,近年又合成了许多球形分子(富勒烯),如C o、C o、
C120、C540等,它们之间的关系是()
A. 同一物质 B. 同种化合物
C. 互为同素异形体 D. 无法判断
【答案】C【 解析】C o、C 0、C120、C540都是由碳元素组成的不同单质,它
课堂练习
们互称为同素异形体。
第一章物质及其变化
第二章海水中的重要元素—钠和氯 第三章铁金属材料
第四章物质结构元素周期律
第一章
物质及其变化
世界是由物质构成的,目前人类发现和合成的物质已 超过1亿种。对于这么多的物质和更为丰富的化学变化, 人们是怎样认识和研究的呢
分类是认识和研究物质及其变化的一种常用的科学方 法。通过分类,可以将纷繁复杂的物质分成不同的类别,
还可以从离子、电子等微观视角揭示化学反应的规律。依 据物质类别和元素价态,可以解释和预测物质的性质,设
第一章
物质及其变化
●物质的分类及转化
●离子反应
●氧化还原反应
人式素预社
第一节物质的分类及转化
第1课时物质的分类
1.感受分类方法对于化学科学研究和化学学习的重要作用。培养学生“科学精神和社会责 任”的学科素养。
2.通过对“物质分类”的学习,培养学生“宏观辨识和微观探析”的学科素养。
1.能从元素组成(宏观)和构成微粒(微观)的角度分析认识物质,并根据物质的组成和性质 对化学物质进行分类。
2.认识交叉分类法和树状分类法,能用不同的分类标准对酸、碱、盐、氧化物进行分类。
学习目标
素养目标
学习目标
名称:眉豆脊骨炖花生汤 12
功效:富含维生素E,润肺化痰,滋养 调气,去水肿健脾祛湿、街水利湿。
名称:银菜养生猪肺汤 12
功效:补虚、止血止咳、平喘润肠通
便、清肺热保养肺部常吸烟者可做调節。
饭类
9.9 剁椒嫩鸡饭 18
18 泡菜五花肉饭 18
名称:虫花乌鸡汤 10
功效:虫草花含有丰富的蛋白质,对增 强和调节人体免疫功能、提高人体抗病 能力有一定的作用,有益肝肾、补精酯、 之血化廣的功效、很健康的汤
冠于军201牛7年肉面
军的牛肉A.
清炖原汁牛肉面
,
a 的有牛
老坛酸菜牛肉面
江
面
18 鱼香茄子饭 梅菜扣肉饭
18
20
20 回锅肉饭
20
餐牌里的分类
uA24二r
功效:健脾祛湿、补虚损、强身体、 脾胃虚弱、高血压、糖尿病和胃清癌 者可做调节。
20 台式红烧肉饭 24
黑想鸡扒饭 Y24 香惧装鸣饭 24
川味麻辣牛肉面 32
。
南洋咖喱牛肉面 32
名称:准山排骨汤 10
功效:促进消化、补胃养精、润肺 止咳、强身健体。
在 波 地 工
满汉三宝牛肉面
4 , 牛 脑 是
证人以右仟的市
宝岛炸酱面
川味香拌面
32
32
32
面类
标的口味一代年的
12
12
35
n
分类法
分类是根据对象的共同点和差异性,将对象区分为不同 的种类,并形成有一定从属关系的不同等级的系统逻辑方 法;是研究和学习化学物质及其变化的一种常用科学方法。
在高中化学的学习中,对物质及其变化的分类标准将 从物质的组成和性质等宏观视角,拓展到物质的构成、结 构和参加化学反应的粒子等微观视角。
发现物质及其变化的规律,预测物质的性质及其可能发生 的变化。
一、物质的分类
含义
标准
意义
1、分类的含义、标准、意义
2、物质的分类方法
(1)树状分类法
按照物质的不同点对同类事物进行再分类。形成具有包含关系的树状结构。
特点:按照层次一层一层分,同一层次
的物质类别间是相互独立的,没有交叉, 各物间是“并列”和“包含”关系
质 的
氧化物
其他
金属
物
质
非金属
混合物
纯净物
金属单质:K 、Ca 、Na 、Fe 、Cu....
单质 非金属单质:H 、O 、C 、S 、P..
稀有气体:He 、Ne.....
氧化物 高中常见7种强酸
强酸:H SO HCl HNO HBrHI HClO HClO
弱酸:H CO 、CH COOH 等
碱 强 碱 :KOH NaOH Ba(OH) Ca(OH) 弱碱:NH ·H O 、Mg(OH) 等
盐 高中常见4种强碱
纯净物
混合物
无机
化合物
化合物
按树状分类法可以对化学物质进行如下分类:
有机 化合物
物质
酸
(2)交叉分类法
按照物质相同点,对同一物质以不同标准分类 的方法,又叫多种分类法。
特点:多种物质的分类呈“并列”和“交叉” 关系。
优点:可从不同角度了解各种物质,对事 物了解更全面。
Na CO Na SO K SO K CO
钠盐
钾 盐
硫酸盐
碳酸盐
钠盐 钾盐 并列关系
Na SO K SO
硫酸盐— —交叉关系
按阳离子分
钠盐
钾盐
硫酸盐
碳酸盐
按阴离子分
对下列盐进行分类并说出你的分类标准。
K SO
N
K CO
1、从物质组成的视角进行分类
任何物质都是由元素组成的,根据元素组成对物质进行分类是化学 研究的基础。
二、化学物质的分类
(1)单质、同素异形体
单质:由同种元素组成的纯净物;
同素异形体:由同种元素形成的几种性质不同的单质;
①实例:金刚石、石墨和C 0;O 和O ; 红磷和白磷。
②产生原因:
a组成分子的原子数目和成键方式不同,如:氧气(O ) 和臭氧(O )。 b原子的排列方式不同,如:金刚石和石墨。
由同种元素组成的物质,不一定是纯净物。
如氧气(O )和臭氧(O )的混合物。
由同种元素组成的物质, 一定是纯净物吗
易错提醒
(2)化合物: 由不同的元素形成的纯净物就是化合物。
如CO 、H O、NaCl等。
一组是(C)
A .CaO和CaS B.
C.C60 和C 0 D.HCNO 和HOCN
【练习】下列每组中的两种物质之间的关系为同素异形体的
H SO 、HNO 、HCl 、HCIO 、HI 、HBr
H SO 、H PO 、H C O
H CO 、CH COOH 、HCIO 、HF 、H S
HNO 、HCl 、HClO 、HI 、HBr 、CH COOH、
HClO 、HF
H SO 、H SO 、H C O 、H CO
H PO
HNO 、HClO 、H SO 、H PO 、H C O 、
CH CO0H 、HCIO 、H CO 、CH COOH 、HCIO
HCI 、HI 、HBr 、HF 、H S
强酸
中强酸 弱酸
一元酸 二元酸 多元酸 含氧酸
无氧酸
酸性强弱
电离出 H+数目
是否含
氧元素
(1)酸
酸
2、从物质性质的视角进行分类
NaOH 、KOH 、Ca(OH) 、Ba(OH)
Mg(OH)
NH H O 、Cu(OH) 、Fe(OH) 、Zn(OH)
NaOH 、KOH 、NH H O
Ca(OH) 、Ba(OH) 、Mg(OH) 、Cu(OHD) 、Zn(OH) Fe(OH)
NaOH 、KOH 、Ba(OH) 、NH H O
Ca(OH)
Mg(OH) 、Cu(OH) 、Fe(OH) 、Zn(OH)
强碱
中强碱 弱碱
一元碱 二元碱 多元碱 可溶碱 微溶碱 难溶酸
碱性强弱
电离出
OH- 数目
溶解性
(2)碱
碱
金属阳离子或铵根离子钠盐、钾盐、铵盐等
酸根离子硫酸盐、硝酸盐、碳酸盐等
可溶盐 NaCl 、K SO 、AgNO
微溶盐 CaSO 、Ag SO 、MgCO
难溶盐 BaCO AgCl BaSO
正盐 K SO 、Na CO
酸式盐 NaHCO 、NaHSO
碱式盐 Cu (OH) CO
组成
溶解性
性质
( 3 ) 盐
盐
注 :
正盐:是在酸跟碱完全中和生成的盐,不会有酸中的H+, 也不会有碱中的OH- , 如NaCl、K SO 等 ;
酸式盐:是指在水溶液中能电离出H+ 的盐,如NaHSO 、NaH PO 等 ;
碱式盐:在电离时生成的阴离子除了酸根离子外还有OH-的盐,如 Cu (OH) CO 等。
【练习】有以下几种物质:①液态氧②硝酸钾溶液③胆矾晶体④干冰
⑤生石灰⑥金刚石⑦纯碱⑧甲烷⑨熟石灰⑩食盐水 石灰水
KCIO H SO 碱式碳酸铜[Cu (OH) CO ] 硫酸氢钠。
其中,属于混合物的有 ,属于正盐的是 ③⑦ ;属于酸的有 , 属于碱的是 ⑨ ;属于氧化物的是④⑤ ;属于单质的是 ①⑥。
能与酸反应生成盐和水的氧化物CO 、SO 、 Mn O
能与碱反应生成盐和水的氧化物 CuO MgO CaO
既能与酸又能与碱起反应,且均生成 Al O
盐和水的氧化物
金属氧化物 CuO MgO CaO
非金属氧化物 CO 、SO 、NO
酸性氧化物
碱性氧化物
两性氧化物
组成
性质
成盐
不成盐氧化物 CO、NO
氧化物
(4)氧化物
①酸性氧化物:
与碱反应生成盐和水的氧化物,如CO 、SO 。
CO +Ca(OH) =CaCO ↓+H O SO +NaOH=Na SO +H O
【注】
①大部分非金属氧化物是酸性氧化物,但有些不是,如NO、CO等,它们不能与酸、碱 反应,属不成盐氧化物。
②部分酸性氧化物与水直接化合为相应的酸,如CO +H O=H CO ,
SO +H O=H 504 。但有些酸性氧化物如SiO等,不能与水反应生成相应的酸。
③酸性氧化物又叫酸酐。C O 、SO SO SiO H SiO 的酸酐。
分别是H CO H SO H SO
【注】
①大部分金属氧化物属于碱性氧化物,但有些不是,如Mn O 属于酸性氧化物。
②部分碱性氧化物与水反应生成碱,如K O+H O=2KOH,CaO+H O=Ca(OH)2,
Na O+H O=2NaO。大部分碱性氧化物不能与水反应生成碱,如CuO、Fe O 、MgO
等。
②碱性氧化物:
与酸反应生成盐和水的氧化物,如CaO 、Fe O 。
CaO+H SO =CaSO J+H O Fe O +6HCl=2FeCl +3H O
(1)酸性氧化物不一定是非金属氧化物,如Mn O 。
(2)非金属氧化物不一定都是酸性氧化物,如CO、NO。
(3)碱性氧化物一定是金属氧化物。
(4)金属氧化物不一定是碱性氧化物,如Mn O 是酸性氧化物,Al O 是两性氧化物
(5)酸性氧化物、碱性氧化物不一定能与水反应生成相应的酸或碱, 如SiO 、Fe O 都不溶于水,也不与水反应。
(6)与碱反应生成盐和水的氧化物不一定是酸性氧化物,
如2NO +2NaOH===NaNO +NaNO +H O,NO 不是酸性氧化物。
★酸性氧化物和碱性氧化物的理解
分类原则:行之有效,简单易行。
目的和意义:了解各类物质的共性各类反应的本质
确定分类标准
选择分类方法
得出正确的分类
小结:
分类方法
树状分类法
交叉分类法
物质的分类
分类步骤
气体生液体 固体五 气体
春天 英语
春 天 (· 夏天 秋天 冬天
冬天 七
三 四 五 六 学 七
语文 ●数学 ·英语 物理物理 化学
【学习评价二】
15秒,谁记住的最多 学完本节内容,会使你更聪明
意义:能够提
高人们工作,
学习的效率, 使人们更快, 更便捷地达到
目的等。
【学习评价三】对下列酸用交叉分类法进行分类,并说出
你的分类标准。H SO 、HCl、H CO 、H PO
H SO
HCl
H CO
H PO
选项 酸性氧化物 碱性氧化物 酸 碱
盐
A CO Mn O H SO KOH
NaHCO
B CO Na O HCl NaOH
NaCl
C SO CuO CH COOH Na CO
CaF
D SO CaO HNO Ca(OH)
CaCO
课堂练习
【答案】D【 解析】Mn O 为酸性氧化物,A 项错误;CO既不能与酸反应生成盐和水,又不能与碱反应
生成盐和水,属于不成盐氧化物,B 项错误;Na CO 是 盐 ,C 项错误。
典 例 1 .下列物质分类正确的是()
典例2 .如图表示的一些物质或概念间的从属关系不正确的是()
A.X 为含氧酸、Y 为酸、Z 为化合物
B.X 为氧化物、Y 为化合物、Z 为纯净物
C.X 为强碱、Y 为碱、Z 为化合物
D.X 为非金属氧化物、Y 为酸性氧化物、Z 为氧化物
【答案】D【 解析】化合物可以分为酸、碱、盐、氧化物等,按分子组成中是否含氧元素,酸可分 为含氧酸和无氧酸,A 项正确;纯净物分为单质和化合物,化合物可以分为酸、碱、盐、氧化物等, B项正确;化合物可以分为酸、碱、盐、氧化物等,按解离程度不同,碱可分为强碱、弱碱等,C 项 正确;氧化物可以分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,酸性氧化物不一定 是非金属氧化物(如Mn O 等),非金属氧化物也不一定是酸性氧化物(如CO 等),酸性氧化物和非金 属氧化物属于交叉关系,D 项错误。
课堂练习
典 例 3 .2019年12月以来,我国部分地区突发的新型冠状病毒肺炎威胁着人们的
身体健康。“84”消毒液(主要成分为NaClO)是人们常用的消毒剂。下列 关于“84”消毒液及其主要成分的说法正确的是()
A.“84” 消毒液是纯净物 B.NaClO 属于氧化物
C.NaClO 属于盐 D.NaClO 属于碱
【答案】C【 解析】 “84”消毒液的主要成分为NaClO,NaClO 属于盐。
课堂练习
典 例 4 .按照物质的交叉分类方法判断,HNO 属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸
⑥挥发性酸⑦一元酸 ⑧化合物 ⑨混合物
A.②④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①③⑤⑨ D.①④⑤⑦⑧
课堂练习
属于酸、含氧酸、挥发性酸、一元酸、化合物。
【答案】B
【解析】HNO
所有碳原子,如图)已在实验室成功合成。T 碳属于()
A. 混合物
B. 化合物
C. 氧化物
D. 单 质
【答案】D
【解析】该物质只由一种元素即碳元素组成,属于单质。
典例5 .我国科学家预言的T碳(四个碳原子构成的正四面体分别取代金刚石结构中
课堂练习
典例6 .科学家发现C o后,近年又合成了许多球形分子(富勒烯),如C o、C o、
C120、C540等,它们之间的关系是()
A. 同一物质 B. 同种化合物
C. 互为同素异形体 D. 无法判断
【答案】C【 解析】C o、C 0、C120、C540都是由碳元素组成的不同单质,它
课堂练习
们互称为同素异形体。
