3.2.2 过氧化氢制氧气的实验课件(共22张PPT) 2024-2025学年化学科粤版九年级上册
文档属性
| 名称 | 3.2.2 过氧化氢制氧气的实验课件(共22张PPT) 2024-2025学年化学科粤版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 860.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-03 20:14:46 | ||
图片预览








文档简介
(共22张PPT)
1.能说出实验室用过氧化氢、氯酸钾制取氧气的原理与装置。
2.认识分解反应、催化剂及催化作用。
反应条件通常以实验操作为主,那么在制取氧气的条件中,却出现了二氧化锰,那么二氧化锰有什么作用呢?
分解过氧化氢制取氧气
1.药品:
2.原理:
过氧化氢溶液(无色液体) 二氧化锰(黑色固体)
过氧化氢 水 + 氧气
二氧化锰
过氧化氢在二氧化锰作催化剂的条件下生成水和氧气
过氧化氢俗称双氧水
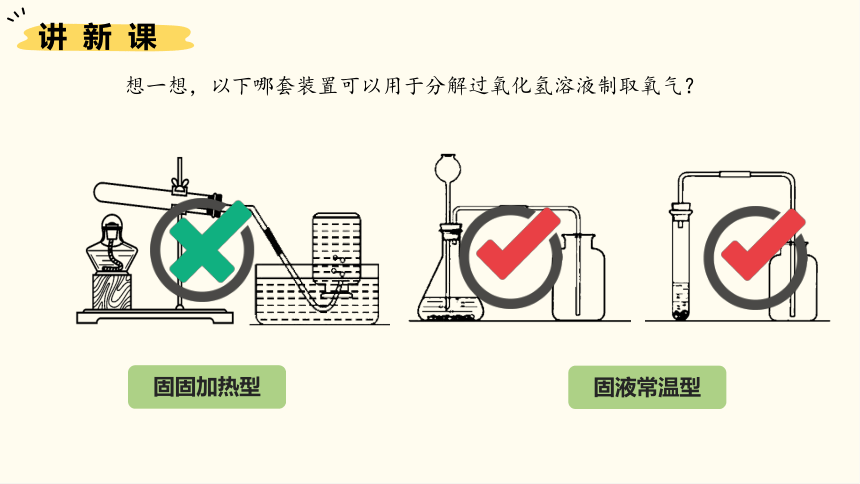
想一想,以下哪套装置可以用于分解过氧化氢溶液制取氧气?
固固加热型
固液常温型
步骤:
1.检查装置气密性;2.加入固体药品;
3.加入液体药品; 4.收集气体。
思考装置图中圈画的注意事项,想想为什么?
长颈漏斗管口必须伸到液面以下,形成液封,防止气体外逸
导管不能太长,有利于气体排出。
导管必须伸到底部,有利于排净集气瓶中的空气。
8
步骤一:用量筒量取4 mL的过氧化氢溶液加入试管中,将带火星的木条伸进试管内,结果怎样
现 象:木条不能复燃
分 析:常温下过氧化氢溶液分解缓慢、放出的氧气少,不足以使带火星的木条复燃。
观察活动:观察过氧化氢在二氧化锰存在下的分解
步骤二:取少量二氧化锰装入另一试管中,将带火星的木条伸进试管内,结果怎样
现 象:带火星的木条不复燃
分 析:二氧化锰不产生氧气
步骤三:再取少量二氧化锰于第三支试管中,再量取4 mL过氧化氢溶液加入,将带火星的木条伸进试管内,有什么现象发生
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,二氧化锰(MnO2)快速产生大量氧气。
步骤三:待实验(3)的试管内的液体不再放出气 泡时,重新加入4 mL过氧化氢溶液,再将带火星的木条伸进试管内,又有什么现象发生
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,加入二氧化锰(MnO2)只是起加快产生氧气的作用。
【实验结论】在有二氧化锰存在的条件下,过氧化氢能更快地分解产生氧气。二氧化锰能促进过氧化氢分解,但它的质量在反应前后没有改变,说明它本身没有分解。
素养培育·方法导引
对比实验
对比实验是指设置两个或两个以上的实验组,通过对结果的比较分析,来探究各种因素与实验对象的关系。在一组对比实验中,只能改变一个因素,除了改变的那个因素外,其他因素应该保持一样。
如果在实验前用天平称量二氧化锰的质量,实验后把二氧化锰洗净、干燥,再称量,你会发现它的质量没有发生变化。
这种在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂。
催化剂在化学反应中所起的作用叫做催化作用。
催化剂注意点
催化剂特点
a.一变:
化学反应速率改变,“改变”可以是加快,也可以是减慢;
b.两不变:
催化剂本身的质量和化学性质不改变。
a.催化剂只是一个反应条件;
b.催化剂不改变生成物的量;
c.催化剂是针对具体的化学反应而言,不能单独的说某种物质是催化剂;
d.同一个反应可以有多种催化剂。
在加热氯酸钾制取氧气中,我们也用到了二氧化锰做催化剂。
加热氯酸钾:氯酸钾 氯化钾+氧气
二氧化锰
加热
KClO3 KCl O2
注意:氯酸钾制取氧气的装置及操作步骤除了不用在试管口放一团棉花外,其他的与加热高锰酸钾制取氧气相同。
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
过氧化氢 水 + 氧气
二氧化锰
观察下列反应,他们有什么共同的特点:
反应前有一种物质名称,反应后是多种物质名称
1、定义:
2、特点:
由一变多
(判断依据)
4、属于化学反应基本类型之一
由一种物质反应产生两种或两种以上物质的化学反应
3、表达式:A→B+C+D+......
思考:泥水过滤得到泥和水,是分解反应吗?
物理变化
分解反应
在化学学习过程中,常常要用到分类的方法。例如,物质可以分为纯净物和混合物;化学反应可以分为化合反应和分解反应等。
物质
纯净物
混合物
化学反应
化合反应
分解反应
……
催化剂及催化作用
工业制取氧气:分离液态空气法
分解反应:“一生多”
特点:“一变两不变”
不改变生成物的质量
氧气的工业制取
分离液态空气法
加压
空气
液态空气
降温、加压
蒸发
氮气
液氧
氮气和氧气沸点不同
贮存在蓝色钢瓶中
── 物理变化
氮气N2(-196℃)
氧气O2(-183℃)
1.下列关于催化剂的说法正确的是( )
A.过氧化氢溶液中加二氧化锰可使产生氧气增多
B.在化学反应前后催化剂质量和性质都不改变
C.所有的催化剂在化学反应中都是加快反应速率
D.在同一反应中可以用多种催化剂改变速率
D
2.在试管甲和试管乙中放入等质量的KClO3,在试管甲中加入一定量的MnO2,分别加热并充分反应,下图对该实验产生气体的质量与反应时间的关系,描述合理的是( )
A
1.能说出实验室用过氧化氢、氯酸钾制取氧气的原理与装置。
2.认识分解反应、催化剂及催化作用。
反应条件通常以实验操作为主,那么在制取氧气的条件中,却出现了二氧化锰,那么二氧化锰有什么作用呢?
分解过氧化氢制取氧气
1.药品:
2.原理:
过氧化氢溶液(无色液体) 二氧化锰(黑色固体)
过氧化氢 水 + 氧气
二氧化锰
过氧化氢在二氧化锰作催化剂的条件下生成水和氧气
过氧化氢俗称双氧水
想一想,以下哪套装置可以用于分解过氧化氢溶液制取氧气?
固固加热型
固液常温型
步骤:
1.检查装置气密性;2.加入固体药品;
3.加入液体药品; 4.收集气体。
思考装置图中圈画的注意事项,想想为什么?
长颈漏斗管口必须伸到液面以下,形成液封,防止气体外逸
导管不能太长,有利于气体排出。
导管必须伸到底部,有利于排净集气瓶中的空气。
8
步骤一:用量筒量取4 mL的过氧化氢溶液加入试管中,将带火星的木条伸进试管内,结果怎样
现 象:木条不能复燃
分 析:常温下过氧化氢溶液分解缓慢、放出的氧气少,不足以使带火星的木条复燃。
观察活动:观察过氧化氢在二氧化锰存在下的分解
步骤二:取少量二氧化锰装入另一试管中,将带火星的木条伸进试管内,结果怎样
现 象:带火星的木条不复燃
分 析:二氧化锰不产生氧气
步骤三:再取少量二氧化锰于第三支试管中,再量取4 mL过氧化氢溶液加入,将带火星的木条伸进试管内,有什么现象发生
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,二氧化锰(MnO2)快速产生大量氧气。
步骤三:待实验(3)的试管内的液体不再放出气 泡时,重新加入4 mL过氧化氢溶液,再将带火星的木条伸进试管内,又有什么现象发生
现 象:木条复燃
分 析:氧气是过氧化氢分解产生的,加入二氧化锰(MnO2)只是起加快产生氧气的作用。
【实验结论】在有二氧化锰存在的条件下,过氧化氢能更快地分解产生氧气。二氧化锰能促进过氧化氢分解,但它的质量在反应前后没有改变,说明它本身没有分解。
素养培育·方法导引
对比实验
对比实验是指设置两个或两个以上的实验组,通过对结果的比较分析,来探究各种因素与实验对象的关系。在一组对比实验中,只能改变一个因素,除了改变的那个因素外,其他因素应该保持一样。
如果在实验前用天平称量二氧化锰的质量,实验后把二氧化锰洗净、干燥,再称量,你会发现它的质量没有发生变化。
这种在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂。
催化剂在化学反应中所起的作用叫做催化作用。
催化剂注意点
催化剂特点
a.一变:
化学反应速率改变,“改变”可以是加快,也可以是减慢;
b.两不变:
催化剂本身的质量和化学性质不改变。
a.催化剂只是一个反应条件;
b.催化剂不改变生成物的量;
c.催化剂是针对具体的化学反应而言,不能单独的说某种物质是催化剂;
d.同一个反应可以有多种催化剂。
在加热氯酸钾制取氧气中,我们也用到了二氧化锰做催化剂。
加热氯酸钾:氯酸钾 氯化钾+氧气
二氧化锰
加热
KClO3 KCl O2
注意:氯酸钾制取氧气的装置及操作步骤除了不用在试管口放一团棉花外,其他的与加热高锰酸钾制取氧气相同。
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
过氧化氢 水 + 氧气
二氧化锰
观察下列反应,他们有什么共同的特点:
反应前有一种物质名称,反应后是多种物质名称
1、定义:
2、特点:
由一变多
(判断依据)
4、属于化学反应基本类型之一
由一种物质反应产生两种或两种以上物质的化学反应
3、表达式:A→B+C+D+......
思考:泥水过滤得到泥和水,是分解反应吗?
物理变化
分解反应
在化学学习过程中,常常要用到分类的方法。例如,物质可以分为纯净物和混合物;化学反应可以分为化合反应和分解反应等。
物质
纯净物
混合物
化学反应
化合反应
分解反应
……
催化剂及催化作用
工业制取氧气:分离液态空气法
分解反应:“一生多”
特点:“一变两不变”
不改变生成物的质量
氧气的工业制取
分离液态空气法
加压
空气
液态空气
降温、加压
蒸发
氮气
液氧
氮气和氧气沸点不同
贮存在蓝色钢瓶中
── 物理变化
氮气N2(-196℃)
氧气O2(-183℃)
1.下列关于催化剂的说法正确的是( )
A.过氧化氢溶液中加二氧化锰可使产生氧气增多
B.在化学反应前后催化剂质量和性质都不改变
C.所有的催化剂在化学反应中都是加快反应速率
D.在同一反应中可以用多种催化剂改变速率
D
2.在试管甲和试管乙中放入等质量的KClO3,在试管甲中加入一定量的MnO2,分别加热并充分反应,下图对该实验产生气体的质量与反应时间的关系,描述合理的是( )
A
同课章节目录
