1.2+离子反应 第2课时 课件(共35张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2+离子反应 第2课时 课件(共35张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 17:16:56 | ||
图片预览











文档简介
(共35张PPT)
第一章第二节
离子反应
1.2.2离子反应
高一必修一
1、分析酸碱盐的反应实质以及课本实验探究1-3,认识离子反应以及其本质,提高学生的证据推理能力。
2、掌握书写离子方程式的一般方法及其正误判断。
3、学会区分化学方程式与离子方程式,掌握离子方程式的一般模型以及相关反应类型。
课堂目标
目录
离子反应
01
离子方程式
02
离子反应的应用
04
离子共存问题
03
PART
01
离子反应
思考
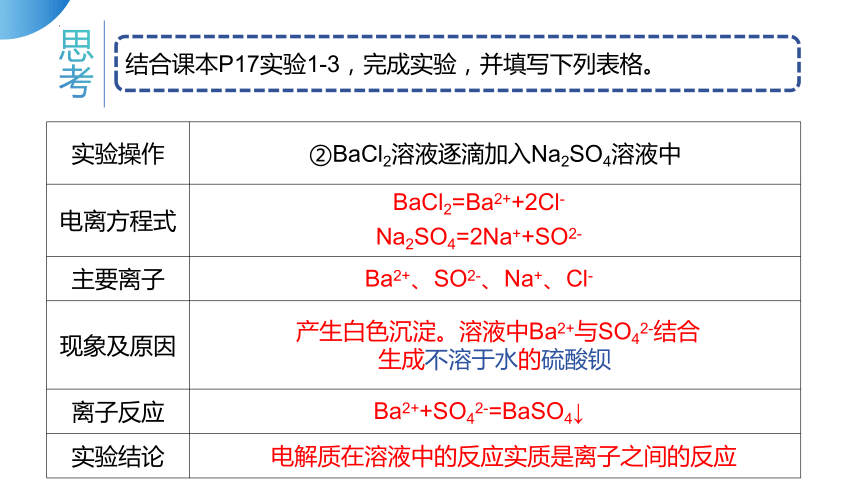
结合课本P17实验1-3,完成实验,并填写下列表格。
实验操作 ②BaCl2溶液逐滴加入Na2SO4溶液中
电离方程式
主要离子
现象及原因
离子反应
实验结论
BaCl2=Ba2++2Cl-
Na2SO4=2Na++SO2-
Ba2+、SO2-、Na+、Cl-
产生白色沉淀。溶液中Ba2+与SO42-结合生成不溶于水的硫酸钡
Ba2++SO42-=BaSO4↓
电解质在溶液中的反应实质是离子之间的反应
思考
阅读课本18页并写出BaCl2与Na2SO4之间的化学方程式与离子方程式,试着从微观的角度分析什么是离子反应以及其本质。
离子之间的反应,即有离子参加或有离子生成的化学反应。中学阶段所学的离子反应一般是指在溶液中进行的反应。
定义
离子反应使得溶液反应物中的某个离子浓度减小
本质
用实际参加反应的离子符号来表示反应的式子叫做离子方程式
离子 方程式
巩固新知
下列反应属于离子反应的是( )
A、C和O2反应生成CO2
B、锌片投入稀硫酸中
C、KMnO4加热分解制取 O2
D、NH 遇HCl气体生成白烟(NH4Cl小颗粒)
解析:电解质在溶液中的反应在实质上是离子之间的反应,这样的反应属于离子反应。
B
思考
电解质在水溶液中发生的反应属于离子反应,那么是否任意两种或多种电解质溶液混合都能够发生离子反应呢
①KCl溶液逐滴加入Na2SO4溶液:不反应
②BaCl2溶液逐滴加入Na2SO4溶液中:
Ba2++SO42-=BaSO4↓
离子反应的发生是否需要条件
探究
探究电解质溶液在发生离子反应时所需要的条件
举例 ①向硫酸溶液中滴加氯化钡溶液 ②向氢氧化钠溶液(含酚酞)中滴加盐酸 ③向碳酸钠溶液中滴加稀盐酸
现象
离子反应
分析
有白色沉淀生成
红色褪去
有无色无味气体产生
2H++CO32-=
HO-+CO2↑
Ba2++SO42-=BaSO4
H++OH-=H2O
生成沉淀使钡离子和硫酸根离子浓度减小
生成水,使氢离子和氢氧根离子浓度减小
生成气体,使氢离子和碳酸根离子浓度减小
离子反应产生的条件
条件:生成难溶物、易挥发性物质、难电离物质。
难溶物:钾钠铵硝皆可溶、盐酸不溶银亚汞;硫酸不溶钡和铅、碳酸只溶钾钠铵
易挥发性物质:氨水、浓盐酸、浓硝酸以及各种气体
难电离物质:弱酸、弱碱以及水
类型:复分解反应、有离子参加的氧化还原反应、盐类的水解
PART
02
离子方程式
离子方程式
用实际参加反应的离子符号来表示反应的式子叫做离子方程式
常见的离子方程式
生成沉淀,如:Ag++Cl-=AgCl↓、
生成气体,如:2H++CO32- =CO2↑+H2O
生成难电离物质,如:H++OH-=H2O
注:离子方程式≠电离方程式
思考
化学反应有化学方程式,离子反应也有离子方程式,而离子方程式跟化学方程式一样有它的一般书写步骤,同学们能总结归纳出来吗?
以 Na2SO4溶液与BaCl2溶液的反应为例
(1)写出反应的化学方程式:
(2)把易溶于水且易电离的物质(如强酸、强碱和大
部分可溶性盐)拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
2Na++ SO42-+ Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4 ↓
思考
化学反应有化学方程式,离子反应也有离子方程式,而离子方程式跟化学方程式一样有它的一般书写步骤,同学们能总结归纳出来吗?
以 Na2SO4溶液与BaCl2溶液的反应为例
(3)删去方程式两边不参加反应的离子,并将方程式
化为最简:
(4)检查离子方程式两边各元素的原子个数和电荷总
数是否相等。
Ba2+ + SO42- = BaSO4↓
离子方程式的书写归纳为:写、拆、删、查
巩固新知
1.下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O = 2H++Cl-+CIO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O = HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I:IO3-+I-+6H = I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:
HCO3-+Ba2++OH- = BaCO3↓+H2O
解析:注意可逆符号,沉淀符号,气体符号,以及原子个数和电荷总数是否相等
D
巩固新知
下列反应的离子方程式书写正确的是( )
A.含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-=Mg(OH)2 ↓
B.CaCO3溶于 CH3COOH:
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑ +H2O
C.过量HI溶液加入到Fe(NO3)3溶液中: Fe3++2I-=2Fe2++I2
D.SO2通入到溴水中:SO2+H2O+Br2=2H++SO42-+2Br-
B
离子方程式正误判断
基本方法(四原则)
①看是否符合客观事实。
如铜与稀盐酸不反应,铁与稀盐酸反应生成的是Fe2+而不可能是Fe3+,HI与Fe(NO3)3充分反应参与的物质有Fe3+、I-、NO3-等
②看拆分是否正确。如难溶的物质、气体和水不拆
③看是否符合原子守恒和电荷守恒。(配平)
④看是否漏写离子之间的反应。如Ba(OH)2与H2SO4的反应
离子方程式正误判断
特殊情况——量的问题
①“以少定多”
是指在离子方程式配平中,以量少的反应物为标准,通常将量少的反应物的系数规定为1,使少量反应物完全反应,进而推断出所需过量的反应物的系数,写出反应的离子方程式。
②氧化还原反应
若反应物中元素氧化性或还原性不同,则反应中会因相对量不同使得参与反应的离子先后顺序不同,从而引起反应后产物不同。解答此类问题的前提需要熟悉常见元素的氧化性或还原性相对强弱。
离子方程式正误判断
特殊情况——量的问题
①“以少定多”
以NaHCO3溶液与Ba(OH)2溶液反应为例:
NaHCO3过量:将Ba(OH)2的系数定为1,即把Ba(OH)2看作1mol,则含2mol OH-。 2mol OH-完全反应需要2mol HCO3-,反应得到2mol H2O 和 2 mol CO32-。因 Ba+为1mol,则1mol CO32-与 Ba+结合生成1 mol BaCO3沉淀,剩余CO32-:与Na+结合形成Na2CO3,因此反应产物为BaCO3、Na2CO3、H2O。
NaHCO3过量: 2NaHCO3+Ba(OH)2=BaCO3↓+Na2CO3+2H2O
离子反应方程式:2HCO3-+ Ba2++OH-=BaCO3↓+CO32-+H2O
离子方程式正误判断
特殊情况——量的问题
①“以少定多”
以NaHCO3溶液与Ba(OH)2溶液反应为例:
NaHCO3少量:将NaHCO3的系数定为1,即把NaHCO3看作1mol,则1mol HCO3-完全反应需要1molOH-,反应得到1mol H2O和1 mol CO32-。 1mol CO32-与 1mol Ba+反应生成1 mol BaCO3沉淀,剩余1mol OH-与Na+结合形成NaOH,因此产物为BaCO3、NaOH、H2O。
NaHCO3少量:NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O
离子方程式:HCO3-+ Ba++OH-=BaCO3↓+H2O
离子方程式正误判断
特殊情况——量的问题
①氧化还原反应
HI与Fe(NO3)3反应为例:
Fe(NO3) 溶液和HI溶液混合的反应是一种还原剂与多种氧化剂反应。
还原剂与强氧化剂反应后,还原剂才能与弱氧化剂反应。
在酸性条件下,氧化性:NO3﹣>Fe3+,在中性条件下,氧化性Fe3+>NO3﹣。
因此,当HI过量,硝酸根离子、铁离子都被还原,所以反应的化学方程式为:Fe(NO3)3+12HI=FeI2↓+5I2+3NO↑+6H2O。
当HI少量时,倍分硝酸根离子和铁离子被还原,反应的化学方程式为:2Fe(NO3)3+8HI=2Fe(NO3)3+4I2+2NO↑+4H2O。
写出HI过量与HI少量时
HI与Fe(NO3)3的离子方程式
酸碱中和的离子方程式
(1)填写下列表格(酸碱中和)
反应物 化学方程式 离子方程式
HCl + NaOH
HCl + KOH
H2SO4 + NaOH
H2SO4 + KOH
HCl + NaOH=
NaCl+H2O
H+ + OH- =H2O
HCl + KOH=
KCl+H2O
H2SO4 + 2NaOH=
Na2SO4+2H2O
H2SO4 + 2KOH=
K2SO4+2H2O
H+ + OH- =H2O
H+ + OH- =H2O
H+ + OH- =H2O
同学们试着自己书写Ba(OH)2与H2SO4的离子方程式看看是否为H+ + OH- =H2O?
酸碱中和的离子方程式
酸碱中和化学方程式与离子方程式的不同
① 离子方程式能方便的把实际参与反应的物质很清晰地反应出来。它不仅表示一定物质间的某个反应,而且表示了所有同一类型的离子反应,如酸碱中和
而化学方程式则重在表示参加反应和生成的物质,一个化学方程式只可表示一个反应。
② 离子方程式是用离子符号来写方程式,
而化学方程式是用物质的化学式来写的
PART
03
离子共存
离子共存
同学们我们已知离子反应产生的条件,那么我们要想让这些离子稳定存在在同一个体系中,又需要创造什么样的条件才能满足?
除此之外,有些离子还具有颜色能够帮助我们判断出溶液具有哪些离子,同学们又了解过多少有色离子呢?
离子共存
离子共存的条件:
①不生成难溶物(沉淀口诀)
②不生成易挥发性物质(氨水、浓盐酸、浓硝酸以及各种气体)
③不生成难电离物质(弱酸、弱碱以及水)
注:有色离子有Cu2+ (蓝色)、Fe2+ (浅绿色)、Fe3+ (棕黄色)
Mn2+ (浅粉色)、MnO4- (紫红色)、Fe3+遇到SCN-时(血红色)、
Cr2+(蓝绿色)、Cr3+(绿色)
巩固新知
下列各组离子一定能大量共存的是
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量 Ca2+的溶液中:Mg2+、Na+、Cl-、OH-
C.在强酸性溶液中:Na+、K+、Cl-、SO42-
D.在强碱性溶液中:K+、Na+、Cl-、NH4+
C
巩固新知
下列各组离子在溶液中既可以大量共存,且加入足量氢氧化钠溶液后也不产生沉淀的是( )
A.Na+ Ba2+ Cl- SO42-
B.K+ Na+ NO3- OH-
C.H+ NH4+ Fe3+ SO42-
D.H+ Cl- CO32 NO3-
B
PART
04
离子反应的应用
离子反应的应用
一、生活领域
1.家里的水壶使用久了往往出现水垢,这时我们可以用厨房里的食醋进行浸泡后再清晰
2.现在药店经常使用含NaHCO3或者Al(OH)3的药物来中和胃酸过多
HCO3 -+ H+ = H2O + CO2↑
Al(OH)3+ 3H+ =3H2O + Al3+
CaCO3 + CH3COOH = Ca2+ + CH3COO-+H2O + CO2↑
离子反应的应用
二、生产领域
1.氯碱工业:工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2)
2.粗盐提纯:去除Ca2+,Mg2+,SO42- ,K+等可溶性杂质,制取精盐
Ca2+,Mg2+,SO42-则可通过加入BaCl2、NaOH和Na2CO3溶液等沉淀剂,生成沉淀而除去,也可加入BaCO3固体和NaOH溶液来除去或通过重结晶法来除去K+。然后蒸发水分得到较纯净的精盐。
2Cl-+ 2H2O 2OH-+ Cl2+ H2↑
通电
离子反应的应用
三、科研领域
1.离子鉴定(阳离子)
铁离子(Fe3+)
①与 KSCN溶液反应,生成血红色物质Fe(SCN)3(硫氰化铁,难电离物质)
②与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀。
铜离子(Cu2+)
与碱反应,生成蓝色Cu(OH)2沉淀,加热后可转变为黑色固体CuO或红色Cu2O
银离子(Ag+)
加入盐酸,生成白色沉淀,白色沉淀为氯化银,沉淀不溶于稀硝酸,但溶于氨水,生成[Ag(NH3)2]+。
离子反应的应用
三、科研领域
1.离子鉴定(阴离子)
氯离子(Cl-)
先滴加稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,则含有(Cl-)。沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+.
溴离子(Br-)
能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。
碘离子(I-)
①能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸。
②能与氯水反应,生成I2,使淀粉溶液变蓝。
同学们知道如何同时检验Cl-、Br-、I-吗?
F-能跟Ag+反应生成沉淀吗?
离子反应的应用
三、科研领域
2.含量测定
酸碱中和滴定
①本质:H+ + OH- =H2O
②原理:
THANK YOU
THIS POWERPOINT DESIGNED BY CREATIVITY
第一章第二节
离子反应
1.2.2离子反应
高一必修一
1、分析酸碱盐的反应实质以及课本实验探究1-3,认识离子反应以及其本质,提高学生的证据推理能力。
2、掌握书写离子方程式的一般方法及其正误判断。
3、学会区分化学方程式与离子方程式,掌握离子方程式的一般模型以及相关反应类型。
课堂目标
目录
离子反应
01
离子方程式
02
离子反应的应用
04
离子共存问题
03
PART
01
离子反应
思考
结合课本P17实验1-3,完成实验,并填写下列表格。
实验操作 ②BaCl2溶液逐滴加入Na2SO4溶液中
电离方程式
主要离子
现象及原因
离子反应
实验结论
BaCl2=Ba2++2Cl-
Na2SO4=2Na++SO2-
Ba2+、SO2-、Na+、Cl-
产生白色沉淀。溶液中Ba2+与SO42-结合生成不溶于水的硫酸钡
Ba2++SO42-=BaSO4↓
电解质在溶液中的反应实质是离子之间的反应
思考
阅读课本18页并写出BaCl2与Na2SO4之间的化学方程式与离子方程式,试着从微观的角度分析什么是离子反应以及其本质。
离子之间的反应,即有离子参加或有离子生成的化学反应。中学阶段所学的离子反应一般是指在溶液中进行的反应。
定义
离子反应使得溶液反应物中的某个离子浓度减小
本质
用实际参加反应的离子符号来表示反应的式子叫做离子方程式
离子 方程式
巩固新知
下列反应属于离子反应的是( )
A、C和O2反应生成CO2
B、锌片投入稀硫酸中
C、KMnO4加热分解制取 O2
D、NH 遇HCl气体生成白烟(NH4Cl小颗粒)
解析:电解质在溶液中的反应在实质上是离子之间的反应,这样的反应属于离子反应。
B
思考
电解质在水溶液中发生的反应属于离子反应,那么是否任意两种或多种电解质溶液混合都能够发生离子反应呢
①KCl溶液逐滴加入Na2SO4溶液:不反应
②BaCl2溶液逐滴加入Na2SO4溶液中:
Ba2++SO42-=BaSO4↓
离子反应的发生是否需要条件
探究
探究电解质溶液在发生离子反应时所需要的条件
举例 ①向硫酸溶液中滴加氯化钡溶液 ②向氢氧化钠溶液(含酚酞)中滴加盐酸 ③向碳酸钠溶液中滴加稀盐酸
现象
离子反应
分析
有白色沉淀生成
红色褪去
有无色无味气体产生
2H++CO32-=
HO-+CO2↑
Ba2++SO42-=BaSO4
H++OH-=H2O
生成沉淀使钡离子和硫酸根离子浓度减小
生成水,使氢离子和氢氧根离子浓度减小
生成气体,使氢离子和碳酸根离子浓度减小
离子反应产生的条件
条件:生成难溶物、易挥发性物质、难电离物质。
难溶物:钾钠铵硝皆可溶、盐酸不溶银亚汞;硫酸不溶钡和铅、碳酸只溶钾钠铵
易挥发性物质:氨水、浓盐酸、浓硝酸以及各种气体
难电离物质:弱酸、弱碱以及水
类型:复分解反应、有离子参加的氧化还原反应、盐类的水解
PART
02
离子方程式
离子方程式
用实际参加反应的离子符号来表示反应的式子叫做离子方程式
常见的离子方程式
生成沉淀,如:Ag++Cl-=AgCl↓、
生成气体,如:2H++CO32- =CO2↑+H2O
生成难电离物质,如:H++OH-=H2O
注:离子方程式≠电离方程式
思考
化学反应有化学方程式,离子反应也有离子方程式,而离子方程式跟化学方程式一样有它的一般书写步骤,同学们能总结归纳出来吗?
以 Na2SO4溶液与BaCl2溶液的反应为例
(1)写出反应的化学方程式:
(2)把易溶于水且易电离的物质(如强酸、强碱和大
部分可溶性盐)拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
2Na++ SO42-+ Ba2+ + 2Cl- = 2Na+ + 2Cl- + BaSO4 ↓
思考
化学反应有化学方程式,离子反应也有离子方程式,而离子方程式跟化学方程式一样有它的一般书写步骤,同学们能总结归纳出来吗?
以 Na2SO4溶液与BaCl2溶液的反应为例
(3)删去方程式两边不参加反应的离子,并将方程式
化为最简:
(4)检查离子方程式两边各元素的原子个数和电荷总
数是否相等。
Ba2+ + SO42- = BaSO4↓
离子方程式的书写归纳为:写、拆、删、查
巩固新知
1.下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O = 2H++Cl-+CIO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O = HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I:IO3-+I-+6H = I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:
HCO3-+Ba2++OH- = BaCO3↓+H2O
解析:注意可逆符号,沉淀符号,气体符号,以及原子个数和电荷总数是否相等
D
巩固新知
下列反应的离子方程式书写正确的是( )
A.含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2++2OH-=Mg(OH)2 ↓
B.CaCO3溶于 CH3COOH:
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑ +H2O
C.过量HI溶液加入到Fe(NO3)3溶液中: Fe3++2I-=2Fe2++I2
D.SO2通入到溴水中:SO2+H2O+Br2=2H++SO42-+2Br-
B
离子方程式正误判断
基本方法(四原则)
①看是否符合客观事实。
如铜与稀盐酸不反应,铁与稀盐酸反应生成的是Fe2+而不可能是Fe3+,HI与Fe(NO3)3充分反应参与的物质有Fe3+、I-、NO3-等
②看拆分是否正确。如难溶的物质、气体和水不拆
③看是否符合原子守恒和电荷守恒。(配平)
④看是否漏写离子之间的反应。如Ba(OH)2与H2SO4的反应
离子方程式正误判断
特殊情况——量的问题
①“以少定多”
是指在离子方程式配平中,以量少的反应物为标准,通常将量少的反应物的系数规定为1,使少量反应物完全反应,进而推断出所需过量的反应物的系数,写出反应的离子方程式。
②氧化还原反应
若反应物中元素氧化性或还原性不同,则反应中会因相对量不同使得参与反应的离子先后顺序不同,从而引起反应后产物不同。解答此类问题的前提需要熟悉常见元素的氧化性或还原性相对强弱。
离子方程式正误判断
特殊情况——量的问题
①“以少定多”
以NaHCO3溶液与Ba(OH)2溶液反应为例:
NaHCO3过量:将Ba(OH)2的系数定为1,即把Ba(OH)2看作1mol,则含2mol OH-。 2mol OH-完全反应需要2mol HCO3-,反应得到2mol H2O 和 2 mol CO32-。因 Ba+为1mol,则1mol CO32-与 Ba+结合生成1 mol BaCO3沉淀,剩余CO32-:与Na+结合形成Na2CO3,因此反应产物为BaCO3、Na2CO3、H2O。
NaHCO3过量: 2NaHCO3+Ba(OH)2=BaCO3↓+Na2CO3+2H2O
离子反应方程式:2HCO3-+ Ba2++OH-=BaCO3↓+CO32-+H2O
离子方程式正误判断
特殊情况——量的问题
①“以少定多”
以NaHCO3溶液与Ba(OH)2溶液反应为例:
NaHCO3少量:将NaHCO3的系数定为1,即把NaHCO3看作1mol,则1mol HCO3-完全反应需要1molOH-,反应得到1mol H2O和1 mol CO32-。 1mol CO32-与 1mol Ba+反应生成1 mol BaCO3沉淀,剩余1mol OH-与Na+结合形成NaOH,因此产物为BaCO3、NaOH、H2O。
NaHCO3少量:NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O
离子方程式:HCO3-+ Ba++OH-=BaCO3↓+H2O
离子方程式正误判断
特殊情况——量的问题
①氧化还原反应
HI与Fe(NO3)3反应为例:
Fe(NO3) 溶液和HI溶液混合的反应是一种还原剂与多种氧化剂反应。
还原剂与强氧化剂反应后,还原剂才能与弱氧化剂反应。
在酸性条件下,氧化性:NO3﹣>Fe3+,在中性条件下,氧化性Fe3+>NO3﹣。
因此,当HI过量,硝酸根离子、铁离子都被还原,所以反应的化学方程式为:Fe(NO3)3+12HI=FeI2↓+5I2+3NO↑+6H2O。
当HI少量时,倍分硝酸根离子和铁离子被还原,反应的化学方程式为:2Fe(NO3)3+8HI=2Fe(NO3)3+4I2+2NO↑+4H2O。
写出HI过量与HI少量时
HI与Fe(NO3)3的离子方程式
酸碱中和的离子方程式
(1)填写下列表格(酸碱中和)
反应物 化学方程式 离子方程式
HCl + NaOH
HCl + KOH
H2SO4 + NaOH
H2SO4 + KOH
HCl + NaOH=
NaCl+H2O
H+ + OH- =H2O
HCl + KOH=
KCl+H2O
H2SO4 + 2NaOH=
Na2SO4+2H2O
H2SO4 + 2KOH=
K2SO4+2H2O
H+ + OH- =H2O
H+ + OH- =H2O
H+ + OH- =H2O
同学们试着自己书写Ba(OH)2与H2SO4的离子方程式看看是否为H+ + OH- =H2O?
酸碱中和的离子方程式
酸碱中和化学方程式与离子方程式的不同
① 离子方程式能方便的把实际参与反应的物质很清晰地反应出来。它不仅表示一定物质间的某个反应,而且表示了所有同一类型的离子反应,如酸碱中和
而化学方程式则重在表示参加反应和生成的物质,一个化学方程式只可表示一个反应。
② 离子方程式是用离子符号来写方程式,
而化学方程式是用物质的化学式来写的
PART
03
离子共存
离子共存
同学们我们已知离子反应产生的条件,那么我们要想让这些离子稳定存在在同一个体系中,又需要创造什么样的条件才能满足?
除此之外,有些离子还具有颜色能够帮助我们判断出溶液具有哪些离子,同学们又了解过多少有色离子呢?
离子共存
离子共存的条件:
①不生成难溶物(沉淀口诀)
②不生成易挥发性物质(氨水、浓盐酸、浓硝酸以及各种气体)
③不生成难电离物质(弱酸、弱碱以及水)
注:有色离子有Cu2+ (蓝色)、Fe2+ (浅绿色)、Fe3+ (棕黄色)
Mn2+ (浅粉色)、MnO4- (紫红色)、Fe3+遇到SCN-时(血红色)、
Cr2+(蓝绿色)、Cr3+(绿色)
巩固新知
下列各组离子一定能大量共存的是
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量 Ca2+的溶液中:Mg2+、Na+、Cl-、OH-
C.在强酸性溶液中:Na+、K+、Cl-、SO42-
D.在强碱性溶液中:K+、Na+、Cl-、NH4+
C
巩固新知
下列各组离子在溶液中既可以大量共存,且加入足量氢氧化钠溶液后也不产生沉淀的是( )
A.Na+ Ba2+ Cl- SO42-
B.K+ Na+ NO3- OH-
C.H+ NH4+ Fe3+ SO42-
D.H+ Cl- CO32 NO3-
B
PART
04
离子反应的应用
离子反应的应用
一、生活领域
1.家里的水壶使用久了往往出现水垢,这时我们可以用厨房里的食醋进行浸泡后再清晰
2.现在药店经常使用含NaHCO3或者Al(OH)3的药物来中和胃酸过多
HCO3 -+ H+ = H2O + CO2↑
Al(OH)3+ 3H+ =3H2O + Al3+
CaCO3 + CH3COOH = Ca2+ + CH3COO-+H2O + CO2↑
离子反应的应用
二、生产领域
1.氯碱工业:工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2)
2.粗盐提纯:去除Ca2+,Mg2+,SO42- ,K+等可溶性杂质,制取精盐
Ca2+,Mg2+,SO42-则可通过加入BaCl2、NaOH和Na2CO3溶液等沉淀剂,生成沉淀而除去,也可加入BaCO3固体和NaOH溶液来除去或通过重结晶法来除去K+。然后蒸发水分得到较纯净的精盐。
2Cl-+ 2H2O 2OH-+ Cl2+ H2↑
通电
离子反应的应用
三、科研领域
1.离子鉴定(阳离子)
铁离子(Fe3+)
①与 KSCN溶液反应,生成血红色物质Fe(SCN)3(硫氰化铁,难电离物质)
②与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀。
铜离子(Cu2+)
与碱反应,生成蓝色Cu(OH)2沉淀,加热后可转变为黑色固体CuO或红色Cu2O
银离子(Ag+)
加入盐酸,生成白色沉淀,白色沉淀为氯化银,沉淀不溶于稀硝酸,但溶于氨水,生成[Ag(NH3)2]+。
离子反应的应用
三、科研领域
1.离子鉴定(阴离子)
氯离子(Cl-)
先滴加稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀生成,则含有(Cl-)。沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+.
溴离子(Br-)
能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。
碘离子(I-)
①能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸。
②能与氯水反应,生成I2,使淀粉溶液变蓝。
同学们知道如何同时检验Cl-、Br-、I-吗?
F-能跟Ag+反应生成沉淀吗?
离子反应的应用
三、科研领域
2.含量测定
酸碱中和滴定
①本质:H+ + OH- =H2O
②原理:
THANK YOU
THIS POWERPOINT DESIGNED BY CREATIVITY
