1.2离子反应方程式与离子共存问题 课件(共34张PPT)2024-2025学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2离子反应方程式与离子共存问题 课件(共34张PPT)2024-2025学年高一化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 844.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 17:17:36 | ||
图片预览











文档简介
(共34张PPT)
第二节 离子反应
第一章
离子反应
1. 看是否符合反应的客观事实,如铁与稀硫酸反应:
2Fe+6H+=2Fe3+ + 3H2↑ (×)
2. 看是否拆分正确,如碳酸钙与盐酸反应:
CO32-+2H+=CO2↑ +H2O (×)
3. 看是否符合质量守恒,如钠与水的反应:
2Na +H2O=2Na+ +2OH +H2↑ (×)
“六看”
五、判断离子方程式的正误
Fe+2H+=Fe2+ + H2↑ (√)
CaCO3+2H+=Ca2+ + CO2↑+H2O (√)
2Na +2H2O=2Na+ +2OH + H2↑ (√)
4. 看是否符合电荷守恒,如铝和盐酸反应:
Al+2H+=Al3+ + H2↑ (×)
5. 看是否漏掉离子反应,如CuSO4和Ba(OH)2的反应:
Ba2+ + SO42-=BaSO4↓ (×)
Ba2+ +2OH + Cu2++ SO42-=BaSO4↓+ Cu(OH)2 ↓ (√)
6. 看反应物的配比是否正确,如稀硫酸与氢氧化钡溶液混合:
H+ + + Ba2+ + OH- = H2O + BaSO4↓( ×)
2H+ + + Ba2+ + 2OH- = 2H2O + BaSO4↓( √)
2Al + 6H+=2Al3+ + 3H2 ↑ (√)
“六看”
五、判断离子方程式的正误
判断下列反应的离子方程式是否正确,在括号中打“√”或“×”。
(1)盐酸与碳酸钡反应: + 2H+ =CO2↑ + H2O( )
(2)铝与盐酸反应:Al + 6H+ = Al3+ +3H2↑( )
(3)Mg与醋酸溶液反应:Mg + 2H+ = Mg2+ + H2↑( )(4)澄清石灰水与盐酸反应:Ca(OH)2 + 2H+ = 2H2O + Ca2+( )
(5)稀硫酸与氢氧化钡溶液混合:H+ + + Ba2+ + OH- = H2O + BaSO4↓( )
(6)铁与稀盐酸混合: 2Fe+ 6H+ = 2Fe3+ + 3H2↑( )(7)CuSO4和Ba(OH)2的反应:Ba2++SO42-=BaSO4↓( )
(8)钠与水的反应:2Na+H2O=2Na+ +2OH +H2↑( )
×
×
×
×
×
×
×
×
练一练
“六看”
五、判断离子方程式的正误
判断正误(正确的打“√”,错误的打“×”)
(4)浓盐酸与铁屑反应的离子方程式为2Fe+3H+===2Fe3++3H2↑( )
(5) Ag++Cl-===AgCl↓只能表示硝酸银溶液与氯化钠溶液的反应( )
√
×
×
×
×
×
√
练一练
下列离子方程式书写正确的是( )
A.铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.碳酸氢钠溶液加入盐酸中:HCO3-+H+=H2CO3
C.氢氧化钠和醋酸溶液反应:OH-+H+=H2O
D.氯化铁与氢氧化钾溶液反应:Fe3++3OH-=Fe(OH)3↓
D
练一练
下列反应的离子方程式书写正确的是( )
A.氧化铜与稀硫酸反应:
CuO+4H++SO42-=Cu2++SO2↑+2H2O
B.二氧化碳通入足量澄清石灰水中:
Ca2++2OH-+CO2=CaCO3↓+H2O
C.铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液与硫酸反应:OH-+H+=H2O
B
练一练
下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
D
练一练
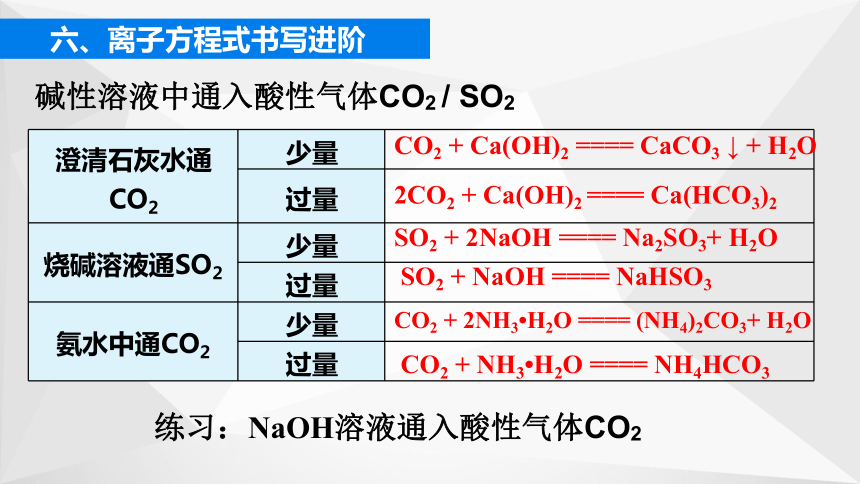
1. 离子反应中的“少量/过量”问题
(1)连续型
若反应的生成物能够和反应物继续反应,需要考虑离子是过量还是少量,即“产物是什么,比例是多少”的问题。
六、离子方程式书写进阶
1. 离子反应中的“少量/过量”问题
(1)连续型
一般情况下,少量CO2 / SO2 生成 / ,过量CO2 / SO2 生成 / HSO3-
过量时之所以生成 / HSO3-是由于发生了以下反应:
+ H2O + CO2 ==== 2 + H2O + SO2 ==== 2HSO3-
六、离子方程式书写进阶
澄清石灰水通CO2 少量
过量
烧碱溶液通SO2 少量
过量
氨水中通CO2 少量
过量
CO2 + Ca(OH)2 ==== CaCO3 ↓ + H2O
2CO2 + Ca(OH)2 ==== Ca(HCO3)2
SO2 + 2NaOH ==== Na2SO3+ H2O
SO2 + NaOH ==== NaHSO3
CO2 + 2NH3 H2O ==== (NH4)2CO3+ H2O
CO2 + NH3 H2O ==== NH4HCO3
碱性溶液中通入酸性气体CO2 / SO2
六、离子方程式书写进阶
练习:NaOH溶液通入酸性气体CO2
碳酸钠溶液中滴入稀盐酸 少量
过量
亚硫酸钠溶液滴入稀盐酸 少量
过量
硫化钠溶液滴入稀盐酸 少量
过量
Na2CO3 + HCl ==== NaHCO3 + NaCl
Na2CO3 + 2HCl ==== 2NaCl + H2O + CO2↑
Na2SO3 + HCl ==== NaHSO3 + NaCl
Na2SO3 + 2HCl ==== 2NaCl + H2O + SO2↑
Na2S + HCl ==== NaHS + NaCl
Na2S + 2HCl ==== 2NaCl + H2S↑
多元弱酸的正盐与酸的反应
六、离子方程式书写进阶
练习:Na2CO3溶液与少量稀硫酸
1. 离子反应中的“少量/过量”问题
(2)先后型
若反应体系中有两种或两种以上的离子,都能与另一种离子发生反应,但因反应顺序不同,离子方程式也不同。
六、离子方程式书写进阶
例如:若某溶液中含有Mg2+、H+,往该溶液中逐滴滴加NaOH溶液。
先跟H+反应,再和Mg2+反应,最后和反应
口诀:一中和二沉淀三弱质四溶解
多元弱酸的正盐与酸的反应
六、离子方程式书写进阶
硫酸氢铵与氢氧化钡反应,
Ba(OH)2 + NaHSO4 ==== H2O + BaSO4↓+ NaOH
Ba(OH)2 + 2NaHSO4 ==== 2H2O + BaSO4↓+ Na2SO4
1. 离子反应中的“少量/过量”问题
(3)配比型
若反应体系中有两种或两种以上的离子,都能与另一种离子发生反应,此时除了需要考虑反应的先后顺序外,还要考虑离子是过量还是少量,即“反应物是什么,比例是多少”的问题。
六、离子方程式书写进阶
往碳酸氢钙溶液中 逐滴滴加烧碱溶液 少量
过量
往澄清石灰水中 逐滴滴加小苏打溶液 少量
过量
往Ba(HCO3)2溶液中 逐滴滴加NaHSO4溶液 少量
过量
往Ba(OH)2溶液中 逐滴滴加NaHSO4溶液 少量
过量
Ca(HCO3)2 + NaOH ==== CaCO3 ↓+ NaHCO3 + H2O
Ca(HCO3)2 + 2NaOH ==== CaCO3 ↓+ Na2CO3 + 2H2O
Ca(OH)2 + NaHCO3 ==== H2O + CaCO3↓ + NaOH
Ca(OH)2 + 2NaHCO3 ==== 2H2O + CaCO3↓+ Na2CO3
Ba(HCO3)2 + NaHSO4 ==== H2O + CO2↑ + BaSO4↓+ NaHCO3
Ba(HCO3)2 + 2NaHSO4 ==== 2H2O + 2CO2↑ + BaSO4↓ + Na2SO4
酸式盐与H+ / OH- 的反应
六、离子方程式书写进阶
(1)用过量氨水吸收工业尾气中的SO2:
(2)过量二氧化硫气体通入氨水中:
(3)稀氨水中通入过量CO2:
(4)石灰水与过量碳酸氢钠溶液反应:
(5)NH4HCO3溶于过量的NaOH溶液中:
2NH3·H2O+SO2===2NH4++SO32-+H2O
SO2+NH3·H2O=HSO3-+NH4+
NH3·H2O+CO2 ==== NH4++ HCO3-
2HCO3 + Ca2+ + 2OH = CaCO3↓ + CO32 + 2H2O
NH4+ + HCO3- + 2OH- === CO32- + NH3·H2O + H2O
练一练
1. 写出下列离子方程式
(6)NH4HSO3溶液与足量NaOH溶液混合加热:
(7)硫酸氢钠溶液中加入氢氧化钡溶液至中性:
(8)Ca(HCO3)2溶液与少量NaOH溶液反应:
(9)向澄清石灰水中加入过量的NaHCO3溶液:
(10)向Ba(OH)2溶液中加入少量NaHSO3溶液:
NH4++ HSO3-+2OH-
NH3↑+ SO32-+2H2O
2H++SO4-+Ba2++2OH-===BaSO4↓+2H2O
HCO3-+Ca2++OH-=CaCO3↓+H2O
2HCO3 +Ca2++2OH = CaCO3↓+CO32 +2H2O
HSO3-+Ba2++OH-===BaSO3↓+H2O
1. 写出下列离子方程式
练一练
2. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液,写出满足下列条件时溶液中所发生反应的离子方程式。
(1)滴到恰好使溶液呈中性:
(2)滴到恰好使溶液中的SO42-沉淀完全:
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
练一练
Ba2++OH-+H++SO42- =BaSO4↓+H2O
(1) 生成沉淀而不能大量共存
判断原则:
溶解性表中不溶或微溶物质的阴、阳离子,不能大量共存。
碱:OH-与 Mg2+、Al3+ 、Cu2+、Fe3+ 、Fe2+ 、Ca2+ 、Zn2+等
盐: Ba2+与 CO32-、 SO42- ;
Ag+与 Cl-、 CO32-、 SO42-;
Ca2+与 CO32-、 SO42-;
离子能大量共存
——离子之间不参加反应
离子不能大量共存
——离子之间会参加反应
七、离子共存问题
1. 不能大量共存的情况
判断原则:有不稳定的酸或不稳定的碱生成。
NH4+与OH- ;H+与CO32-、HCO3-、SO32-、HSO3- 、 S2-、HS-等
(2)生成气体或挥发性物质而不能共存
七、离子共存问题
判断原则:有弱酸、弱碱和水等弱电解质的生成,它们在水溶液中主要以难电离的分子状态存在,因此不能大量共存。
H+ 与 OH-、HSO3- 、CH3COO- 、ClO- 等;
OH-与 NH4+生成弱碱;OH-与HCO3-、HSO3-、 HS-
(3)生成弱电解质而不能大量共存
判断原则:溶液中同时存在弱酸根和弱碱根离子。
Al3+和CO32-、HCO3--、S2- 、 AlO2-等。
(4)发生双水解反应而不能大量共存
七、离子共存问题
判断原则:常见的强氧化性离子和强还原性离子不能大量共存。
(5)发生氧化还原反应而不能大量共存
氧化性离子:如Fe3+、NO3- (在酸性条件下) 、ClO-、MnO4- (在酸性条件下)等;
还原性离子:如S2-、I-、Fe2+、SO32-等
判断原则:两种离子之间若能生成络合物则不能大量共存。
Fe3+和SCN-: Fe3++3SCN-=Fe(SCN)3
(6)发生络合反应而不能大量共存
七、离子共存问题
(1)溶液为无色透明时,则不存在Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫色)等
(2)强碱性溶液或使紫色石蕊变蓝,酚酞变红的溶液时,则溶液中存在大量OH-,不存在与OH- 反应的离子。
(3)强酸性溶液或使紫色石蕊变红的溶液则溶液中存在大量H+,不存在与H+反应的离子。
2. 题目中的隐含条件
七、离子共存问题
步骤1:认真审题,看清题目要求,是“大量共存”, 还是“不能共存”;
步骤2:挖掘试题隐含条件,判断溶液的酸碱性,有无颜色或其他限制条件;
步骤3:根据微粒共存知识,微粒之间不能生成沉淀、气体、弱电解质、发生双水解反应、发生氧化还原反应、发生络合反应等。
3. 解答离子共存类试题的一般步骤
七、离子共存问题
1. 检验离子的方法
八、离子检验
①生成沉淀;
②生成气体;
③显现特殊颜色。
2. 常见离子的检验
离子 试剂与操作 现象
OH- 酚酞 溶液变红
紫色石蕊溶液 溶液变蓝
Ag+ 含Cl-的溶液,稀硝酸 白色沉淀
加稀氨水至过量 先生成白色沉淀,然后沉淀溶解
Cu2+ 观察法 蓝色溶液
NaOH溶液 生成蓝色沉淀
八、离子检验
Cl- AgNO3溶液和稀HNO3 白色沉淀(AgCl)
Br- 淡黄色沉淀(AgBr)
I- 黄色沉淀(AgI)
先加足量的稀盐酸,再加BaCl2溶液 白色沉淀
加入足量稀盐酸,将产生的气体通入澄清石灰水 产生无色无味气体→澄清石灰水变浑浊
2. 常见离子的检验
八、离子检验
2. 常见离子的检验
八、离子检验
1. 在无色透明溶液中,能大量共存的离子组是 ( )
A. K+、Cu2+、NO3-、SO42-
B. K+、Na+、Cl-、CO32-
C. Mg2+、OH-、NO3-、Cl-
D. K+、Na+、MnO4-、SO42-
B
练一练
2、下列指定溶液之间的反应不能用离子方程式:
SO42-+Ba2+=BaSO4↓表示的是( )
A.Na2SO4与Ba(OH)2
B.MgSO4与BaCl2
C.H2SO4与Ba(OH)2
D.H2SO4与Ba(NO3)2
C
练一练
3. 判断正误:
(1)无色透明的溶液中:Fe3+、NH4+ 、I-、CO32- (______)
(2)无色透明的溶液中:K+、Cu2+、NO3- 、Cl-(______)
(3)澄清透明的溶液中:Fe3+、Mg2+、Br-、Cl-(______)
(4)使酚酞变红色的溶液中:Na+、Al3+、SO42- 、Cl-(______)
(5)使甲基橙变红的溶液中:Na+、Mg2+、SO42- 、 HCO3- (______)
【答案】错 错 对 错 错
练一练
4. 某河道两旁有甲、乙两厂,它们排放的工业废水中,共含 K+、Ag+、Fe3+、Cl-、OH-、NO3- 六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_______、____、___________。
(2)乙厂的废水中含有另外三种离子。如果加一定量的__________(填“活性炭”或“铁粉”), 可以回收其中的______________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含__________ , 可用来浇灌农田。
【答案】OH- Cl- K+ 铁粉 Ag Ag+、Fe3+、Cl-、OH- KNO3
练一练
第二节 离子反应
第一章
离子反应
1. 看是否符合反应的客观事实,如铁与稀硫酸反应:
2Fe+6H+=2Fe3+ + 3H2↑ (×)
2. 看是否拆分正确,如碳酸钙与盐酸反应:
CO32-+2H+=CO2↑ +H2O (×)
3. 看是否符合质量守恒,如钠与水的反应:
2Na +H2O=2Na+ +2OH +H2↑ (×)
“六看”
五、判断离子方程式的正误
Fe+2H+=Fe2+ + H2↑ (√)
CaCO3+2H+=Ca2+ + CO2↑+H2O (√)
2Na +2H2O=2Na+ +2OH + H2↑ (√)
4. 看是否符合电荷守恒,如铝和盐酸反应:
Al+2H+=Al3+ + H2↑ (×)
5. 看是否漏掉离子反应,如CuSO4和Ba(OH)2的反应:
Ba2+ + SO42-=BaSO4↓ (×)
Ba2+ +2OH + Cu2++ SO42-=BaSO4↓+ Cu(OH)2 ↓ (√)
6. 看反应物的配比是否正确,如稀硫酸与氢氧化钡溶液混合:
H+ + + Ba2+ + OH- = H2O + BaSO4↓( ×)
2H+ + + Ba2+ + 2OH- = 2H2O + BaSO4↓( √)
2Al + 6H+=2Al3+ + 3H2 ↑ (√)
“六看”
五、判断离子方程式的正误
判断下列反应的离子方程式是否正确,在括号中打“√”或“×”。
(1)盐酸与碳酸钡反应: + 2H+ =CO2↑ + H2O( )
(2)铝与盐酸反应:Al + 6H+ = Al3+ +3H2↑( )
(3)Mg与醋酸溶液反应:Mg + 2H+ = Mg2+ + H2↑( )(4)澄清石灰水与盐酸反应:Ca(OH)2 + 2H+ = 2H2O + Ca2+( )
(5)稀硫酸与氢氧化钡溶液混合:H+ + + Ba2+ + OH- = H2O + BaSO4↓( )
(6)铁与稀盐酸混合: 2Fe+ 6H+ = 2Fe3+ + 3H2↑( )(7)CuSO4和Ba(OH)2的反应:Ba2++SO42-=BaSO4↓( )
(8)钠与水的反应:2Na+H2O=2Na+ +2OH +H2↑( )
×
×
×
×
×
×
×
×
练一练
“六看”
五、判断离子方程式的正误
判断正误(正确的打“√”,错误的打“×”)
(4)浓盐酸与铁屑反应的离子方程式为2Fe+3H+===2Fe3++3H2↑( )
(5) Ag++Cl-===AgCl↓只能表示硝酸银溶液与氯化钠溶液的反应( )
√
×
×
×
×
×
√
练一练
下列离子方程式书写正确的是( )
A.铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.碳酸氢钠溶液加入盐酸中:HCO3-+H+=H2CO3
C.氢氧化钠和醋酸溶液反应:OH-+H+=H2O
D.氯化铁与氢氧化钾溶液反应:Fe3++3OH-=Fe(OH)3↓
D
练一练
下列反应的离子方程式书写正确的是( )
A.氧化铜与稀硫酸反应:
CuO+4H++SO42-=Cu2++SO2↑+2H2O
B.二氧化碳通入足量澄清石灰水中:
Ca2++2OH-+CO2=CaCO3↓+H2O
C.铁和盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液与硫酸反应:OH-+H+=H2O
B
练一练
下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
D
练一练
1. 离子反应中的“少量/过量”问题
(1)连续型
若反应的生成物能够和反应物继续反应,需要考虑离子是过量还是少量,即“产物是什么,比例是多少”的问题。
六、离子方程式书写进阶
1. 离子反应中的“少量/过量”问题
(1)连续型
一般情况下,少量CO2 / SO2 生成 / ,过量CO2 / SO2 生成 / HSO3-
过量时之所以生成 / HSO3-是由于发生了以下反应:
+ H2O + CO2 ==== 2 + H2O + SO2 ==== 2HSO3-
六、离子方程式书写进阶
澄清石灰水通CO2 少量
过量
烧碱溶液通SO2 少量
过量
氨水中通CO2 少量
过量
CO2 + Ca(OH)2 ==== CaCO3 ↓ + H2O
2CO2 + Ca(OH)2 ==== Ca(HCO3)2
SO2 + 2NaOH ==== Na2SO3+ H2O
SO2 + NaOH ==== NaHSO3
CO2 + 2NH3 H2O ==== (NH4)2CO3+ H2O
CO2 + NH3 H2O ==== NH4HCO3
碱性溶液中通入酸性气体CO2 / SO2
六、离子方程式书写进阶
练习:NaOH溶液通入酸性气体CO2
碳酸钠溶液中滴入稀盐酸 少量
过量
亚硫酸钠溶液滴入稀盐酸 少量
过量
硫化钠溶液滴入稀盐酸 少量
过量
Na2CO3 + HCl ==== NaHCO3 + NaCl
Na2CO3 + 2HCl ==== 2NaCl + H2O + CO2↑
Na2SO3 + HCl ==== NaHSO3 + NaCl
Na2SO3 + 2HCl ==== 2NaCl + H2O + SO2↑
Na2S + HCl ==== NaHS + NaCl
Na2S + 2HCl ==== 2NaCl + H2S↑
多元弱酸的正盐与酸的反应
六、离子方程式书写进阶
练习:Na2CO3溶液与少量稀硫酸
1. 离子反应中的“少量/过量”问题
(2)先后型
若反应体系中有两种或两种以上的离子,都能与另一种离子发生反应,但因反应顺序不同,离子方程式也不同。
六、离子方程式书写进阶
例如:若某溶液中含有Mg2+、H+,往该溶液中逐滴滴加NaOH溶液。
先跟H+反应,再和Mg2+反应,最后和反应
口诀:一中和二沉淀三弱质四溶解
多元弱酸的正盐与酸的反应
六、离子方程式书写进阶
硫酸氢铵与氢氧化钡反应,
Ba(OH)2 + NaHSO4 ==== H2O + BaSO4↓+ NaOH
Ba(OH)2 + 2NaHSO4 ==== 2H2O + BaSO4↓+ Na2SO4
1. 离子反应中的“少量/过量”问题
(3)配比型
若反应体系中有两种或两种以上的离子,都能与另一种离子发生反应,此时除了需要考虑反应的先后顺序外,还要考虑离子是过量还是少量,即“反应物是什么,比例是多少”的问题。
六、离子方程式书写进阶
往碳酸氢钙溶液中 逐滴滴加烧碱溶液 少量
过量
往澄清石灰水中 逐滴滴加小苏打溶液 少量
过量
往Ba(HCO3)2溶液中 逐滴滴加NaHSO4溶液 少量
过量
往Ba(OH)2溶液中 逐滴滴加NaHSO4溶液 少量
过量
Ca(HCO3)2 + NaOH ==== CaCO3 ↓+ NaHCO3 + H2O
Ca(HCO3)2 + 2NaOH ==== CaCO3 ↓+ Na2CO3 + 2H2O
Ca(OH)2 + NaHCO3 ==== H2O + CaCO3↓ + NaOH
Ca(OH)2 + 2NaHCO3 ==== 2H2O + CaCO3↓+ Na2CO3
Ba(HCO3)2 + NaHSO4 ==== H2O + CO2↑ + BaSO4↓+ NaHCO3
Ba(HCO3)2 + 2NaHSO4 ==== 2H2O + 2CO2↑ + BaSO4↓ + Na2SO4
酸式盐与H+ / OH- 的反应
六、离子方程式书写进阶
(1)用过量氨水吸收工业尾气中的SO2:
(2)过量二氧化硫气体通入氨水中:
(3)稀氨水中通入过量CO2:
(4)石灰水与过量碳酸氢钠溶液反应:
(5)NH4HCO3溶于过量的NaOH溶液中:
2NH3·H2O+SO2===2NH4++SO32-+H2O
SO2+NH3·H2O=HSO3-+NH4+
NH3·H2O+CO2 ==== NH4++ HCO3-
2HCO3 + Ca2+ + 2OH = CaCO3↓ + CO32 + 2H2O
NH4+ + HCO3- + 2OH- === CO32- + NH3·H2O + H2O
练一练
1. 写出下列离子方程式
(6)NH4HSO3溶液与足量NaOH溶液混合加热:
(7)硫酸氢钠溶液中加入氢氧化钡溶液至中性:
(8)Ca(HCO3)2溶液与少量NaOH溶液反应:
(9)向澄清石灰水中加入过量的NaHCO3溶液:
(10)向Ba(OH)2溶液中加入少量NaHSO3溶液:
NH4++ HSO3-+2OH-
NH3↑+ SO32-+2H2O
2H++SO4-+Ba2++2OH-===BaSO4↓+2H2O
HCO3-+Ca2++OH-=CaCO3↓+H2O
2HCO3 +Ca2++2OH = CaCO3↓+CO32 +2H2O
HSO3-+Ba2++OH-===BaSO3↓+H2O
1. 写出下列离子方程式
练一练
2. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液,写出满足下列条件时溶液中所发生反应的离子方程式。
(1)滴到恰好使溶液呈中性:
(2)滴到恰好使溶液中的SO42-沉淀完全:
Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O
练一练
Ba2++OH-+H++SO42- =BaSO4↓+H2O
(1) 生成沉淀而不能大量共存
判断原则:
溶解性表中不溶或微溶物质的阴、阳离子,不能大量共存。
碱:OH-与 Mg2+、Al3+ 、Cu2+、Fe3+ 、Fe2+ 、Ca2+ 、Zn2+等
盐: Ba2+与 CO32-、 SO42- ;
Ag+与 Cl-、 CO32-、 SO42-;
Ca2+与 CO32-、 SO42-;
离子能大量共存
——离子之间不参加反应
离子不能大量共存
——离子之间会参加反应
七、离子共存问题
1. 不能大量共存的情况
判断原则:有不稳定的酸或不稳定的碱生成。
NH4+与OH- ;H+与CO32-、HCO3-、SO32-、HSO3- 、 S2-、HS-等
(2)生成气体或挥发性物质而不能共存
七、离子共存问题
判断原则:有弱酸、弱碱和水等弱电解质的生成,它们在水溶液中主要以难电离的分子状态存在,因此不能大量共存。
H+ 与 OH-、HSO3- 、CH3COO- 、ClO- 等;
OH-与 NH4+生成弱碱;OH-与HCO3-、HSO3-、 HS-
(3)生成弱电解质而不能大量共存
判断原则:溶液中同时存在弱酸根和弱碱根离子。
Al3+和CO32-、HCO3--、S2- 、 AlO2-等。
(4)发生双水解反应而不能大量共存
七、离子共存问题
判断原则:常见的强氧化性离子和强还原性离子不能大量共存。
(5)发生氧化还原反应而不能大量共存
氧化性离子:如Fe3+、NO3- (在酸性条件下) 、ClO-、MnO4- (在酸性条件下)等;
还原性离子:如S2-、I-、Fe2+、SO32-等
判断原则:两种离子之间若能生成络合物则不能大量共存。
Fe3+和SCN-: Fe3++3SCN-=Fe(SCN)3
(6)发生络合反应而不能大量共存
七、离子共存问题
(1)溶液为无色透明时,则不存在Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫色)等
(2)强碱性溶液或使紫色石蕊变蓝,酚酞变红的溶液时,则溶液中存在大量OH-,不存在与OH- 反应的离子。
(3)强酸性溶液或使紫色石蕊变红的溶液则溶液中存在大量H+,不存在与H+反应的离子。
2. 题目中的隐含条件
七、离子共存问题
步骤1:认真审题,看清题目要求,是“大量共存”, 还是“不能共存”;
步骤2:挖掘试题隐含条件,判断溶液的酸碱性,有无颜色或其他限制条件;
步骤3:根据微粒共存知识,微粒之间不能生成沉淀、气体、弱电解质、发生双水解反应、发生氧化还原反应、发生络合反应等。
3. 解答离子共存类试题的一般步骤
七、离子共存问题
1. 检验离子的方法
八、离子检验
①生成沉淀;
②生成气体;
③显现特殊颜色。
2. 常见离子的检验
离子 试剂与操作 现象
OH- 酚酞 溶液变红
紫色石蕊溶液 溶液变蓝
Ag+ 含Cl-的溶液,稀硝酸 白色沉淀
加稀氨水至过量 先生成白色沉淀,然后沉淀溶解
Cu2+ 观察法 蓝色溶液
NaOH溶液 生成蓝色沉淀
八、离子检验
Cl- AgNO3溶液和稀HNO3 白色沉淀(AgCl)
Br- 淡黄色沉淀(AgBr)
I- 黄色沉淀(AgI)
先加足量的稀盐酸,再加BaCl2溶液 白色沉淀
加入足量稀盐酸,将产生的气体通入澄清石灰水 产生无色无味气体→澄清石灰水变浑浊
2. 常见离子的检验
八、离子检验
2. 常见离子的检验
八、离子检验
1. 在无色透明溶液中,能大量共存的离子组是 ( )
A. K+、Cu2+、NO3-、SO42-
B. K+、Na+、Cl-、CO32-
C. Mg2+、OH-、NO3-、Cl-
D. K+、Na+、MnO4-、SO42-
B
练一练
2、下列指定溶液之间的反应不能用离子方程式:
SO42-+Ba2+=BaSO4↓表示的是( )
A.Na2SO4与Ba(OH)2
B.MgSO4与BaCl2
C.H2SO4与Ba(OH)2
D.H2SO4与Ba(NO3)2
C
练一练
3. 判断正误:
(1)无色透明的溶液中:Fe3+、NH4+ 、I-、CO32- (______)
(2)无色透明的溶液中:K+、Cu2+、NO3- 、Cl-(______)
(3)澄清透明的溶液中:Fe3+、Mg2+、Br-、Cl-(______)
(4)使酚酞变红色的溶液中:Na+、Al3+、SO42- 、Cl-(______)
(5)使甲基橙变红的溶液中:Na+、Mg2+、SO42- 、 HCO3- (______)
【答案】错 错 对 错 错
练一练
4. 某河道两旁有甲、乙两厂,它们排放的工业废水中,共含 K+、Ag+、Fe3+、Cl-、OH-、NO3- 六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_______、____、___________。
(2)乙厂的废水中含有另外三种离子。如果加一定量的__________(填“活性炭”或“铁粉”), 可以回收其中的______________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含__________ , 可用来浇灌农田。
【答案】OH- Cl- K+ 铁粉 Ag Ag+、Fe3+、Cl-、OH- KNO3
练一练
