1.2+离子反应第1课时课件(共37张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2+离子反应第1课时课件(共37张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 17:18:17 | ||
图片预览










文档简介
(共37张PPT)
电解质的电离
第一章 物质及其变化
粤盐生产基地——雷州盐场
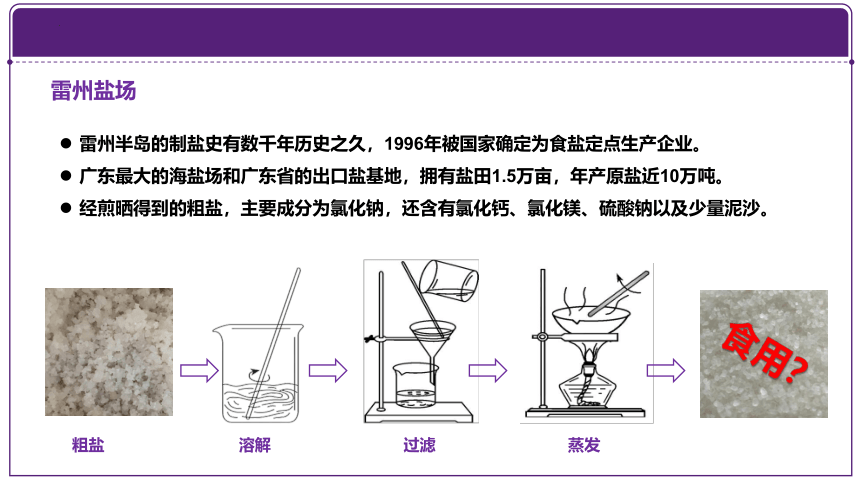
雷州盐场
雷州半岛的制盐史有数千年历史之久,1996年被国家确定为食盐定点生产企业。
广东最大的海盐场和广东省的出口盐基地,拥有盐田1.5万亩,年产原盐近10万吨。
经煎晒得到的粗盐,主要成分为氯化钠,还含有氯化钙、氯化镁、硫酸钠以及少量泥沙。
粗盐
溶解
过滤
蒸发
食用?
资料卡片
我国古代所生产的盐基本上都是粗盐。以井盐为例,20世纪20年代,对川盐进行化验后,发现盐质相差很大。冠绝天下的富荣盐场生产的优质花盐,其成分含量为:氯化钠94.72%,水分1.08%,夹杂物3.60%。质劣的如大宁盐场生产的炭花盐:氯化钠48.82%,水分8.70%,夹杂物42.48%。
当粗盐中含有氯化钙时,容易在蒸发时结垢。当粗盐中含有七水硫酸镁时,人食用后,会导致腹泻。粗盐中含有硫酸钠和硫酸镁都会使盐呈现苦味。川盐含有氯化钡,历来误食者众。轻者恶心呕吐,四肢麻木,腹泻腹痛,周身疲软乏力,俗称“软病”;重者肠胃痉挛,心跳加剧,血压升高,数日而亡。
假设你们现在就是雷州盐场的化工工程师,你会如何除去粗盐中的氯化钙杂质
利用所提供的仪器和药品,试一试你的方案是否可行?用化学语言表达所涉及的化学反应原理。
药品:粗盐固体、碳酸钠固体、蒸馏水。
任务1
NaCl(CaCl2、MgCl2、Na2SO4)
NaCl
粗盐+碳酸钠
粗盐水溶液+碳酸钠溶液
任务2
物质进入溶液前后有什么不同?
任务2
物质进入溶液前后有什么不同?
从微观角度看,氯化钠进入溶液前后有什么不同
左下图是氯化钠固体的微观示意图,请同学们画出氯化钠进入溶液后的微观示意图,并阐述氯化钠固体与氯化钠溶液的不同。
············
NaCl固体
加水溶解
?
任务2
物质进入溶液前后有什么不同?
从微观角度看,氯化钠进入溶液前后有什么不同
左下图是氯化钠固体的微观示意图,请同学们画出氯化钠进入溶液后的微观示意图,并阐述氯化钠固体与氯化钠溶液的不同。
············
NaCl固体
加水溶解
自由移动
的Na+和Cl-
如何证明呢?
NaCl固体和蒸馏水的导电性实验
为什么NaCl固体加入水中,能产生自由移动的Na+和Cl- ?
固体氯化钠中,Na+和Cl-按一定的规则紧密的排列,在位置附近振动,Na+和Cl-之间有较强的静电作用,不能自由移动。
加水溶解
当将NaCl固体加入水中时,在水分子的作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子。
-
-
一定条件下,解离成能自由移动离子的过程称为电离
NaCl = Na+ + Cl-
表征电离过程的方程式就是电离方程式
熔融NaCl导电性实验
概括总结
在水溶液或熔融状态下,能发生电离的化合物称为电解质。
从物质类别角度来看,酸、碱、盐和金属氧化物是常见的电解质
尝试写出CaCl2、Na2SO4、MgSO4的电离方程式
CaCl2 = Ca2+ + 2Cl-
Na2SO4 = 2Na+ + SO42-
MgSO4 = Mg2+ + SO42-
从电离的角度认识酸和碱,书写电离方程式,归纳酸和碱的概念。
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3= H+ + NO3-
酸:电离时生成的阳离子
全部是H+的化合物
NaOH = Na+ + OH-
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
碱:电离时生成的阴离子
全部是OH-的化合物
任务3:
从微观角度看粗盐溶液的组成,你有哪些新认识,请画出粗盐溶液的微观示意图,同时讨论:你认为粗盐中的杂质是什么?为什么?
NaCl(CaCl2、MgCl2、Na2SO4)
?
离子方程式的书写
第一章 物质及其变化
任务4:
1.小组合作,先画出右侧烧杯Na2CO3溶液的微观组成,再试着演示出两个溶液混合之后的微观过程。
混合
宏观
微观
粗盐溶液
Na2CO3
溶液
混合
?
Ca2+浓度变化曲线
证据推理
结合以上证据,试着书写除Ca2+过程的离子反应方程式。
Ca2+ + CO32- =CaCO3↓
【梳理】
通过上面粗盐溶液中加入Na2CO3的反应,你对酸、碱、盐在溶液中的反应有什么新的认识?
任务5:
选择合适试剂完成粗盐溶液中Mg2+和SO42-的除杂任务,写出除杂的离子方程式。
【课后任务】
设计除去粗盐溶液中杂质制取精盐的完整方案。
要求:除干净、操作简便、成本低。
请写出方案流程以及必要的实验操作,包括每一步溶液中的离子及生成的沉淀,每一步反应的离子方程式。
流程示例:
粗盐溶液
Na2CO3溶液
过滤
CaCO3
Na+、Cl-、Mg2+、Ca2+、SO42-
Na+、Cl-、Mg2+、SO42-、CO32-
溶液1
离子方程式书写训练
离子反应的应用
第一章 物质及其变化
环节一:食盐精制方案的交流改进
环节一:食盐精制方案的交流改进
问题1:各杂质离子分别选用哪些除杂试剂除去?
问题2:除杂试剂用量如何选择?
问题3:引入的杂质离子如何除去?
问题4:除杂的具体顺序如何确定?过滤步骤能否合并?
问题5:为什么用盐酸试剂收尾?为什么加盐酸前需要过滤?
问题6:为什么钙盐、氢氧化钙比钡盐、氢氧化钡常用?
纯净度、简洁性、成本
多种离子除杂方案确定
第一步:确定各杂质离子除杂试剂
第二步:确定引入杂质离子除杂试剂
第三步:合并相同除杂试剂,确定最佳除杂顺序(先难后易)
环节一:食盐精制方案的交流改进
环节二:食盐精制方案的实施与反思
问题1:怎么证明粗盐溶液中存在杂质离子?
问题2:怎么证明粗盐溶液中杂质离子已经完全沉淀?
取样,加入检验试剂,根据现象得出结论
将反应混合液静置,向上层液中继续加入几滴沉淀剂,根据现象得出结论
问题3:一般最终控制溶液的pH约为4,怎么测定溶液的pH?
静置环节可以用离心机离心代替,节约时间。
将一小块pH试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到pH试纸中央,待变色稳定后再和标准比色卡对照,读出对应的pH。
问题4:能否直接选用Ba(OH)2溶液沉淀Mg2+和SO42-
优点:步骤简化,节约时间。
缺点:杂质量不确定,容易造成试剂浪费,增大成本。
环节三:真实工业情境食盐精制方案的分析与评价
生成胶体有何影响?如何控制沉淀环节条件?
减压过滤和真空蒸发的目的是?
该工艺还有哪些值得关注的点?
离子反应归纳整理
第一章 物质及其变化
KNO3 BaCl2 CaCO3 HClO4
Ba(OH)2 NH4NO3 NaHCO3 NaHSO4(溶液和熔融)
练习1:写出下列物质电离方程式:
练习2:写出下列离子方程式:
(1)H2SO4 + NaOH:_________________________________________________;
(2)H2SO4+Ba(OH)2:________________________________________________。
(3)Mg + H2SO4:____________________________________________________;
(4)MgO + HCl:_____________________________________________________。
(5)NaOH + CH3COOH:______________________________________________;
(6)Ca(OH)2 (澄清石灰水) + CO2(少量):_________________________________。
练习3:判断下列离子方程式是否正确并说明理由
(1)铁与稀盐酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑
(2)FeCl3与Fe反应:Fe3+ + Fe = 2Fe2+
(3)硫酸和Ba(OH)2溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O
(4)碳酸钡和稀硝酸反应:CO32-+2H+ = H2O + CO2↑
(5)硫酸镁和Ba(OH)2溶液反应:Ba2+ + SO42- = BaSO4↓
练习4:下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cl-、SO42-
B.Na+、CO32-、SO42-、Cl-
C.NO、Na+、HCO3-、Ba2+
D.Na+、NO3-、H+、SO42-
练习5:下列说法中正确的是( )
A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+
B.能使石蕊试液变红的溶液中可能含有Cl-、K+、Na+、NO3-
C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42-
D.用H++OH-=H2O可描述醋酸与Ba(OH)2反应的实质
练习6:某溶液的溶质可能由下列离子组成:Cl-、SO42-、 CO32- 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将(1)中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。依据以上实验可以推断,原溶液中一定含有 ;一定没有 ;可能含有________。
SO42-、 CO32- 、Na+
H+、Ba2+
Cl-
电解质的电离
第一章 物质及其变化
粤盐生产基地——雷州盐场
雷州盐场
雷州半岛的制盐史有数千年历史之久,1996年被国家确定为食盐定点生产企业。
广东最大的海盐场和广东省的出口盐基地,拥有盐田1.5万亩,年产原盐近10万吨。
经煎晒得到的粗盐,主要成分为氯化钠,还含有氯化钙、氯化镁、硫酸钠以及少量泥沙。
粗盐
溶解
过滤
蒸发
食用?
资料卡片
我国古代所生产的盐基本上都是粗盐。以井盐为例,20世纪20年代,对川盐进行化验后,发现盐质相差很大。冠绝天下的富荣盐场生产的优质花盐,其成分含量为:氯化钠94.72%,水分1.08%,夹杂物3.60%。质劣的如大宁盐场生产的炭花盐:氯化钠48.82%,水分8.70%,夹杂物42.48%。
当粗盐中含有氯化钙时,容易在蒸发时结垢。当粗盐中含有七水硫酸镁时,人食用后,会导致腹泻。粗盐中含有硫酸钠和硫酸镁都会使盐呈现苦味。川盐含有氯化钡,历来误食者众。轻者恶心呕吐,四肢麻木,腹泻腹痛,周身疲软乏力,俗称“软病”;重者肠胃痉挛,心跳加剧,血压升高,数日而亡。
假设你们现在就是雷州盐场的化工工程师,你会如何除去粗盐中的氯化钙杂质
利用所提供的仪器和药品,试一试你的方案是否可行?用化学语言表达所涉及的化学反应原理。
药品:粗盐固体、碳酸钠固体、蒸馏水。
任务1
NaCl(CaCl2、MgCl2、Na2SO4)
NaCl
粗盐+碳酸钠
粗盐水溶液+碳酸钠溶液
任务2
物质进入溶液前后有什么不同?
任务2
物质进入溶液前后有什么不同?
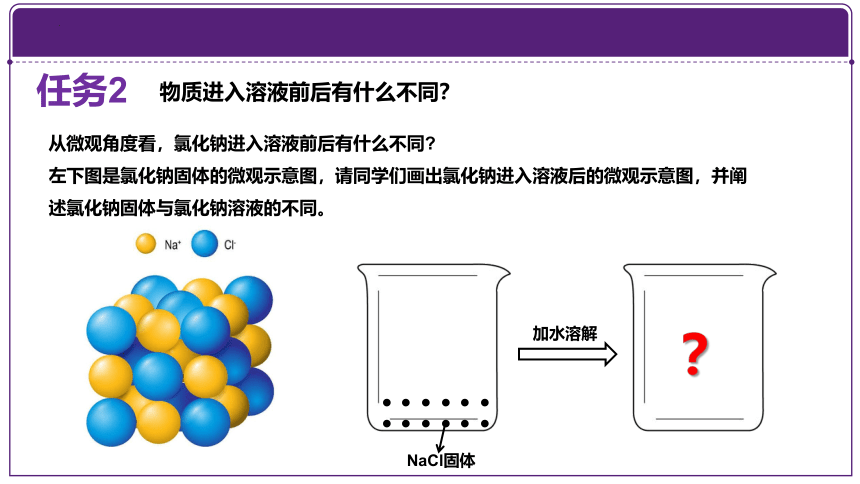
从微观角度看,氯化钠进入溶液前后有什么不同
左下图是氯化钠固体的微观示意图,请同学们画出氯化钠进入溶液后的微观示意图,并阐述氯化钠固体与氯化钠溶液的不同。
············
NaCl固体
加水溶解
?
任务2
物质进入溶液前后有什么不同?
从微观角度看,氯化钠进入溶液前后有什么不同
左下图是氯化钠固体的微观示意图,请同学们画出氯化钠进入溶液后的微观示意图,并阐述氯化钠固体与氯化钠溶液的不同。
············
NaCl固体
加水溶解
自由移动
的Na+和Cl-
如何证明呢?
NaCl固体和蒸馏水的导电性实验
为什么NaCl固体加入水中,能产生自由移动的Na+和Cl- ?
固体氯化钠中,Na+和Cl-按一定的规则紧密的排列,在位置附近振动,Na+和Cl-之间有较强的静电作用,不能自由移动。
加水溶解
当将NaCl固体加入水中时,在水分子的作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子。
-
-
一定条件下,解离成能自由移动离子的过程称为电离
NaCl = Na+ + Cl-
表征电离过程的方程式就是电离方程式
熔融NaCl导电性实验
概括总结
在水溶液或熔融状态下,能发生电离的化合物称为电解质。
从物质类别角度来看,酸、碱、盐和金属氧化物是常见的电解质
尝试写出CaCl2、Na2SO4、MgSO4的电离方程式
CaCl2 = Ca2+ + 2Cl-
Na2SO4 = 2Na+ + SO42-
MgSO4 = Mg2+ + SO42-
从电离的角度认识酸和碱,书写电离方程式,归纳酸和碱的概念。
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3= H+ + NO3-
酸:电离时生成的阳离子
全部是H+的化合物
NaOH = Na+ + OH-
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
碱:电离时生成的阴离子
全部是OH-的化合物
任务3:
从微观角度看粗盐溶液的组成,你有哪些新认识,请画出粗盐溶液的微观示意图,同时讨论:你认为粗盐中的杂质是什么?为什么?
NaCl(CaCl2、MgCl2、Na2SO4)
?
离子方程式的书写
第一章 物质及其变化
任务4:
1.小组合作,先画出右侧烧杯Na2CO3溶液的微观组成,再试着演示出两个溶液混合之后的微观过程。
混合
宏观
微观
粗盐溶液
Na2CO3
溶液
混合
?
Ca2+浓度变化曲线
证据推理
结合以上证据,试着书写除Ca2+过程的离子反应方程式。
Ca2+ + CO32- =CaCO3↓
【梳理】
通过上面粗盐溶液中加入Na2CO3的反应,你对酸、碱、盐在溶液中的反应有什么新的认识?
任务5:
选择合适试剂完成粗盐溶液中Mg2+和SO42-的除杂任务,写出除杂的离子方程式。
【课后任务】
设计除去粗盐溶液中杂质制取精盐的完整方案。
要求:除干净、操作简便、成本低。
请写出方案流程以及必要的实验操作,包括每一步溶液中的离子及生成的沉淀,每一步反应的离子方程式。
流程示例:
粗盐溶液
Na2CO3溶液
过滤
CaCO3
Na+、Cl-、Mg2+、Ca2+、SO42-
Na+、Cl-、Mg2+、SO42-、CO32-
溶液1
离子方程式书写训练
离子反应的应用
第一章 物质及其变化
环节一:食盐精制方案的交流改进
环节一:食盐精制方案的交流改进
问题1:各杂质离子分别选用哪些除杂试剂除去?
问题2:除杂试剂用量如何选择?
问题3:引入的杂质离子如何除去?
问题4:除杂的具体顺序如何确定?过滤步骤能否合并?
问题5:为什么用盐酸试剂收尾?为什么加盐酸前需要过滤?
问题6:为什么钙盐、氢氧化钙比钡盐、氢氧化钡常用?
纯净度、简洁性、成本
多种离子除杂方案确定
第一步:确定各杂质离子除杂试剂
第二步:确定引入杂质离子除杂试剂
第三步:合并相同除杂试剂,确定最佳除杂顺序(先难后易)
环节一:食盐精制方案的交流改进
环节二:食盐精制方案的实施与反思
问题1:怎么证明粗盐溶液中存在杂质离子?
问题2:怎么证明粗盐溶液中杂质离子已经完全沉淀?
取样,加入检验试剂,根据现象得出结论
将反应混合液静置,向上层液中继续加入几滴沉淀剂,根据现象得出结论
问题3:一般最终控制溶液的pH约为4,怎么测定溶液的pH?
静置环节可以用离心机离心代替,节约时间。
将一小块pH试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到pH试纸中央,待变色稳定后再和标准比色卡对照,读出对应的pH。
问题4:能否直接选用Ba(OH)2溶液沉淀Mg2+和SO42-
优点:步骤简化,节约时间。
缺点:杂质量不确定,容易造成试剂浪费,增大成本。
环节三:真实工业情境食盐精制方案的分析与评价
生成胶体有何影响?如何控制沉淀环节条件?
减压过滤和真空蒸发的目的是?
该工艺还有哪些值得关注的点?
离子反应归纳整理
第一章 物质及其变化
KNO3 BaCl2 CaCO3 HClO4
Ba(OH)2 NH4NO3 NaHCO3 NaHSO4(溶液和熔融)
练习1:写出下列物质电离方程式:
练习2:写出下列离子方程式:
(1)H2SO4 + NaOH:_________________________________________________;
(2)H2SO4+Ba(OH)2:________________________________________________。
(3)Mg + H2SO4:____________________________________________________;
(4)MgO + HCl:_____________________________________________________。
(5)NaOH + CH3COOH:______________________________________________;
(6)Ca(OH)2 (澄清石灰水) + CO2(少量):_________________________________。
练习3:判断下列离子方程式是否正确并说明理由
(1)铁与稀盐酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑
(2)FeCl3与Fe反应:Fe3+ + Fe = 2Fe2+
(3)硫酸和Ba(OH)2溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O
(4)碳酸钡和稀硝酸反应:CO32-+2H+ = H2O + CO2↑
(5)硫酸镁和Ba(OH)2溶液反应:Ba2+ + SO42- = BaSO4↓
练习4:下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cl-、SO42-
B.Na+、CO32-、SO42-、Cl-
C.NO、Na+、HCO3-、Ba2+
D.Na+、NO3-、H+、SO42-
练习5:下列说法中正确的是( )
A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+
B.能使石蕊试液变红的溶液中可能含有Cl-、K+、Na+、NO3-
C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42-
D.用H++OH-=H2O可描述醋酸与Ba(OH)2反应的实质
练习6:某溶液的溶质可能由下列离子组成:Cl-、SO42-、 CO32- 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将(1)中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。依据以上实验可以推断,原溶液中一定含有 ;一定没有 ;可能含有________。
SO42-、 CO32- 、Na+
H+、Ba2+
Cl-
