1.3氧化还原反应 课件(共19张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应 课件(共19张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 17:19:24 | ||
图片预览




文档简介
(共19张PPT)
第三节 氧化还原反应
第一章
氧化还原反应
生活中的现象
新切的苹果与放置30分钟后的苹果
新的铁钉与长久放置的铁钉
情景导入
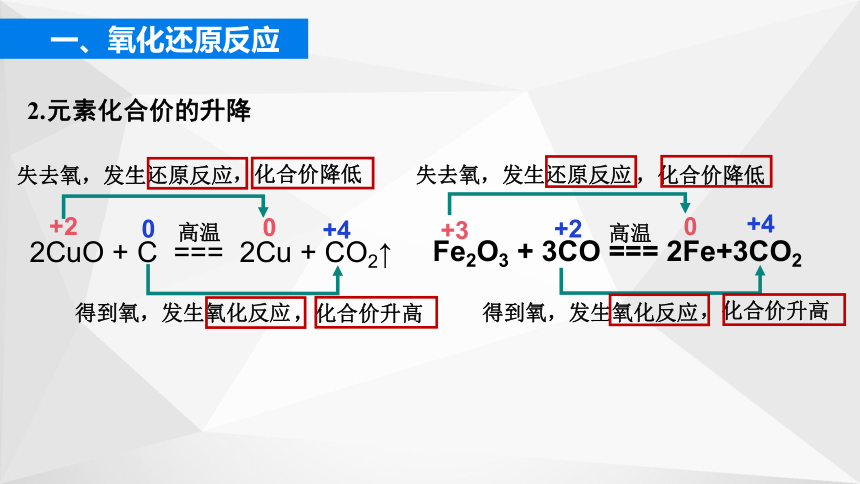
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
【氧化还原反应】
氧化反应和还原反应是在一个反应中同时发生的(P20)
请标出上述反应中各物质所含元素化合价的变化情况
1. 物质的得失氧
一、氧化还原反应
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
+2
0
,化合价降低
0
+4
,化合价升高
+3
0
,化合价降低
+2
+4
,化合价升高
2.元素化合价的升降
一、氧化还原反应
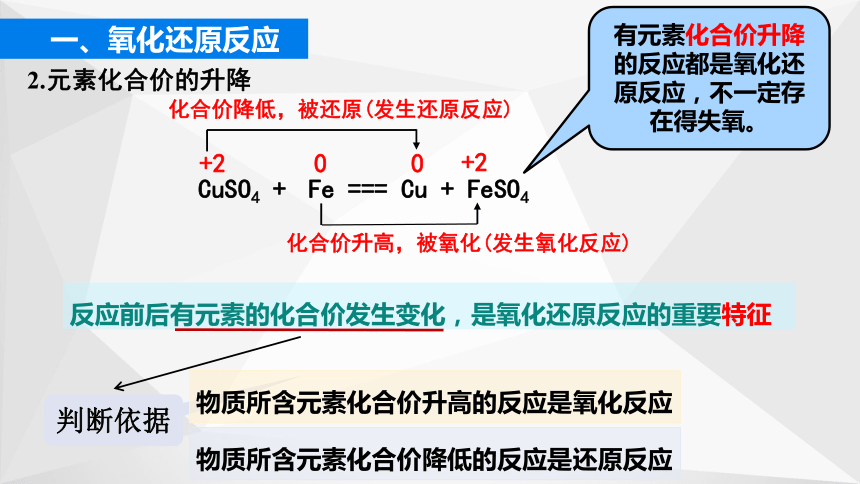
CuSO4 + Fe === Cu + FeSO4
化合价降低,被还原(发生还原反应)
+2
0
0
+2
化合价升高,被氧化(发生氧化反应)
2.元素化合价的升降
一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
判断依据
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
Cl-
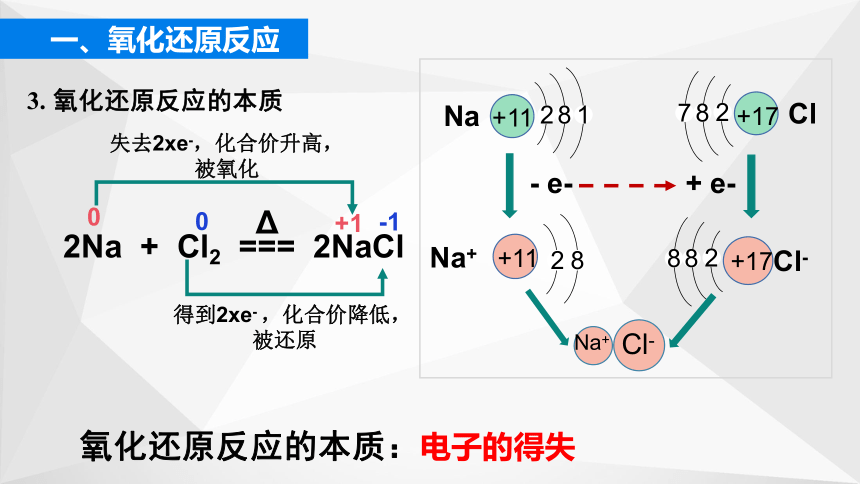
2Na + Cl2 === 2NaCl
Δ
0
0
+1
-1
+11
2
8
1
+17
7
8
2
- e-
+ e-
+11
2
8
+17
8
8
2
Na+
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,
被氧化
得到2xe- ,化合价降低,
被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
H2 + Cl2 === 2HCl
点燃
0
0
+1
-1
电子对偏离
化合价升高,被氧化
电子对偏向
化合价降低,被还原
+1
1
+17
2
8
7
你的电子
借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
氧化剂/还原剂、得电子/失电子、化合价降低/升高,三者关系如下
氧化还原反应
特征:有元素化合价发生变化
本质:有电子的得失或共用电子对的偏移
口诀:失 → 升 → 氧
得 → 降 → 还
1. 元素的原子失去电子(或电子对偏离),元素的化合价升高,物质被氧化,发生氧化反应。
2. 元素的原子得到电子(或电子对偏向),元素的化合价降低,物质被还原,发生还原反应。
总结
化学反应(反应条件未标) 基本类型 是否为氧化还原反应
CaCO3==CaO+CO2↑
2H2O=2H2↑+O2↑
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl + BaSO4 ↓
Fe+CuSO4=FeSO4+Cu
Fe2O3+3CO==2Fe+3CO2
2Na+ Cl2=2NaCl
H2O+ CaO == Ca(OH)2
分解反应
否
分解反应
是
复分解反应
否
复分解反应
否
置换反应
是
是
化合反应
否
化合反应
是
X
氧化还原反应与四种基本类型反应有什么联系 ?
化合反应、分解反应 氧化还原反应;
置换反应 氧化还原反应;
复分解反应 氧化还原反应;
不一定是
一定是
一定不是
氧化还原反应与四种基本类型反应的关系
有单质参加
的化合反应
是氧化还原
反应
复分解反应
置换反应
氧化还原
反应
反应
反应
分解
化合
有单质生成的
分解反应是氧
化还原反应
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
氧化还原反应与四种基本类型反应的关系
判断下列说法是否正确
(1)有单质参加的化合反应和由单质生成的分解反应一定是氧化还原反应。
(2)有单质参加或生成的反应一定是氧化还原反应。
(3)没有单质参加的化合反应和没有单质生成的分解反应一定不是氧化还原反应。
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
无沉淀、气体、水
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )
A.Cl2+2KOH=KCl+KClO+H2O
B.3NO2+H2O=2HNO3+NO
C.Na2O2+SO2=Na2SO4
D.2NaHCO3 Na2CO3+CO2↑+H2O
0
-1
+1
氧化还原反应
+4
+5
+2
氧化还原反应
-1
+4
-2
氧化还原反应
+6
+1 +1 +4 -2
+1 +4 -2
+4 -2
+1 -2
非氧化还原反应
D
练一练
2.(2017·三明高一检测)海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是
A.溴发生了还原反应
B.二氧化硫在反应中被还原
C.溴在反应中失去电子
D.该反应既是化合反应又是氧化还原反应
√
解析 该反应为氧化还原反应,溴在反应中得到电子发生还原反应,溴被还原。
练一练
3.下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液
B.铁片置于硫酸铜溶液中
C.铁在氧气中燃烧
D.二氧化碳通入澄清石灰水中
√
解析 凡是有元素化合价升降的反应都是氧化还原反应,B、C属于氧化还原反应,在溶液中有离子参加的化学反应称为离子反应,A、B、D属于离子反应。
练一练
4.下列各式中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
(1)NaCl→Cl2 (2)KMnO4→MnCl2
(3)Fe2O3→Fe (4)CO→CO2
被氧化
被还原
被还原
被氧化
5.下列哪个反应表示二氧化硫被还原 ( )
A . SO2+2H2O+Cl2 = H2SO4+2HCl B . SO2+2H2S = 2H2O+3S↓
C . SO2+2NaOH = Na2SO3+H2O D . SO2+Na2CO3 = Na2SO3+CO2↑
6.当化合物中的元素被转化成单质中的元素时,该元素( )
A.一定被氧化; B.一定被还原;
C.可能被氧化,也可能被还原; D.化合价降低为0。
B
C
练一练
第三节 氧化还原反应
第一章
氧化还原反应
生活中的现象
新切的苹果与放置30分钟后的苹果
新的铁钉与长久放置的铁钉
情景导入
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
【氧化还原反应】
氧化反应和还原反应是在一个反应中同时发生的(P20)
请标出上述反应中各物质所含元素化合价的变化情况
1. 物质的得失氧
一、氧化还原反应
2CuO + C === 2Cu + CO2↑
高温
失去氧,发生还原反应
得到氧,发生氧化反应
Fe2O3 + 3CO === 2Fe+3CO2
高温
失去氧,发生还原反应
得到氧,发生氧化反应
+2
0
,化合价降低
0
+4
,化合价升高
+3
0
,化合价降低
+2
+4
,化合价升高
2.元素化合价的升降
一、氧化还原反应
CuSO4 + Fe === Cu + FeSO4
化合价降低,被还原(发生还原反应)
+2
0
0
+2
化合价升高,被氧化(发生氧化反应)
2.元素化合价的升降
一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
判断依据
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
Cl-
2Na + Cl2 === 2NaCl
Δ
0
0
+1
-1
+11
2
8
1
+17
7
8
2
- e-
+ e-
+11
2
8
+17
8
8
2
Na+
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,
被氧化
得到2xe- ,化合价降低,
被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
H2 + Cl2 === 2HCl
点燃
0
0
+1
-1
电子对偏离
化合价升高,被氧化
电子对偏向
化合价降低,被还原
+1
1
+17
2
8
7
你的电子
借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
氧化剂/还原剂、得电子/失电子、化合价降低/升高,三者关系如下
氧化还原反应
特征:有元素化合价发生变化
本质:有电子的得失或共用电子对的偏移
口诀:失 → 升 → 氧
得 → 降 → 还
1. 元素的原子失去电子(或电子对偏离),元素的化合价升高,物质被氧化,发生氧化反应。
2. 元素的原子得到电子(或电子对偏向),元素的化合价降低,物质被还原,发生还原反应。
总结
化学反应(反应条件未标) 基本类型 是否为氧化还原反应
CaCO3==CaO+CO2↑
2H2O=2H2↑+O2↑
AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl + BaSO4 ↓
Fe+CuSO4=FeSO4+Cu
Fe2O3+3CO==2Fe+3CO2
2Na+ Cl2=2NaCl
H2O+ CaO == Ca(OH)2
分解反应
否
分解反应
是
复分解反应
否
复分解反应
否
置换反应
是
是
化合反应
否
化合反应
是
X
氧化还原反应与四种基本类型反应有什么联系 ?
化合反应、分解反应 氧化还原反应;
置换反应 氧化还原反应;
复分解反应 氧化还原反应;
不一定是
一定是
一定不是
氧化还原反应与四种基本类型反应的关系
有单质参加
的化合反应
是氧化还原
反应
复分解反应
置换反应
氧化还原
反应
反应
反应
分解
化合
有单质生成的
分解反应是氧
化还原反应
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
氧化还原反应与四种基本类型反应的关系
判断下列说法是否正确
(1)有单质参加的化合反应和由单质生成的分解反应一定是氧化还原反应。
(2)有单质参加或生成的反应一定是氧化还原反应。
(3)没有单质参加的化合反应和没有单质生成的分解反应一定不是氧化还原反应。
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
无沉淀、气体、水
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )
A.Cl2+2KOH=KCl+KClO+H2O
B.3NO2+H2O=2HNO3+NO
C.Na2O2+SO2=Na2SO4
D.2NaHCO3 Na2CO3+CO2↑+H2O
0
-1
+1
氧化还原反应
+4
+5
+2
氧化还原反应
-1
+4
-2
氧化还原反应
+6
+1 +1 +4 -2
+1 +4 -2
+4 -2
+1 -2
非氧化还原反应
D
练一练
2.(2017·三明高一检测)海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是
A.溴发生了还原反应
B.二氧化硫在反应中被还原
C.溴在反应中失去电子
D.该反应既是化合反应又是氧化还原反应
√
解析 该反应为氧化还原反应,溴在反应中得到电子发生还原反应,溴被还原。
练一练
3.下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液
B.铁片置于硫酸铜溶液中
C.铁在氧气中燃烧
D.二氧化碳通入澄清石灰水中
√
解析 凡是有元素化合价升降的反应都是氧化还原反应,B、C属于氧化还原反应,在溶液中有离子参加的化学反应称为离子反应,A、B、D属于离子反应。
练一练
4.下列各式中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
(1)NaCl→Cl2 (2)KMnO4→MnCl2
(3)Fe2O3→Fe (4)CO→CO2
被氧化
被还原
被还原
被氧化
5.下列哪个反应表示二氧化硫被还原 ( )
A . SO2+2H2O+Cl2 = H2SO4+2HCl B . SO2+2H2S = 2H2O+3S↓
C . SO2+2NaOH = Na2SO3+H2O D . SO2+Na2CO3 = Na2SO3+CO2↑
6.当化合物中的元素被转化成单质中的元素时,该元素( )
A.一定被氧化; B.一定被还原;
C.可能被氧化,也可能被还原; D.化合价降低为0。
B
C
练一练
