1.3氧化还原反应课件(共54张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应课件(共54张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 17:21:26 | ||
图片预览








文档简介
(共54张PPT)
氧化还原反应的概念
第一章 物质及其变化
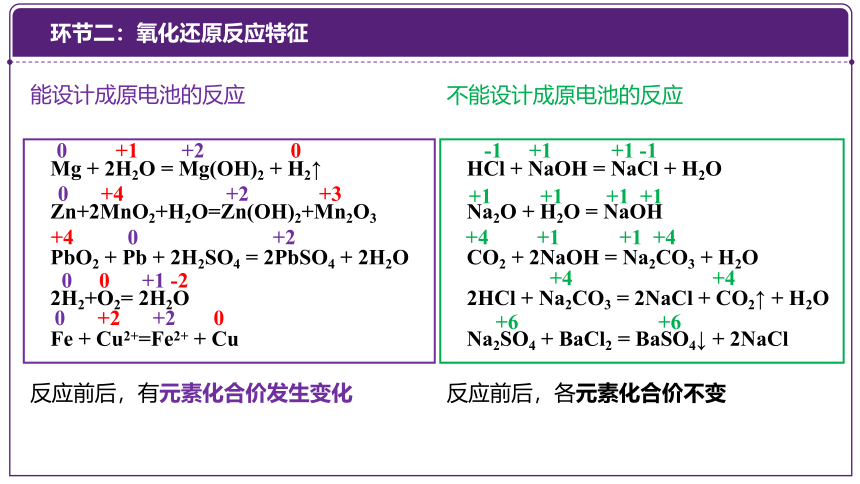
Mg + 2H2O = Mg(OH)2 + H2↑
Zn+2MnO2+H2O=Zn(OH)2+Mn2O3
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
2H2+O2=2H2O
比亚迪燃料电池大巴车
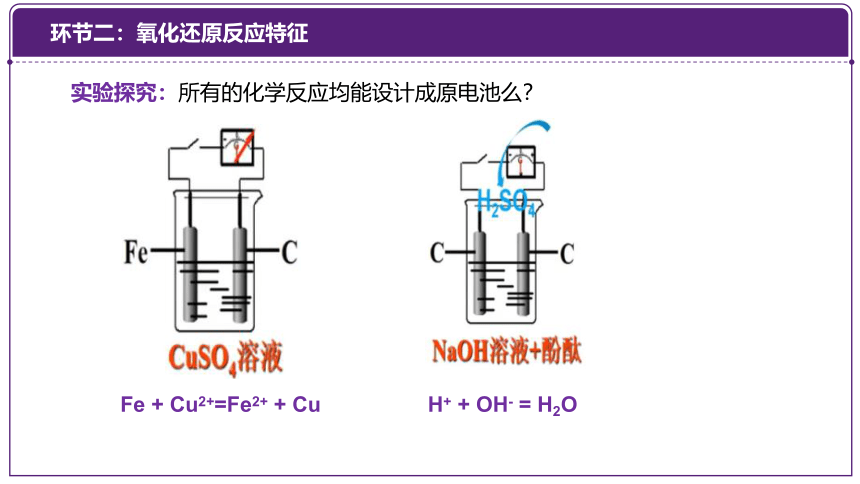
实验探究:所有的化学反应均能设计成原电池么?
Fe + Cu2+=Fe2+ + Cu
H+ + OH- = H2O
环节二:氧化还原反应特征
2H2+O2= 2H2O
Mg + 2H2O = Mg(OH)2 + H2↑
Zn+2MnO2+H2O=Zn(OH)2+Mn2O3
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
Fe + Cu2+=Fe2+ + Cu
2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O
HCl + NaOH = NaCl + H2O
Na2O + H2O = NaOH
CO2 + 2NaOH = Na2CO3 + H2O
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
能设计成原电池的反应
不能设计成原电池的反应
0 +1 +2 0
0 +4 +2 +3
+4 0 +2
0 0 +1 -2
0 +2 +2 0
-1 +1 +1 -1
+1 +1 +1 +1
+4 +1 +1 +4
+4 +4
+6 +6
反应前后,有元素化合价发生变化
反应前后,各元素化合价不变
环节二:氧化还原反应特征
环节二:氧化还原反应特征
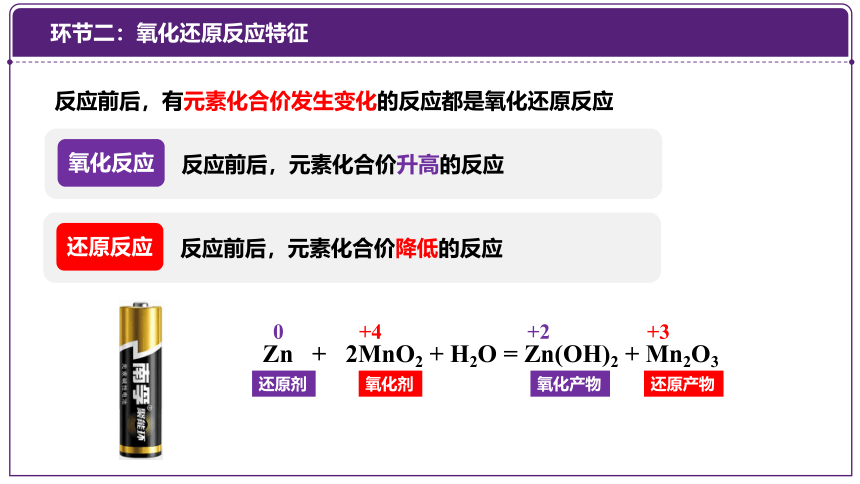
反应前后,有元素化合价发生变化的反应都是氧化还原反应
氧化反应
反应前后,元素化合价升高的反应
还原反应
反应前后,元素化合价降低的反应
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
0 +4 +2 +3
化合价升高,发生氧化反应(被氧化)
化合价降低 ,发生还原反应(被还原)
环节二:氧化还原反应特征
反应前后,有元素化合价发生变化的反应都是氧化还原反应
氧化反应
反应前后,元素化合价升高的反应
还原反应
反应前后,元素化合价降低的反应
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
还原剂
氧化产物
氧化剂
还原产物
0 +4 +2 +3
环节二:氧化还原反应特征
反应前后,有元素化合价发生变化的反应都是氧化还原反应
氧化反应
反应前后,元素化合价升高的反应
还原反应
反应前后,元素化合价降低的反应
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,发生氧化反应
化合价降低,发生还原反应
反应 氧化剂 还原剂 氧化产物 还原产物
Mg + 2H2O = Mg(OH)2 + H2↑
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
2H2+O2= 2H2O
Fe + Cu2+=Fe2+ + Cu
环节二:氧化还原反应特征
标出下列反应的氧化剂、还原剂、氧化产物和还原产物。
H2O Mg Mg(OH)2 H2
PbO2 Pb PbSO4 PbSO4
O2 H2 H2O H2O
Cu2+ Fe Fe2+ Cu
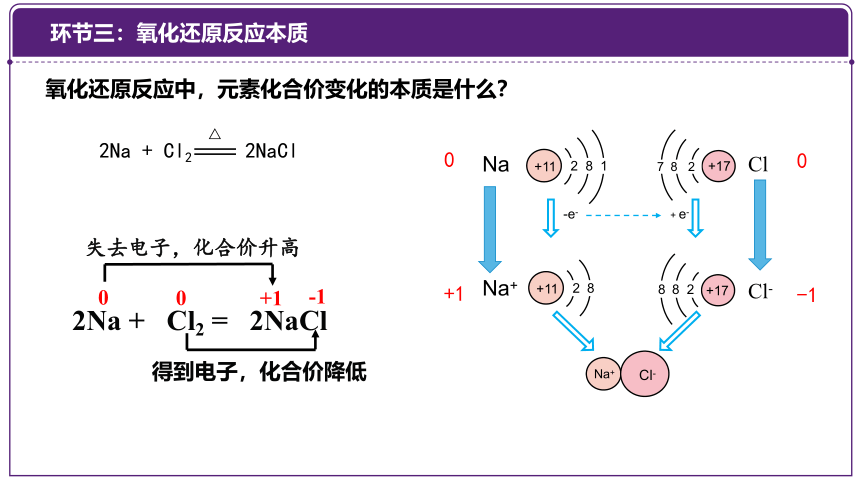
2Na + Cl2 2NaCl
△
+11
2 8 1
+17
7 8 2
-e-
+11
2 8
Na+
+17
8 8 2
Cl-
Na+
Cl-
+ e-
0
+1
0
-1
Na
Cl
2Na + Cl2 = 2NaCl
失去电子,化合价升高
得到电子,化合价降低
0
0
+1
-1
氧化还原反应中,元素化合价变化的本质是什么?
环节三:氧化还原反应本质
环节三:氧化还原反应本质
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
HCl
H2 + Cl2 2HCl
点燃
电子对偏离,化合价升高
0
0
+1 -1
H2 + Cl2 == 2 HCl
电子对偏向,化合价降低
氧化还原反应的本质是发生了电子的转移,有的是电子的得到和失去,有的是共用电子对的偏离和偏向两种情况。
环节三:氧化还原反应本质
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
0 +4 +2 +3
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
氧化还原反应电子转移的表示方法
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
0 +4 +2 +3
失去2e-
得到2×e-
双线桥法
单线桥法
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
2e-
环节三:氧化还原反应本质
用双线桥法和单线桥法表示下列反应的电子转移
Mg + 2H2O = Mg(OH)2 + H2↑
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
2H2+O2= 2H2O
Fe + Cu2+=Fe2+ + Cu
环节三:氧化还原反应本质
具有
还原剂
还原性
氧化反应
氧化产物
发生
生成
化合价升高
失去电子
被氧化
具有
氧化剂
氧化性
还原反应
还原产物
发生
生成
化合价降低
得到电子
被还原
小结
氧化剂与还原剂
第一章 物质及其变化
回顾旧识
①氧化还原反应的特征和本质是什么?
②氧化剂和还原剂的特征是什么?
特征:化合价的升降 本质:电子的转移
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
环节一:探寻氧化剂、还原剂
任务1:预测FeCl2能否做氧化剂或还原剂,说明分析思路。
物质 核心元素 核心元素价态 常见价态 变价的可能性 可能的性质
FeCl2
Fe
+2
0、+2、+3
↓ ↑
氧化性
还原性
+3
+2
0
FeCl2
盐
FeCl3
Fe
单质
还原剂
氧化剂
环节一:探寻氧化剂、还原剂
任务1:预测FeCl2能否做氧化剂或还原剂,说明分析思路。
物质 核心元素 核心元素价态 常见价态 变价的可能性 可能的性质
FeCl2
FeCl2
Fe
+2
0、+2、+3
↓ ↑
氧化性
还原性
Cl
-1
-1、0、+1
+3、+5、+7
↑
还原性
价态规律:高价氧化低价还,中间价态两边转。
环节一:探寻氧化剂、还原剂
物质 核心元素 核心元素价态 常见价态 变价的可能性 可能的性质
FeCl2
FeCl3
KMnO4
KI
H2O2
Fe
+2
0、+2、+3
↓ ↑
氧化性
还原性
小结
常见氧化剂:部分非金属单质:F2、O2、Cl2……
部分含高价元素的物质:FeCl3、KMnO4、K2Cr2O7 …
部分含中间价态元素的物质:H2O2……
常见还原剂:金属单质:Fe、Zn、Cu.…
部分非金属单质:C、H ……
含最低价元素的物质:KI.…
部分含中间价态元素的物质:CO、FeCl ....
环节二:验证物质氧化性和还原性
任务2:设计实验方案验证H2O2的性质
限选试剂:5%H2O2溶液、酸性KMnO4溶液、FeCl2溶液、KI溶液、Na2S溶液。
性质 试剂 理由 预期的产物和现象
氧化性
还原性
实验步骤 现象 结论
预测性质
预测依据
选择试剂
实施实验
分析解释
得出结论
任务2:设计实验方案验证H2O2的性质
限选试剂:5%H2O2溶液、酸性KMnO4溶液、FeCl2溶液、KI溶液、Na2S溶液,淀粉溶液,KSCN溶液。
资料卡片:①淀粉遇碘变蓝;
②Fe3+能与SCN-结合生成红色的Fe(SCN)3使溶液呈红色。
环节二:验证物质氧化性和还原性
环节三:应用氧化还原反应实现物质转化
汽车尾气是汽车使用时产生的废气,含有上百种不同的化合物,其中的污染物有固体悬浮微粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等。
环节三:应用氧化还原反应实现物质转化
问题1:汽车尾气中的CO、NO2转化为什么排放比较合理?
任务3:汽车尾气排放处理。
问题2:如何实现转化?
CO→CO2
NO2→N2
需要加入氧化剂
需要加入还原剂
+2 +4
+4 0
环节三:应用氧化还原反应实现物质转化
问题1:汽车尾气中的CO、NO2转化为什么排放比较合理?
任务3:汽车尾气排放处理。
问题2:如何实现转化?
CO→CO2
NO2→N2
+2 +4
+4 0
4CO+2NO2 4CO2+N2
催化剂
任务3:汽车尾气排放处理。
大货车尾气中氮氧化物(NO2)含量较高,需要添加尿素[CO(NH2)2] 帮助处理尾气,试着写出该过程反应化学方程式。
+4 -3
4CO(NH2)2 + 6NO2 = 4CO2 + 7N2
氧化还原反应方程式书写
第一章 物质及其变化
泳池变绿之谜
里约奥运之
32
里约奥组委的官方解释为:“跳水池先是使用了氯系消毒剂(主要成分为NaClO)对池水消毒,后来又往池水中加入了双氧水,发生了化学反应。”
33
找
物质
算
得失
查
介质
定
方程
氧化剂
还原剂
氧化产物
还原产物
得失电子守恒
酸性: H+ H2O H2O H+
碱性: OH- H2O H2O OH-
酸性(补H+)
碱性(补OH-)
质量守恒
电荷守恒
氧化还原反应方程式的书写
34
NaClO + H2O2=NaCl +O2↑+ H2O
2e-
跳水池先是使用了氯系消毒剂(主要成分为NaClO)对池水消毒,后来又往池水中加入了双氧水,产生大量O2,又加上周围高温高湿,促进了蓝藻、绿藻等藻类大量快速地繁殖。
35
含氯消毒剂会与水中有机物发生氯代反应,生成物对人体会产生三致效应——致癌、致畸、致基因突变。
ClO2是国际上公认的最理想的更换代产品,我国从2000年起就逐渐用它取代了其他含氯消毒剂。
36
(2016年全国Ⅰ卷改编)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
37
(2016年全国Ⅰ卷改编)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
(1)写出“反应”步骤中生成ClO2的化学方程式 。
NaClO3 + SO2= ClO2 + NaHSO4
2NaClO3 + SO2= 2ClO2 + NaHSO4
2NaClO3 + SO2 + H2SO4= 2ClO2 + 2NaHSO4
38
“尾气吸收”是用NaOH和H2O2吸收“电解”过程排出的少量ClO2,该反应中离子方程式为
ClO2 + H2O2 = ClO2- + O2
2ClO2 + H2O2 = 2ClO2- + O2
2ClO2 + H2O2 +2OH- = 2ClO2- + O2+ 2H2O
氧化剂 还原产物
KMnO4 Mn2+
浓H2SO4 SO2
浓HNO3 NO2
稀HNO3 NO
Cl2/HClO Cl-
Fe3+ Fe2+
H2O2 H2O
还原剂 氧化产物
S2- S
SO32- SO42-
I- I2
Fe2+ Fe3+
Br- Br2
Cl- Cl2
H2O2 O2
留 点 铁
生 锈 了
长 绿 毛
S2- I- Fe2+
SO32-
Br-
Cl-
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
反 思 和 总 结
41
1、陌生情景的信息获取
2、氧化还原反应方程式配平的四步法
3、氧化还原反应的电子转移问题
42
向试管中加入适量酸性KIO3 溶液,再滴加适量 CCl4
继续向上述试管中滴加几滴Na2SO3溶液,振荡,观察实验现象。
继续向上述试管中滴加几滴Na2SO3溶液振荡,观察实验现象。
继续向上述试管中滴加几滴KIO3 溶液振荡,观察实验现象。
试写出下列过程中所发生的所有氧化还原反应,用单线桥标出电子转移
43
氧化还原反应归纳整理
第一章 物质及其变化
氧化性、还原性强弱的判断
1.根据氧化还原反应原理来判断
(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.根据元素的活动性顺序来判断
(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;
非金属单质的氧化性越强,其阴离子的还原性越弱。
3. 根据反应条件的难易来判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
我举个例子
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
氧化性:_____________________________
△
KMnO4>MnO2
4. 根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
我举个例子
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:__________
点燃
Cl2 > S
△
5. 根据所处环境(温度、浓度、pH)来判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷); ②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:①中性环境中 不显氧化性,酸性环境中 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
四、氧化还原反应的规律
1. 价态决定性质规律
(1)处于最高价态的元素 → 只有 性;
(2)处于最低价态的元素 → 只有 性;
(3)处于中间价态的元素 → 性。
氧化
还原
既有氧化性又有还原
补充说明
一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
如氧化性:Fe3+ > Fe2+ > Fe,SO3 > SO2;(特例:HClO4 <HClO3 < HClO2 < HClO)
还原性:H2S > S > SO2。
2. 相邻价态转化规律(不交叉规律)
同种元素不同价态之间发生氧化还原反应,元素的化合价只向中间靠拢,不出现交叉。即:高价要降低,低价要升高,它们最多变为同一价态,不可能发生交叉现象。
元素是很“懒”的。在化学反应中,化合价能不变就不变,价态变化值能少就少。
3. 反应先后规律
(1)当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
(2)当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
及时小练
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入过量锌粉,反应的先后顺序是?
先和Ag+反应,再和Cu2+ 反应
4. 得失电子守恒规律
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
本质:得失电子总数相同
表征:化合价升降总数相同
配平氧化还原方程式的基础
氧化还原反应习题处理
第一章 物质及其变化
氧化还原反应的概念
第一章 物质及其变化
Mg + 2H2O = Mg(OH)2 + H2↑
Zn+2MnO2+H2O=Zn(OH)2+Mn2O3
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
2H2+O2=2H2O
比亚迪燃料电池大巴车
实验探究:所有的化学反应均能设计成原电池么?
Fe + Cu2+=Fe2+ + Cu
H+ + OH- = H2O
环节二:氧化还原反应特征
2H2+O2= 2H2O
Mg + 2H2O = Mg(OH)2 + H2↑
Zn+2MnO2+H2O=Zn(OH)2+Mn2O3
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
Fe + Cu2+=Fe2+ + Cu
2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O
HCl + NaOH = NaCl + H2O
Na2O + H2O = NaOH
CO2 + 2NaOH = Na2CO3 + H2O
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
能设计成原电池的反应
不能设计成原电池的反应
0 +1 +2 0
0 +4 +2 +3
+4 0 +2
0 0 +1 -2
0 +2 +2 0
-1 +1 +1 -1
+1 +1 +1 +1
+4 +1 +1 +4
+4 +4
+6 +6
反应前后,有元素化合价发生变化
反应前后,各元素化合价不变
环节二:氧化还原反应特征
环节二:氧化还原反应特征
反应前后,有元素化合价发生变化的反应都是氧化还原反应
氧化反应
反应前后,元素化合价升高的反应
还原反应
反应前后,元素化合价降低的反应
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
0 +4 +2 +3
化合价升高,发生氧化反应(被氧化)
化合价降低 ,发生还原反应(被还原)
环节二:氧化还原反应特征
反应前后,有元素化合价发生变化的反应都是氧化还原反应
氧化反应
反应前后,元素化合价升高的反应
还原反应
反应前后,元素化合价降低的反应
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
还原剂
氧化产物
氧化剂
还原产物
0 +4 +2 +3
环节二:氧化还原反应特征
反应前后,有元素化合价发生变化的反应都是氧化还原反应
氧化反应
反应前后,元素化合价升高的反应
还原反应
反应前后,元素化合价降低的反应
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,发生氧化反应
化合价降低,发生还原反应
反应 氧化剂 还原剂 氧化产物 还原产物
Mg + 2H2O = Mg(OH)2 + H2↑
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
2H2+O2= 2H2O
Fe + Cu2+=Fe2+ + Cu
环节二:氧化还原反应特征
标出下列反应的氧化剂、还原剂、氧化产物和还原产物。
H2O Mg Mg(OH)2 H2
PbO2 Pb PbSO4 PbSO4
O2 H2 H2O H2O
Cu2+ Fe Fe2+ Cu
2Na + Cl2 2NaCl
△
+11
2 8 1
+17
7 8 2
-e-
+11
2 8
Na+
+17
8 8 2
Cl-
Na+
Cl-
+ e-
0
+1
0
-1
Na
Cl
2Na + Cl2 = 2NaCl
失去电子,化合价升高
得到电子,化合价降低
0
0
+1
-1
氧化还原反应中,元素化合价变化的本质是什么?
环节三:氧化还原反应本质
环节三:氧化还原反应本质
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
H
Cl
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
HCl
H2 + Cl2 2HCl
点燃
电子对偏离,化合价升高
0
0
+1 -1
H2 + Cl2 == 2 HCl
电子对偏向,化合价降低
氧化还原反应的本质是发生了电子的转移,有的是电子的得到和失去,有的是共用电子对的偏离和偏向两种情况。
环节三:氧化还原反应本质
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
0 +4 +2 +3
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
氧化还原反应电子转移的表示方法
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
0 +4 +2 +3
失去2e-
得到2×e-
双线桥法
单线桥法
Zn + 2MnO2 + H2O = Zn(OH)2 + Mn2O3
2e-
环节三:氧化还原反应本质
用双线桥法和单线桥法表示下列反应的电子转移
Mg + 2H2O = Mg(OH)2 + H2↑
PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O
2H2+O2= 2H2O
Fe + Cu2+=Fe2+ + Cu
环节三:氧化还原反应本质
具有
还原剂
还原性
氧化反应
氧化产物
发生
生成
化合价升高
失去电子
被氧化
具有
氧化剂
氧化性
还原反应
还原产物
发生
生成
化合价降低
得到电子
被还原
小结
氧化剂与还原剂
第一章 物质及其变化
回顾旧识
①氧化还原反应的特征和本质是什么?
②氧化剂和还原剂的特征是什么?
特征:化合价的升降 本质:电子的转移
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
环节一:探寻氧化剂、还原剂
任务1:预测FeCl2能否做氧化剂或还原剂,说明分析思路。
物质 核心元素 核心元素价态 常见价态 变价的可能性 可能的性质
FeCl2
Fe
+2
0、+2、+3
↓ ↑
氧化性
还原性
+3
+2
0
FeCl2
盐
FeCl3
Fe
单质
还原剂
氧化剂
环节一:探寻氧化剂、还原剂
任务1:预测FeCl2能否做氧化剂或还原剂,说明分析思路。
物质 核心元素 核心元素价态 常见价态 变价的可能性 可能的性质
FeCl2
FeCl2
Fe
+2
0、+2、+3
↓ ↑
氧化性
还原性
Cl
-1
-1、0、+1
+3、+5、+7
↑
还原性
价态规律:高价氧化低价还,中间价态两边转。
环节一:探寻氧化剂、还原剂
物质 核心元素 核心元素价态 常见价态 变价的可能性 可能的性质
FeCl2
FeCl3
KMnO4
KI
H2O2
Fe
+2
0、+2、+3
↓ ↑
氧化性
还原性
小结
常见氧化剂:部分非金属单质:F2、O2、Cl2……
部分含高价元素的物质:FeCl3、KMnO4、K2Cr2O7 …
部分含中间价态元素的物质:H2O2……
常见还原剂:金属单质:Fe、Zn、Cu.…
部分非金属单质:C、H ……
含最低价元素的物质:KI.…
部分含中间价态元素的物质:CO、FeCl ....
环节二:验证物质氧化性和还原性
任务2:设计实验方案验证H2O2的性质
限选试剂:5%H2O2溶液、酸性KMnO4溶液、FeCl2溶液、KI溶液、Na2S溶液。
性质 试剂 理由 预期的产物和现象
氧化性
还原性
实验步骤 现象 结论
预测性质
预测依据
选择试剂
实施实验
分析解释
得出结论
任务2:设计实验方案验证H2O2的性质
限选试剂:5%H2O2溶液、酸性KMnO4溶液、FeCl2溶液、KI溶液、Na2S溶液,淀粉溶液,KSCN溶液。
资料卡片:①淀粉遇碘变蓝;
②Fe3+能与SCN-结合生成红色的Fe(SCN)3使溶液呈红色。
环节二:验证物质氧化性和还原性
环节三:应用氧化还原反应实现物质转化
汽车尾气是汽车使用时产生的废气,含有上百种不同的化合物,其中的污染物有固体悬浮微粒、一氧化碳、二氧化碳、碳氢化合物、氮氧化合物、铅及硫氧化合物等。
环节三:应用氧化还原反应实现物质转化
问题1:汽车尾气中的CO、NO2转化为什么排放比较合理?
任务3:汽车尾气排放处理。
问题2:如何实现转化?
CO→CO2
NO2→N2
需要加入氧化剂
需要加入还原剂
+2 +4
+4 0
环节三:应用氧化还原反应实现物质转化
问题1:汽车尾气中的CO、NO2转化为什么排放比较合理?
任务3:汽车尾气排放处理。
问题2:如何实现转化?
CO→CO2
NO2→N2
+2 +4
+4 0
4CO+2NO2 4CO2+N2
催化剂
任务3:汽车尾气排放处理。
大货车尾气中氮氧化物(NO2)含量较高,需要添加尿素[CO(NH2)2] 帮助处理尾气,试着写出该过程反应化学方程式。
+4 -3
4CO(NH2)2 + 6NO2 = 4CO2 + 7N2
氧化还原反应方程式书写
第一章 物质及其变化
泳池变绿之谜
里约奥运之
32
里约奥组委的官方解释为:“跳水池先是使用了氯系消毒剂(主要成分为NaClO)对池水消毒,后来又往池水中加入了双氧水,发生了化学反应。”
33
找
物质
算
得失
查
介质
定
方程
氧化剂
还原剂
氧化产物
还原产物
得失电子守恒
酸性: H+ H2O H2O H+
碱性: OH- H2O H2O OH-
酸性(补H+)
碱性(补OH-)
质量守恒
电荷守恒
氧化还原反应方程式的书写
34
NaClO + H2O2=NaCl +O2↑+ H2O
2e-
跳水池先是使用了氯系消毒剂(主要成分为NaClO)对池水消毒,后来又往池水中加入了双氧水,产生大量O2,又加上周围高温高湿,促进了蓝藻、绿藻等藻类大量快速地繁殖。
35
含氯消毒剂会与水中有机物发生氯代反应,生成物对人体会产生三致效应——致癌、致畸、致基因突变。
ClO2是国际上公认的最理想的更换代产品,我国从2000年起就逐渐用它取代了其他含氯消毒剂。
36
(2016年全国Ⅰ卷改编)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
37
(2016年全国Ⅰ卷改编)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
(1)写出“反应”步骤中生成ClO2的化学方程式 。
NaClO3 + SO2= ClO2 + NaHSO4
2NaClO3 + SO2= 2ClO2 + NaHSO4
2NaClO3 + SO2 + H2SO4= 2ClO2 + 2NaHSO4
38
“尾气吸收”是用NaOH和H2O2吸收“电解”过程排出的少量ClO2,该反应中离子方程式为
ClO2 + H2O2 = ClO2- + O2
2ClO2 + H2O2 = 2ClO2- + O2
2ClO2 + H2O2 +2OH- = 2ClO2- + O2+ 2H2O
氧化剂 还原产物
KMnO4 Mn2+
浓H2SO4 SO2
浓HNO3 NO2
稀HNO3 NO
Cl2/HClO Cl-
Fe3+ Fe2+
H2O2 H2O
还原剂 氧化产物
S2- S
SO32- SO42-
I- I2
Fe2+ Fe3+
Br- Br2
Cl- Cl2
H2O2 O2
留 点 铁
生 锈 了
长 绿 毛
S2- I- Fe2+
SO32-
Br-
Cl-
还原剂
氧化产物
氧化剂
还原产物
+ = +
化合价升高,失去电子,发生氧化反应
化合价降低,得到电子,发生还原反应
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
反 思 和 总 结
41
1、陌生情景的信息获取
2、氧化还原反应方程式配平的四步法
3、氧化还原反应的电子转移问题
42
向试管中加入适量酸性KIO3 溶液,再滴加适量 CCl4
继续向上述试管中滴加几滴Na2SO3溶液,振荡,观察实验现象。
继续向上述试管中滴加几滴Na2SO3溶液振荡,观察实验现象。
继续向上述试管中滴加几滴KIO3 溶液振荡,观察实验现象。
试写出下列过程中所发生的所有氧化还原反应,用单线桥标出电子转移
43
氧化还原反应归纳整理
第一章 物质及其变化
氧化性、还原性强弱的判断
1.根据氧化还原反应原理来判断
(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.根据元素的活动性顺序来判断
(1)金属单质越活泼,其还原性越强;非金属单质越活泼,其氧化性越强。
(2)“单强离弱”——金属单质还原性越强,其阳离子的氧化性越弱;
非金属单质的氧化性越强,其阴离子的还原性越弱。
3. 根据反应条件的难易来判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
我举个例子
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
氧化性:_____________________________
△
KMnO4>MnO2
4. 根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
我举个例子
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:__________
点燃
Cl2 > S
△
5. 根据所处环境(温度、浓度、pH)来判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷); ②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:①中性环境中 不显氧化性,酸性环境中 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
四、氧化还原反应的规律
1. 价态决定性质规律
(1)处于最高价态的元素 → 只有 性;
(2)处于最低价态的元素 → 只有 性;
(3)处于中间价态的元素 → 性。
氧化
还原
既有氧化性又有还原
补充说明
一般来说,同种元素价态越高,氧化性越强;价态越低,还原性越强。
如氧化性:Fe3+ > Fe2+ > Fe,SO3 > SO2;(特例:HClO4 <HClO3 < HClO2 < HClO)
还原性:H2S > S > SO2。
2. 相邻价态转化规律(不交叉规律)
同种元素不同价态之间发生氧化还原反应,元素的化合价只向中间靠拢,不出现交叉。即:高价要降低,低价要升高,它们最多变为同一价态,不可能发生交叉现象。
元素是很“懒”的。在化学反应中,化合价能不变就不变,价态变化值能少就少。
3. 反应先后规律
(1)当一种氧化剂遇到几种还原剂,若均能反应,先跟还原性强的反应。
(2)当一种还原剂遇到几种氧化剂,若均能反应,先跟氧化性强的反应。
及时小练
在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入过量锌粉,反应的先后顺序是?
先和Ag+反应,再和Cu2+ 反应
4. 得失电子守恒规律
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
得到2×2e-
失去1×4e-
0
+4
+2
0
C + 2CuO
CO2↑ + 2Cu
高温
本质:得失电子总数相同
表征:化合价升降总数相同
配平氧化还原方程式的基础
氧化还原反应习题处理
第一章 物质及其变化
