3.1.3铁盐和亚铁盐 课件(共17张PPT)2024-2025学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.3铁盐和亚铁盐 课件(共17张PPT)2024-2025学年高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 17:56:40 | ||
图片预览





文档简介
(共17张PPT)
铁及其化合物
——铁盐和亚铁盐
执教教师:
第三章 铁 金属材料
第1节 铁及其化合物
(2)铁盐和亚铁盐
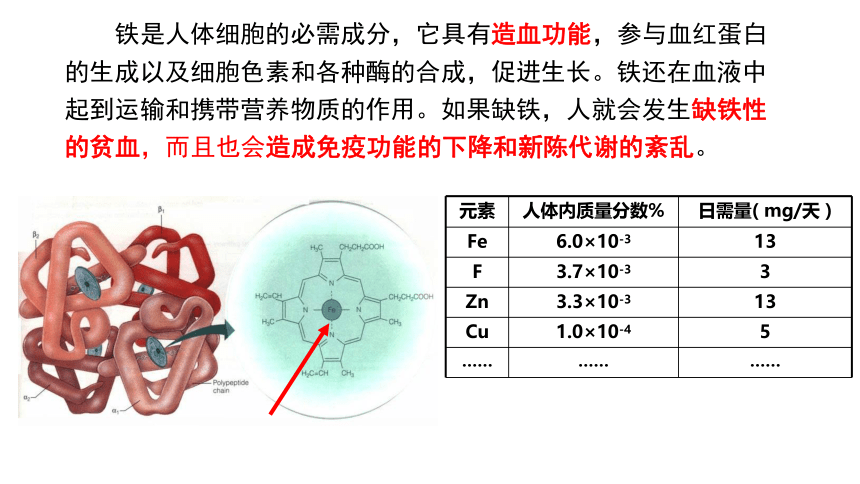
铁是人体细胞的必需成分,它具有造血功能,参与血红蛋白的生成以及细胞色素和各种酶的合成,促进生长。铁还在血液中起到运输和携带营养物质的作用。如果缺铁,人就会发生缺铁性的贫血,而且也会造成免疫功能的下降和新陈代谢的紊乱。
元素 人体内质量分数% 日需量( mg/天 )
Fe 6.0×10-3 13
F 3.7×10-3 3
Zn 3.3×10-3 13
Cu 1.0×10-4 5
…… …… ……
补铁药物
主任务:如果你是药品质检员,想要检测该补铁剂中铁元素含量与存在形式,你会怎么做呢?
补铁剂预处理:药片研磨成粉末,加水溶解,过滤,收集滤液。
几种情况?
①样品溶液中只含有Fe2+;
②样品溶液中只含有Fe3+;
③样品溶液中含有Fe2+和Fe3+。
补铁剂中的铁元素的存在形式?
氧气
Fe2+ Fe3+
【思考﹡交流】如何检验Fe2+和Fe3+?
方法1:看颜色
氯化铁[FeCl3]
硫酸铁[Fe2(SO4)3]
氯化亚铁[FeCl2]
硫酸亚铁[FeSO4]
棕黄色
浅绿色
实验探究:Fe2+和Fe3+的检验
实验探究:Fe2+和Fe3+的检验
方法2:加入NaOH溶液
实验探究1:在氯化铁和硫酸亚铁溶液中分别滴加氢氧化钠溶液
Fe3+ + 3OH- = Fe(OH)3↓
Fe2+ + 2OH- = Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
离子检验方法
Fe3+
几滴KSCN溶液
溶液变红色
Fe2+
几滴KSCN溶液
溶液不变色
FeCl2
FeCl3
实验探究2
实验探究:Fe2+和Fe3+的检验
方法3:加入KSCN溶液
Fe3+溶液
Fe2+溶液
溶液呈红色
溶液颜色无变化
【思考】能否用此方法检验Fe2+的存在
Fe2+ Fe3+
化合价升高,失电子,被氧化
加氧化剂
氧化剂:O2、Cl2、Br2、 KMnO4 、HNO3 、 H2O2
【现象】溶液变为红色
实验探究3:向盛有FeCl2溶液的试管中滴加KSCN溶液,再向其中滴加双氧水
请同学们用离子方程式表示出这个反应的原理
Fe3+ Fe2+
化合价降低,得电子,被还原
加还原剂
活动:请小组讨论,如果将铁盐重新转变成亚铁盐,你会选择什么试剂
Fe2+和Fe3+的检验
现象:
溶液由棕黄色变为浅绿色
实验探究4:FeCl3溶液与铁粉的反应
【步骤】向盛有FeCl3溶液的试管中加入铁粉,振荡后观察溶液颜色变化。
知识拓展:
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
核心素养
密封包装
薄膜防止Fe2+被氧化
?
Vc会有什么作用?
小结:铁盐、亚铁盐的性质
物质 角度 性质 发生反应的试剂
铁盐 类别 盐 NaOH溶液
化合价 +3价,氧化性 Fe、Cu、Zn、KI溶液
特性 Fe3+的特殊性质 KSCN溶液
亚铁盐 类别 盐 NaOH溶液
化合价 +2价→+3价,还原性 氯水、酸性KMnO4溶液、H2O2
+2价→0价,氧化性 Zn
双击达标,随堂检测
1、A
2、A
3、B
4、C
5、B
6、(1)取少量溶液,加入几滴硫氰化钾溶液,若观察到溶液变红色,则证明绿矾样品已被氧化
(2)取少量溶液,加入几滴酸性高锰酸钾溶液,若观察到溶液不褪色,则证明绿矾样品完全被氧化
(3)向溶液中加入适量铁粉
铁及其化合物
——铁盐和亚铁盐
执教教师:
第三章 铁 金属材料
第1节 铁及其化合物
(2)铁盐和亚铁盐
铁是人体细胞的必需成分,它具有造血功能,参与血红蛋白的生成以及细胞色素和各种酶的合成,促进生长。铁还在血液中起到运输和携带营养物质的作用。如果缺铁,人就会发生缺铁性的贫血,而且也会造成免疫功能的下降和新陈代谢的紊乱。
元素 人体内质量分数% 日需量( mg/天 )
Fe 6.0×10-3 13
F 3.7×10-3 3
Zn 3.3×10-3 13
Cu 1.0×10-4 5
…… …… ……
补铁药物
主任务:如果你是药品质检员,想要检测该补铁剂中铁元素含量与存在形式,你会怎么做呢?
补铁剂预处理:药片研磨成粉末,加水溶解,过滤,收集滤液。
几种情况?
①样品溶液中只含有Fe2+;
②样品溶液中只含有Fe3+;
③样品溶液中含有Fe2+和Fe3+。
补铁剂中的铁元素的存在形式?
氧气
Fe2+ Fe3+
【思考﹡交流】如何检验Fe2+和Fe3+?
方法1:看颜色
氯化铁[FeCl3]
硫酸铁[Fe2(SO4)3]
氯化亚铁[FeCl2]
硫酸亚铁[FeSO4]
棕黄色
浅绿色
实验探究:Fe2+和Fe3+的检验
实验探究:Fe2+和Fe3+的检验
方法2:加入NaOH溶液
实验探究1:在氯化铁和硫酸亚铁溶液中分别滴加氢氧化钠溶液
Fe3+ + 3OH- = Fe(OH)3↓
Fe2+ + 2OH- = Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
离子检验方法
Fe3+
几滴KSCN溶液
溶液变红色
Fe2+
几滴KSCN溶液
溶液不变色
FeCl2
FeCl3
实验探究2
实验探究:Fe2+和Fe3+的检验
方法3:加入KSCN溶液
Fe3+溶液
Fe2+溶液
溶液呈红色
溶液颜色无变化
【思考】能否用此方法检验Fe2+的存在
Fe2+ Fe3+
化合价升高,失电子,被氧化
加氧化剂
氧化剂:O2、Cl2、Br2、 KMnO4 、HNO3 、 H2O2
【现象】溶液变为红色
实验探究3:向盛有FeCl2溶液的试管中滴加KSCN溶液,再向其中滴加双氧水
请同学们用离子方程式表示出这个反应的原理
Fe3+ Fe2+
化合价降低,得电子,被还原
加还原剂
活动:请小组讨论,如果将铁盐重新转变成亚铁盐,你会选择什么试剂
Fe2+和Fe3+的检验
现象:
溶液由棕黄色变为浅绿色
实验探究4:FeCl3溶液与铁粉的反应
【步骤】向盛有FeCl3溶液的试管中加入铁粉,振荡后观察溶液颜色变化。
知识拓展:
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到 2~3年的保质期?
核心素养
密封包装
薄膜防止Fe2+被氧化
?
Vc会有什么作用?
小结:铁盐、亚铁盐的性质
物质 角度 性质 发生反应的试剂
铁盐 类别 盐 NaOH溶液
化合价 +3价,氧化性 Fe、Cu、Zn、KI溶液
特性 Fe3+的特殊性质 KSCN溶液
亚铁盐 类别 盐 NaOH溶液
化合价 +2价→+3价,还原性 氯水、酸性KMnO4溶液、H2O2
+2价→0价,氧化性 Zn
双击达标,随堂检测
1、A
2、A
3、B
4、C
5、B
6、(1)取少量溶液,加入几滴硫氰化钾溶液,若观察到溶液变红色,则证明绿矾样品已被氧化
(2)取少量溶液,加入几滴酸性高锰酸钾溶液,若观察到溶液不褪色,则证明绿矾样品完全被氧化
(3)向溶液中加入适量铁粉
