第三章第一节铁及其化合物第1课时 铁的单质 课件(共30张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章第一节铁及其化合物第1课时 铁的单质 课件(共30张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 87.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 18:00:10 | ||
图片预览










文档简介
(共30张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第1课时 铁的单质
人类在四千五百年前就开始使用铁器。铁是目前产量最大、使用最广泛的金属。铁及其化合物具有怎样的性质?应如何进行研究呢?通过研究铁及其化合物的性质和用途,可以使我们从物质类别和元素价态的视角认识物质间的转化关系,深化对物质及其变化多样性的认识。
金属材料对于生产发展、改善人类生活发挥了巨大作用。对不同类型合金的性能和用途的认识,可以进一步强化性能决定用途的观念。
陨铁制品
陨铁石孙悟空,有陨硫铁斑点,可见维斯台登结构,可以看到120度与60度的威德曼交角。
人类最早使用的铁,是来自太空的陨铁
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
赤铁矿
铁的存在与性质
一
1、铁的存在
Fe2O3 + CO 2Fe + CO2
2、铁的冶炼
铁的单质(性质)
二
1.铁的物理性质
银白色金属单质
铁粉(黑色)
铁块(银灰色)
熔点:1535℃
沸点:2750℃
密度:7.86g/cm3
良好的延展性、导热性好、能够导电(不如铜和铝)
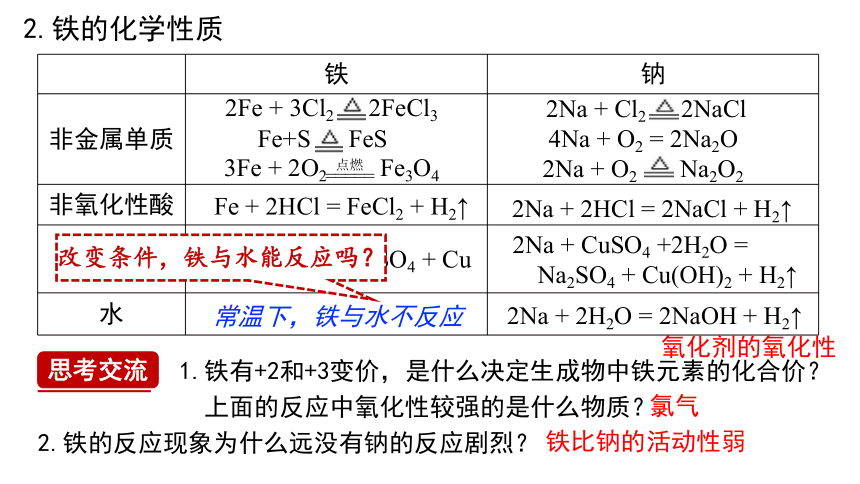
2.铁的化学性质
铁 钠
非金属单质
非氧化性酸
盐溶液
水
2Na + Cl2 2NaCl
4Na + O2 = 2Na2O
2Na + O2 Na2O2
2Na + 2HCl = 2NaCl + H2↑
Fe + 2HCl = FeCl2 + H2↑
2Na + CuSO4 +2H2O =
Na2SO4 + Cu(OH)2 + H2↑
Fe + CuSO4 = FeSO4 + Cu
2Na + 2H2O = 2NaOH + H2↑
常温下,铁与水不反应
2Fe + 3Cl2 2FeCl3
3Fe + 2O2 Fe3O4
Fe+S FeS
思考交流
1.铁有+2和+3变价,是什么决定生成物中铁元素的化合价?
上面的反应中氧化性较强的是什么物质?
2.铁的反应现象为什么远没有钠的反应剧烈?
氧化剂的氧化性
氯气
铁比钠的活动性弱
改变条件,铁与水能反应吗?
①棉花的作用: 。
②酒精灯的火焰可用防风罩套住,____________________。
③肥皂液的作用: 。
④结束时,先_________,再_________。
爆鸣
H2
提供水蒸气
为了产生气泡,便于通过点燃验证产物中的气体
思考交流
提高温度,加热效果更好
撤导管
移酒精灯
现象:加热时铁粉红热,蒸发皿中产生大量的肥皂泡,放出的气体能点燃且发出爆鸣声,反应后试管内固体仍为黑色。
A
例题
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
食补
药补
都是亚铁!
思考交流
砖的颜色为什么有青有红?
氧化铁可作外墙涂料
黏土中含有的铁元素经过不同工艺煅烧,分别生成了黑色的Fe3O4或FeO和红色的Fe2O3。
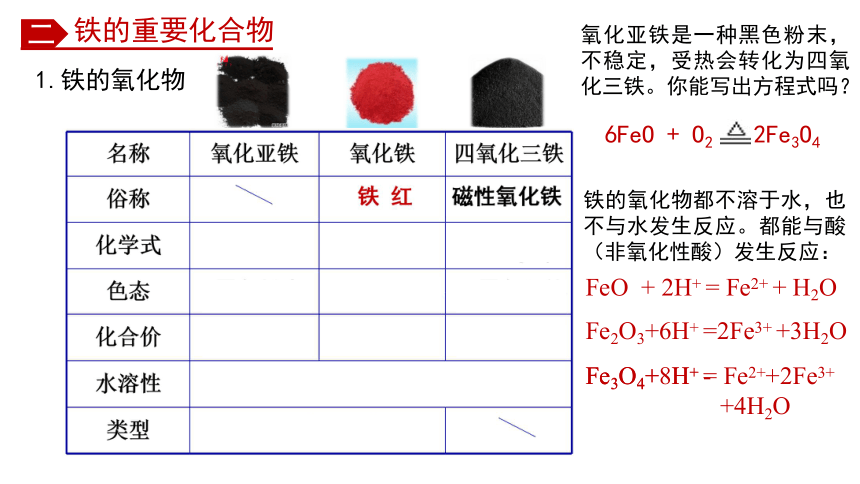
氧化亚铁是一种黑色粉末,不稳定,受热会转化为四氧化三铁。你能写出方程式吗?
6FeO + O2 2Fe3O4
铁的重要化合物
二
1.铁的氧化物
铁的氧化物都不溶于水,也不与水发生反应。都能与酸(非氧化性酸)发生反应:
FeO + 2H+ = Fe2+ + H2O
Fe2O3+6H+ =2Fe3+ +3H2O
Fe3O4+ H+ -
Fe3O4+8H+ = Fe2++2Fe3+
+4H2O
1、司南是中国古代劳动人民在长期的实践中对磁石磁性认识的发明,《论衡》中记载有“司南之杓(sháo),投之于地,其柢(chí)指南”。下列说法正确的是( )
A.“杓”的主要成分是四氧化三铁
B. 纯净的铁在常温下与水反应可得到磁性氧化铁
C. 磁性氧化铁为Fe2O3和FeO的混合物
D. Fe、Fe2O3、Fe3O4均具有磁性
A
例题
2.铁的氢氧化物
铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
2.铁的氢氧化物
铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
Fe3++ 3OH- = Fe(OH)3↓
红褐色沉淀
Fe2++ 2OH- = Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
白色絮状沉淀
迅速变成灰绿色,最终变成红褐色。
2Fe(OH)3 Fe2O3 + 3H2O
Fe(OH)3和Fe(OH)2都是不溶性碱,它们都能与酸发生反应。(但随着酸的氧化性强弱不同,产物不同,以后学习)
科学方法
类比是一种很好的科学方法,但也要谨慎使用
Ca(OH)2 CaO + H2O
Fe(OH)2 FeO + H2O
这里忽略了Fe(OH)2易被空气中氧气氧化为Fe(OH)3,继续灼烧,只能得到Fe2O3 。
坩埚里灼烧不溶性碱(或弱碱)
【分析】 Fe(OH)2会被溶解在溶液中的氧气氧化,因此实验室中得到Fe(OH)2的关键是防止氧气的干扰。其中包括溶液中的氧气的干扰与空气中的氧气的干扰。
【措施】
1.在新制的FeSO4溶液中加入少量铁粉;
2. 将NaOH溶液煮沸,减少溶解在溶液中的氧气含量;
3. 将胶头滴管伸入到液面以下,减少带入空气中的氧气。
方法:
①将吸有的NaOH溶液(煮沸过)的长胶头滴管伸人到新制的FeSO4溶液的液面以下,挤出NaOH溶液。
3.铁盐和亚铁盐
Fe3+溶液一般呈现棕黄色
Fe2+溶液一般呈现浅绿色
3.铁盐和亚铁盐
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色 :Fe3++ 3SCN- Fe(SCN)3(红色)
无明显变化:Fe2++2SCN-=Fe(SCN)2 (无色)
FeCl3溶液 FeCl2溶液
结论:可利用此KSCN(硫氰化钾)来确定Fe3+ 的存在和鉴别Fe3+、 Fe2+。
铁盐和亚铁盐
[实验3--3]向盛有 2 mL FeCl 3 溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴 KSCN 溶
液,观察实验现象。把上层清液转移至另一支试管,滴入几滴氯水,又发生了什么变化?
FeCl 3 (aq)
浅绿色溶液
( )
无变化
上层清液
血红色溶液
如果改变试剂的添加顺序,先向 FeCl 3 溶液中滴
加 KSCN 溶液,再加入铁粉,会有什么现象?
FeCl 3 (aq)
( )
血红色溶液
褪色
2Fe3++ Fe = 3Fe2+
2Fe2++ Cl2 = 2Fe3+ + 2Cl-
Fe3+ Fe2+
还原剂
氧化剂
实验:FeCl3溶液中先加铁粉,再滴加KSCN溶液,最后滴加氯水
P69【思考与讨论】
( 1 )Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂 举例写出相应反应的化学方程式,并加以说明。
(2)请你用图示的方法归纳Fe、Fe2+和Fe3+三者之间的相互转化关系,并与同学讨论。
(Fe可做还原剂;Fe2(SO4)3做氧化剂;FeSO4既可做氧化剂又可做还原剂。)
铁三角的应用
【背景】电子工业中常用覆铜板(以绝缘板为基材,一面或两面覆以铜箔,经热压而成的一种板状材料)为基础材料制作印刷电路板,印刷电路板广泛用于电视机、计算机、手机等电子产品中。用覆铜板制作印刷电路板的原理是,利用FeCl3溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀。即把预先设计好的电路在覆铜板上用蜡或不透水的物料覆盖,以保护不被腐蚀;然后,把覆铜板放到FeCl3溶液中。
根据工业上制作印刷电路板的原理,我们可以利用覆铜板制作所需要的图案(如图3-12)。
【探究】利用覆铜板制作图案(了解FeCl3制作印刷电路板)
【实验】取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案。
【思考与讨论】
(1)在上述实验中,发生了什么化学反应,生成的主要产物是什么 请运用氧化还原反应的规律进行分析,并尝试写出反应的化学方程式。
(2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”
2Fe3+ + Cu = 2Fe2+ + Cu2+
先加人适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加人氯水等氧化剂,实现FeCl3溶液的再生。
归纳小结
Fe3+和Fe2+的检验方法
(6)淀粉KI试液;
Fe2+溶液无明显现象,Fe3+溶液变蓝色。(原溶液里无其它可以氧化I-的物质)
(5)铁氰化钾K3[Fe(CN)6] (黄色)溶液检验Fe2+,生成有特征的深蓝色沉淀
例题
D
例题
C
例题
第三章 铁 金属材料
第一节 铁及其化合物
第1课时 铁的单质
人类在四千五百年前就开始使用铁器。铁是目前产量最大、使用最广泛的金属。铁及其化合物具有怎样的性质?应如何进行研究呢?通过研究铁及其化合物的性质和用途,可以使我们从物质类别和元素价态的视角认识物质间的转化关系,深化对物质及其变化多样性的认识。
金属材料对于生产发展、改善人类生活发挥了巨大作用。对不同类型合金的性能和用途的认识,可以进一步强化性能决定用途的观念。
陨铁制品
陨铁石孙悟空,有陨硫铁斑点,可见维斯台登结构,可以看到120度与60度的威德曼交角。
人类最早使用的铁,是来自太空的陨铁
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
赤铁矿
铁的存在与性质
一
1、铁的存在
Fe2O3 + CO 2Fe + CO2
2、铁的冶炼
铁的单质(性质)
二
1.铁的物理性质
银白色金属单质
铁粉(黑色)
铁块(银灰色)
熔点:1535℃
沸点:2750℃
密度:7.86g/cm3
良好的延展性、导热性好、能够导电(不如铜和铝)
2.铁的化学性质
铁 钠
非金属单质
非氧化性酸
盐溶液
水
2Na + Cl2 2NaCl
4Na + O2 = 2Na2O
2Na + O2 Na2O2
2Na + 2HCl = 2NaCl + H2↑
Fe + 2HCl = FeCl2 + H2↑
2Na + CuSO4 +2H2O =
Na2SO4 + Cu(OH)2 + H2↑
Fe + CuSO4 = FeSO4 + Cu
2Na + 2H2O = 2NaOH + H2↑
常温下,铁与水不反应
2Fe + 3Cl2 2FeCl3
3Fe + 2O2 Fe3O4
Fe+S FeS
思考交流
1.铁有+2和+3变价,是什么决定生成物中铁元素的化合价?
上面的反应中氧化性较强的是什么物质?
2.铁的反应现象为什么远没有钠的反应剧烈?
氧化剂的氧化性
氯气
铁比钠的活动性弱
改变条件,铁与水能反应吗?
①棉花的作用: 。
②酒精灯的火焰可用防风罩套住,____________________。
③肥皂液的作用: 。
④结束时,先_________,再_________。
爆鸣
H2
提供水蒸气
为了产生气泡,便于通过点燃验证产物中的气体
思考交流
提高温度,加热效果更好
撤导管
移酒精灯
现象:加热时铁粉红热,蒸发皿中产生大量的肥皂泡,放出的气体能点燃且发出爆鸣声,反应后试管内固体仍为黑色。
A
例题
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
食补
药补
都是亚铁!
思考交流
砖的颜色为什么有青有红?
氧化铁可作外墙涂料
黏土中含有的铁元素经过不同工艺煅烧,分别生成了黑色的Fe3O4或FeO和红色的Fe2O3。
氧化亚铁是一种黑色粉末,不稳定,受热会转化为四氧化三铁。你能写出方程式吗?
6FeO + O2 2Fe3O4
铁的重要化合物
二
1.铁的氧化物
铁的氧化物都不溶于水,也不与水发生反应。都能与酸(非氧化性酸)发生反应:
FeO + 2H+ = Fe2+ + H2O
Fe2O3+6H+ =2Fe3+ +3H2O
Fe3O4+ H+ -
Fe3O4+8H+ = Fe2++2Fe3+
+4H2O
1、司南是中国古代劳动人民在长期的实践中对磁石磁性认识的发明,《论衡》中记载有“司南之杓(sháo),投之于地,其柢(chí)指南”。下列说法正确的是( )
A.“杓”的主要成分是四氧化三铁
B. 纯净的铁在常温下与水反应可得到磁性氧化铁
C. 磁性氧化铁为Fe2O3和FeO的混合物
D. Fe、Fe2O3、Fe3O4均具有磁性
A
例题
2.铁的氢氧化物
铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
2.铁的氢氧化物
铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
Fe3++ 3OH- = Fe(OH)3↓
红褐色沉淀
Fe2++ 2OH- = Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
白色絮状沉淀
迅速变成灰绿色,最终变成红褐色。
2Fe(OH)3 Fe2O3 + 3H2O
Fe(OH)3和Fe(OH)2都是不溶性碱,它们都能与酸发生反应。(但随着酸的氧化性强弱不同,产物不同,以后学习)
科学方法
类比是一种很好的科学方法,但也要谨慎使用
Ca(OH)2 CaO + H2O
Fe(OH)2 FeO + H2O
这里忽略了Fe(OH)2易被空气中氧气氧化为Fe(OH)3,继续灼烧,只能得到Fe2O3 。
坩埚里灼烧不溶性碱(或弱碱)
【分析】 Fe(OH)2会被溶解在溶液中的氧气氧化,因此实验室中得到Fe(OH)2的关键是防止氧气的干扰。其中包括溶液中的氧气的干扰与空气中的氧气的干扰。
【措施】
1.在新制的FeSO4溶液中加入少量铁粉;
2. 将NaOH溶液煮沸,减少溶解在溶液中的氧气含量;
3. 将胶头滴管伸入到液面以下,减少带入空气中的氧气。
方法:
①将吸有的NaOH溶液(煮沸过)的长胶头滴管伸人到新制的FeSO4溶液的液面以下,挤出NaOH溶液。
3.铁盐和亚铁盐
Fe3+溶液一般呈现棕黄色
Fe2+溶液一般呈现浅绿色
3.铁盐和亚铁盐
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色 :Fe3++ 3SCN- Fe(SCN)3(红色)
无明显变化:Fe2++2SCN-=Fe(SCN)2 (无色)
FeCl3溶液 FeCl2溶液
结论:可利用此KSCN(硫氰化钾)来确定Fe3+ 的存在和鉴别Fe3+、 Fe2+。
铁盐和亚铁盐
[实验3--3]向盛有 2 mL FeCl 3 溶液的试管中加入少量铁粉,振荡试管。充分反应后,滴入几滴 KSCN 溶
液,观察实验现象。把上层清液转移至另一支试管,滴入几滴氯水,又发生了什么变化?
FeCl 3 (aq)
浅绿色溶液
( )
无变化
上层清液
血红色溶液
如果改变试剂的添加顺序,先向 FeCl 3 溶液中滴
加 KSCN 溶液,再加入铁粉,会有什么现象?
FeCl 3 (aq)
( )
血红色溶液
褪色
2Fe3++ Fe = 3Fe2+
2Fe2++ Cl2 = 2Fe3+ + 2Cl-
Fe3+ Fe2+
还原剂
氧化剂
实验:FeCl3溶液中先加铁粉,再滴加KSCN溶液,最后滴加氯水
P69【思考与讨论】
( 1 )Fe、FeSO4和Fe2(SO4)3三种物质中,哪种物质可做氧化剂,哪种可做还原剂,哪种既可做氧化剂又可做还原剂 举例写出相应反应的化学方程式,并加以说明。
(2)请你用图示的方法归纳Fe、Fe2+和Fe3+三者之间的相互转化关系,并与同学讨论。
(Fe可做还原剂;Fe2(SO4)3做氧化剂;FeSO4既可做氧化剂又可做还原剂。)
铁三角的应用
【背景】电子工业中常用覆铜板(以绝缘板为基材,一面或两面覆以铜箔,经热压而成的一种板状材料)为基础材料制作印刷电路板,印刷电路板广泛用于电视机、计算机、手机等电子产品中。用覆铜板制作印刷电路板的原理是,利用FeCl3溶液作为“腐蚀液”将覆铜板上不需要的铜腐蚀。即把预先设计好的电路在覆铜板上用蜡或不透水的物料覆盖,以保护不被腐蚀;然后,把覆铜板放到FeCl3溶液中。
根据工业上制作印刷电路板的原理,我们可以利用覆铜板制作所需要的图案(如图3-12)。
【探究】利用覆铜板制作图案(了解FeCl3制作印刷电路板)
【实验】取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。观察实验现象,并展示制作的图案。
【思考与讨论】
(1)在上述实验中,发生了什么化学反应,生成的主要产物是什么 请运用氧化还原反应的规律进行分析,并尝试写出反应的化学方程式。
(2)为使使用后的“腐蚀液”能得到充分利用,如何处理使用后的“腐蚀液”
2Fe3+ + Cu = 2Fe2+ + Cu2+
先加人适量的铁粉与废液中Cu2+反应,回收铜;再向废液中加人氯水等氧化剂,实现FeCl3溶液的再生。
归纳小结
Fe3+和Fe2+的检验方法
(6)淀粉KI试液;
Fe2+溶液无明显现象,Fe3+溶液变蓝色。(原溶液里无其它可以氧化I-的物质)
(5)铁氰化钾K3[Fe(CN)6] (黄色)溶液检验Fe2+,生成有特征的深蓝色沉淀
例题
D
例题
C
例题
