3.3 醛 酮 课件(共25张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.3 醛 酮 课件(共25张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
第三章 烃的含氧衍生物
第三节 醛 酮
含有香草醛
的兰花
杏仁含
苯甲醛
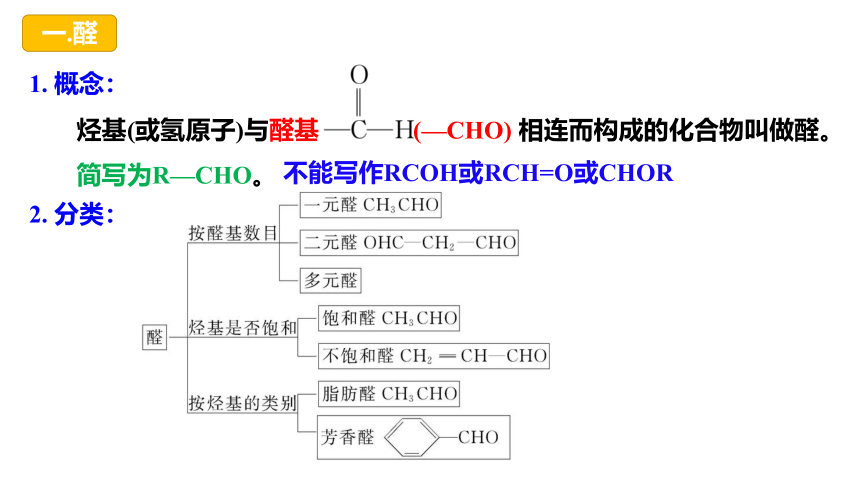
什么是醛?
烃基(或氢原子)与醛基 (—CHO) 相连而构成的化合物叫做醛。简写为R—CHO。
一.醛
1. 概念:
2. 分类:
不能写作RCOH或RCH=O或CHOR
C
O
H
H
甲醛
C
O
H
CH3
乙醛
丙醛
C
O
H
CH3CH2
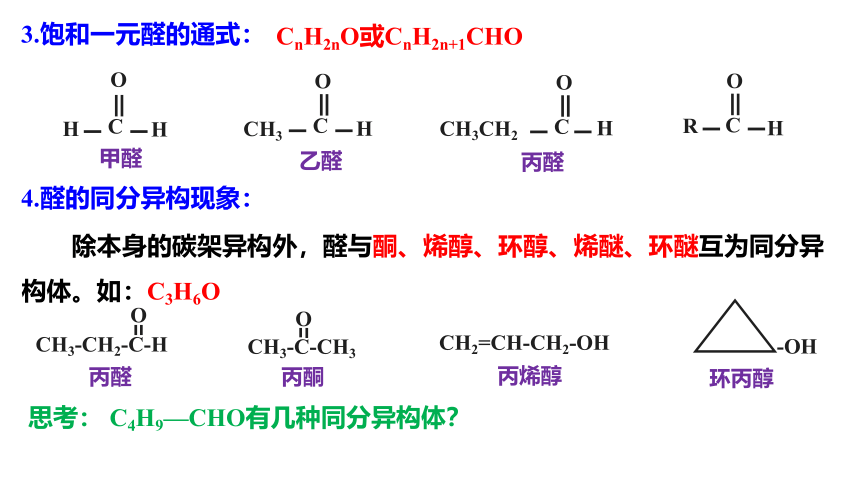
3.饱和一元醛的通式:
C
O
H
R
CnH2nO或CnH2n+1CHO
4.醛的同分异构现象:
除本身的碳架异构外,醛与酮、烯醇、环醇、烯醚、环醚互为同分异构体。如:C3H6O
CH3-CH2-C-H
O
CH3-C-CH3
O
CH2=CH-CH2-OH
-OH
丙醛
环丙醇
丙烯醇
丙酮
思考: C4H9—CHO有几种同分异构体?
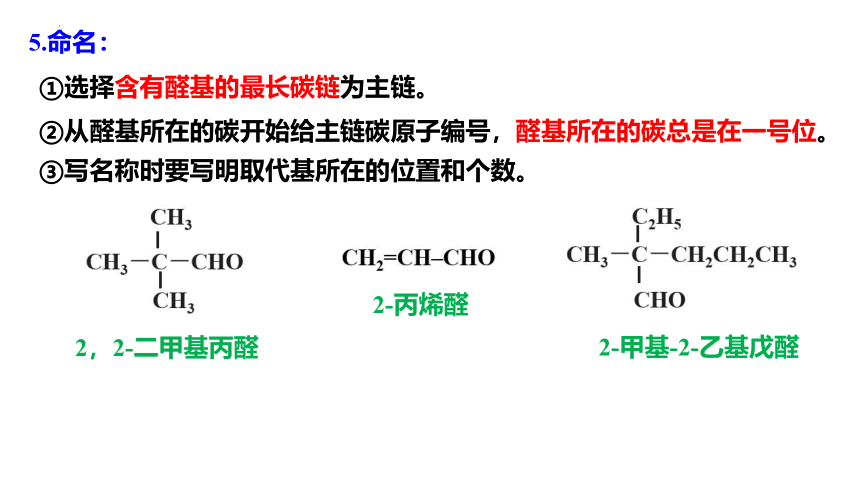
②从醛基所在的碳开始给主链碳原子编号,醛基所在的碳总是在一号位。
①选择含有醛基的最长碳链为主链。
③写名称时要写明取代基所在的位置和个数。
5.命名:
2,2-二甲基丙醛
2-丙烯醛
2-甲基-2-乙基戊醛
①熔沸点随碳原子数增多而变大,随支链增多而减小。密度随碳原子数增多而逐渐变大。
②随着碳原子数的增多,在水中的溶解度逐渐减小,低级醛易溶于水(HCHO、CH3CHO)。
③除了甲醛是气体,其他的醛常温下是液体或者固体,有一定气味(或刺激性气味)。
6.醛物理性质:
二.乙醛
1.物理性质:
色、态 气味 沸点 溶解性 密度 挥发性
无色液体
有刺激性气味
20.8℃
能与水、乙醇等互溶
比水小
易挥发
易燃烧
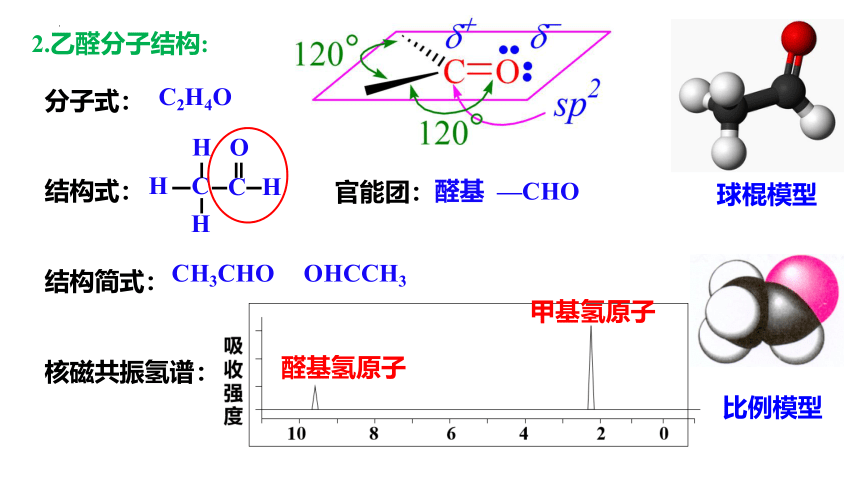
分子式:
结构式:
结构简式:
核磁共振氢谱:
2.乙醛分子结构:
C2H4O
H
H
H
H
C
C
O
CH3CHO
OHCCH3
比例模型
球棍模型
甲基氢原子
醛基氢原子
官能团:
醛基 —CHO
思考:乙醛分子中的醛基官能团对乙醛的化学性质起决定性作用,根据醛基的结构,判断乙醛有哪些化学性质?
H—C—C—H
O
H
H
C=O键不饱和,与C=C有相似性
C—H键,极性键,易断裂
醛基中碳氧双键与H2发生加成反应,被H2还原为醇
▲醛基不能与卤素单质加成,这点与C=C不同,
能跟烯烃起加成反应的试剂一般不跟醛起加成反应。
醛基中碳氢键较活泼,能被氧化成相应羧酸
3.乙醛的化学性质:
(1)加成反应
①催化加氢反应(也是乙醛的还原反应)
②与HCN加成
在醛基的碳氧双键中,氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。乙醛也能和一些极性试剂发生加成反应。
当极性分子与醛基发生加成反应时,带正电荷的原子或原子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。
乙醛可以被还原为乙醇,能否被氧化?
【实验3—7】在洁净的试管中加入1mL 2%AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
实验现象:向试管中滴加氨水,先产生白色沉淀后变澄清。加入乙醛,水浴加热一段时间后,试管内壁出现一层光亮的银镜。
AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3
AgOH+2NH3·H2O===[Ag(NH3)2]OH+2H2O
i. 配制银氨溶液:
ii . 水浴加热生成银镜
(2)氧化反应
①与银氨溶液反应——银镜反应
(巧记:一水 二银 三氨 乙酸铵)
解释:
CH3CHO CH3COOH CH3COONH4
被氧化
NH3
☆1 mol –CHO被氧化,有2 mol Ag(NH3)2OH被还原,生成2 mol Ag
用途:
此反应用来检验醛基的存在或数目。
在工业上也用银镜反应来制镜或保温瓶胆。
可用稀HNO3清洗试管内壁的银镜
①试管内壁必须洁净;
②必须是新配制的银氨溶液,久置的银氨溶液会生成易爆炸的AgN3(叠氮化银);
③配制银氨溶液是在2%的AgNO3溶液中滴加氨水至沉淀恰好溶解,溶液呈碱性,氨水不能过量,否则会生成容易爆炸的AgONC(雷酸银);
④乙醛用量不可过多,析出银的速率不能过快,否则不能形成光亮的银镜。
⑤必须60℃水浴加热,不能直接加热煮沸,不能振荡或摇动试管。
银镜反应实验成功的关键
【实验3—8】在试管里加入2mL 10%NaOH溶液,加入5滴 5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5mL乙醛溶液,加热。观察实验现象。
实验现象:滴入CuSO4溶液后产生蓝色絮状沉淀,滴入乙醛,加热至沸腾后,溶液中有砖红色沉淀产生。
②与新制氢氧化铜反应
i. 配制新制的Cu(OH)2悬浊液:
(碱必须过量)
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
ii. 乙醛的氧化:
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa+ Cu2O↓+3H2O
砖红色沉淀
用途:
此反应用来检验醛基的存在或数目。
在医学上也用来检验病人是否患有糖尿病。
☆1 mol –CHO被氧化,有2 mol Cu(OH)2被还原,生成1 mol Cu2O
①氢氧化铜溶液一定要新制;
②碱一定要过量;
③加热时须将混合溶液加热至沸腾,但加热煮沸时间不能过久,过久将出现黑色沉淀,原因是Cu(OH)2受热分解为CuO。
此实验成功的关键
③催化氧化
2CH3CHO+5O2 4CO2+4H2O
点燃
④燃烧
⑤乙醛可以被银氨溶液和新制氢氧化铜等弱氧化剂氧化,更能与酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水等强氧化剂反应。
5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + 3H2O + K2SO4
5CH3CHO + 2MnO4- + 6H+ = 5CH3COOH + 2Mn2+ + 3H2O
CH3CHO +Br2 +H2O = 2HBr +CH3COOH
注意:乙醛不能使溴的四氯化碳溶液褪色
4.乙醛的工业制法
①乙炔水化法
②乙烯氧化法
CH CH + H2O CH3-C-H
汞盐
O
2CH2 CH2 +O2 2CH3-C-H
钯盐
O
加压、加热
某醛的结构简式为(CH3)2C=CHCH2CH2CHO,实验操作中,哪一个官能团应先检验?
由于Br2也能氧化—CHO,所以必须先用银氨溶液氧化醛基,又因为氧化后溶液为碱性,所以应先用稀硝酸酸化后在加溴水检验碳碳双键。
三.醛类
1.最简单的醛—甲醛(蚁醛)
结构式:
分子式:
结构简式:
(2)甲醛分子结构
H
H
C
O
CH2O
HCHO
甲醛中碳原子采取sp2杂化,4个原子共平面,其结构可以看作两个醛基,甲醛与银氨溶液或新制氢氧化铜反应时,相当于两个醛基的用量
甲醛是一种无色、有强烈刺激性气味的气体,易溶于水,它的水溶液(又称福尔马林)具有杀菌、防腐性能,可用于消毒和制作生物标本。
(3)化学性质
①加成反应(还原反应)
HCHO+H2 CH3OH
催化剂
②氧化反应
HCHO+O2 CO2+H2O
点燃
a.燃烧
b.催化氧化
(H2CO3)
或:HCHO+O2
H-O-C-O-H
O
催化剂
2HCHO+O2 2HCOOH
催化剂
HCHO+4[Ag(NH3)2]OH
(NH4)2CO3+4Ag↓+6NH3+2H2O
c.发生银镜反应
d.与新制的氢氧化铜反应
HCHO+4Cu(OH)2+2NaOH Na2CO3+ 2Cu2O↓+6H2O
△
e. 被酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水等强氧化剂氧化
f.缩聚反应
酚醛树脂
OH
n + nHCHO CH2— + nH2O
OH
n
催化剂
2. 最简单的芳香醛—苯甲醛
俗称苦杏仁油,是一种有苦杏仁气味的无色液体,是制造染料、香料及药物的重要原料。
四. 酮
羰基与两个烃基相连的化合物叫做酮。
1. 最简单的酮—丙酮
(1)物理性质
丙酮是无色透明的液体,沸点56.2 ℃,易挥发,能与 水、乙醇等互溶。酮是重要的有机溶剂和化工原料,丙酮可用作化学纤维、钢瓶储存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
R、R’可以相同,也可以不同。
分子式:
结构简式:
(2)分子结构
C3H6O
或CH3COCH3
||
O
—C—
官能团:
酮羰基
(3)化学性质
①加成反应
②不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化。
醛的结构
化学性质
氧化反应
代表物:乙醛
物理性质
加成反应
银镜反应
与新制氢氧化铜反应
催化氧化
第三章 烃的含氧衍生物
第三节 醛 酮
含有香草醛
的兰花
杏仁含
苯甲醛
什么是醛?
烃基(或氢原子)与醛基 (—CHO) 相连而构成的化合物叫做醛。简写为R—CHO。
一.醛
1. 概念:
2. 分类:
不能写作RCOH或RCH=O或CHOR
C
O
H
H
甲醛
C
O
H
CH3
乙醛
丙醛
C
O
H
CH3CH2
3.饱和一元醛的通式:
C
O
H
R
CnH2nO或CnH2n+1CHO
4.醛的同分异构现象:
除本身的碳架异构外,醛与酮、烯醇、环醇、烯醚、环醚互为同分异构体。如:C3H6O
CH3-CH2-C-H
O
CH3-C-CH3
O
CH2=CH-CH2-OH
-OH
丙醛
环丙醇
丙烯醇
丙酮
思考: C4H9—CHO有几种同分异构体?
②从醛基所在的碳开始给主链碳原子编号,醛基所在的碳总是在一号位。
①选择含有醛基的最长碳链为主链。
③写名称时要写明取代基所在的位置和个数。
5.命名:
2,2-二甲基丙醛
2-丙烯醛
2-甲基-2-乙基戊醛
①熔沸点随碳原子数增多而变大,随支链增多而减小。密度随碳原子数增多而逐渐变大。
②随着碳原子数的增多,在水中的溶解度逐渐减小,低级醛易溶于水(HCHO、CH3CHO)。
③除了甲醛是气体,其他的醛常温下是液体或者固体,有一定气味(或刺激性气味)。
6.醛物理性质:
二.乙醛
1.物理性质:
色、态 气味 沸点 溶解性 密度 挥发性
无色液体
有刺激性气味
20.8℃
能与水、乙醇等互溶
比水小
易挥发
易燃烧
分子式:
结构式:
结构简式:
核磁共振氢谱:
2.乙醛分子结构:
C2H4O
H
H
H
H
C
C
O
CH3CHO
OHCCH3
比例模型
球棍模型
甲基氢原子
醛基氢原子
官能团:
醛基 —CHO
思考:乙醛分子中的醛基官能团对乙醛的化学性质起决定性作用,根据醛基的结构,判断乙醛有哪些化学性质?
H—C—C—H
O
H
H
C=O键不饱和,与C=C有相似性
C—H键,极性键,易断裂
醛基中碳氧双键与H2发生加成反应,被H2还原为醇
▲醛基不能与卤素单质加成,这点与C=C不同,
能跟烯烃起加成反应的试剂一般不跟醛起加成反应。
醛基中碳氢键较活泼,能被氧化成相应羧酸
3.乙醛的化学性质:
(1)加成反应
①催化加氢反应(也是乙醛的还原反应)
②与HCN加成
在醛基的碳氧双键中,氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷,从而使醛基具有较强的极性。乙醛也能和一些极性试剂发生加成反应。
当极性分子与醛基发生加成反应时,带正电荷的原子或原子团连接在氧原子上,带负电荷的原子或原子团连接在碳原子上。
乙醛可以被还原为乙醇,能否被氧化?
【实验3—7】在洁净的试管中加入1mL 2%AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液。再滴入3滴乙醛,振荡后将试管放在热水浴中温热。观察实验现象。
实验现象:向试管中滴加氨水,先产生白色沉淀后变澄清。加入乙醛,水浴加热一段时间后,试管内壁出现一层光亮的银镜。
AgNO3+NH3·H2O===AgOH↓(白色)+NH4NO3
AgOH+2NH3·H2O===[Ag(NH3)2]OH+2H2O
i. 配制银氨溶液:
ii . 水浴加热生成银镜
(2)氧化反应
①与银氨溶液反应——银镜反应
(巧记:一水 二银 三氨 乙酸铵)
解释:
CH3CHO CH3COOH CH3COONH4
被氧化
NH3
☆1 mol –CHO被氧化,有2 mol Ag(NH3)2OH被还原,生成2 mol Ag
用途:
此反应用来检验醛基的存在或数目。
在工业上也用银镜反应来制镜或保温瓶胆。
可用稀HNO3清洗试管内壁的银镜
①试管内壁必须洁净;
②必须是新配制的银氨溶液,久置的银氨溶液会生成易爆炸的AgN3(叠氮化银);
③配制银氨溶液是在2%的AgNO3溶液中滴加氨水至沉淀恰好溶解,溶液呈碱性,氨水不能过量,否则会生成容易爆炸的AgONC(雷酸银);
④乙醛用量不可过多,析出银的速率不能过快,否则不能形成光亮的银镜。
⑤必须60℃水浴加热,不能直接加热煮沸,不能振荡或摇动试管。
银镜反应实验成功的关键
【实验3—8】在试管里加入2mL 10%NaOH溶液,加入5滴 5%CuSO4溶液,得到新制的Cu(OH)2,振荡后加入0.5mL乙醛溶液,加热。观察实验现象。
实验现象:滴入CuSO4溶液后产生蓝色絮状沉淀,滴入乙醛,加热至沸腾后,溶液中有砖红色沉淀产生。
②与新制氢氧化铜反应
i. 配制新制的Cu(OH)2悬浊液:
(碱必须过量)
CuSO4 + 2NaOH = Cu(OH)2↓+Na2SO4
ii. 乙醛的氧化:
CH3CHO + 2Cu(OH)2 + NaOH CH3COONa+ Cu2O↓+3H2O
砖红色沉淀
用途:
此反应用来检验醛基的存在或数目。
在医学上也用来检验病人是否患有糖尿病。
☆1 mol –CHO被氧化,有2 mol Cu(OH)2被还原,生成1 mol Cu2O
①氢氧化铜溶液一定要新制;
②碱一定要过量;
③加热时须将混合溶液加热至沸腾,但加热煮沸时间不能过久,过久将出现黑色沉淀,原因是Cu(OH)2受热分解为CuO。
此实验成功的关键
③催化氧化
2CH3CHO+5O2 4CO2+4H2O
点燃
④燃烧
⑤乙醛可以被银氨溶液和新制氢氧化铜等弱氧化剂氧化,更能与酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水等强氧化剂反应。
5CH3CHO + 2KMnO4 + 3H2SO4 = 5CH3COOH + 2MnSO4 + 3H2O + K2SO4
5CH3CHO + 2MnO4- + 6H+ = 5CH3COOH + 2Mn2+ + 3H2O
CH3CHO +Br2 +H2O = 2HBr +CH3COOH
注意:乙醛不能使溴的四氯化碳溶液褪色
4.乙醛的工业制法
①乙炔水化法
②乙烯氧化法
CH CH + H2O CH3-C-H
汞盐
O
2CH2 CH2 +O2 2CH3-C-H
钯盐
O
加压、加热
某醛的结构简式为(CH3)2C=CHCH2CH2CHO,实验操作中,哪一个官能团应先检验?
由于Br2也能氧化—CHO,所以必须先用银氨溶液氧化醛基,又因为氧化后溶液为碱性,所以应先用稀硝酸酸化后在加溴水检验碳碳双键。
三.醛类
1.最简单的醛—甲醛(蚁醛)
结构式:
分子式:
结构简式:
(2)甲醛分子结构
H
H
C
O
CH2O
HCHO
甲醛中碳原子采取sp2杂化,4个原子共平面,其结构可以看作两个醛基,甲醛与银氨溶液或新制氢氧化铜反应时,相当于两个醛基的用量
甲醛是一种无色、有强烈刺激性气味的气体,易溶于水,它的水溶液(又称福尔马林)具有杀菌、防腐性能,可用于消毒和制作生物标本。
(3)化学性质
①加成反应(还原反应)
HCHO+H2 CH3OH
催化剂
②氧化反应
HCHO+O2 CO2+H2O
点燃
a.燃烧
b.催化氧化
(H2CO3)
或:HCHO+O2
H-O-C-O-H
O
催化剂
2HCHO+O2 2HCOOH
催化剂
HCHO+4[Ag(NH3)2]OH
(NH4)2CO3+4Ag↓+6NH3+2H2O
c.发生银镜反应
d.与新制的氢氧化铜反应
HCHO+4Cu(OH)2+2NaOH Na2CO3+ 2Cu2O↓+6H2O
△
e. 被酸性KMnO4溶液、酸性K2Cr2O7溶液、溴水等强氧化剂氧化
f.缩聚反应
酚醛树脂
OH
n + nHCHO CH2— + nH2O
OH
n
催化剂
2. 最简单的芳香醛—苯甲醛
俗称苦杏仁油,是一种有苦杏仁气味的无色液体,是制造染料、香料及药物的重要原料。
四. 酮
羰基与两个烃基相连的化合物叫做酮。
1. 最简单的酮—丙酮
(1)物理性质
丙酮是无色透明的液体,沸点56.2 ℃,易挥发,能与 水、乙醇等互溶。酮是重要的有机溶剂和化工原料,丙酮可用作化学纤维、钢瓶储存乙炔等的溶剂,还用于生产有机玻璃、农药和涂料等。
R、R’可以相同,也可以不同。
分子式:
结构简式:
(2)分子结构
C3H6O
或CH3COCH3
||
O
—C—
官能团:
酮羰基
(3)化学性质
①加成反应
②不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化。
醛的结构
化学性质
氧化反应
代表物:乙醛
物理性质
加成反应
银镜反应
与新制氢氧化铜反应
催化氧化
