3.4+第一课时 羧酸 课件(共22张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.4+第一课时 羧酸 课件(共22张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 18:01:58 | ||
图片预览






文档简介
(共22张PPT)
第三章 烃的含氧衍生物
第四节 羧酸 羧酸衍生物
第一课时 羧酸
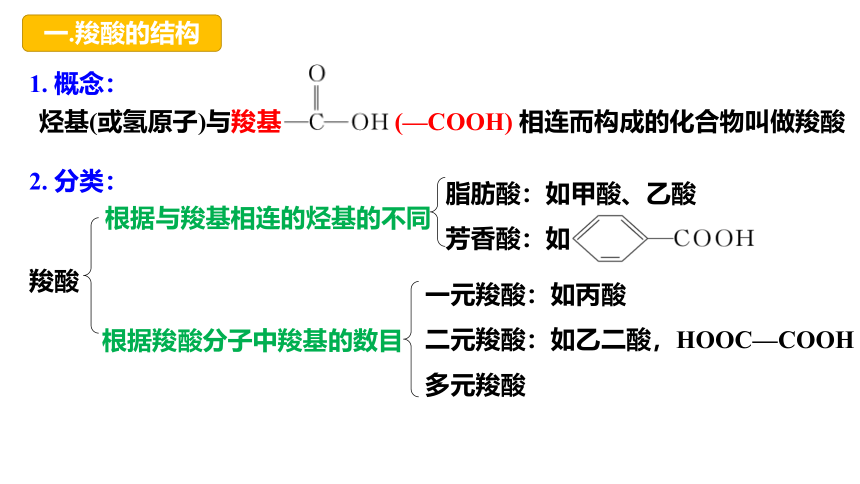
一.羧酸的结构
1. 概念:
2. 分类:
烃基(或氢原子)与羧基 (—COOH) 相连而构成的化合物叫做羧酸
根据羧酸分子中羧基的数目
羧酸
一元羧酸:如丙酸
二元羧酸:如乙二酸,HOOC—COOH
多元羧酸
脂肪酸:如甲酸、乙酸
芳香酸:如
根据与羧基相连的烃基的不同
C
O
OH
H
甲酸
C
O
OH
CH3
乙酸
丙酸
C
O
OH
CH3CH2
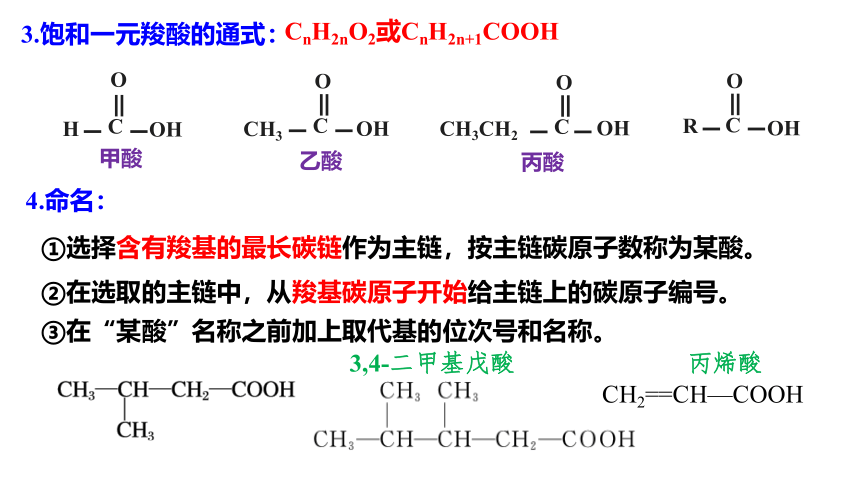
3.饱和一元羧酸的通式:
C
O
OH
R
CnH2nO2或CnH2n+1COOH
②在选取的主链中,从羧基碳原子开始给主链上的碳原子编号。
①选择含有羧基的最长碳链作为主链,按主链碳原子数称为某酸。
③在“某酸”名称之前加上取代基的位次号和名称。
4.命名:
CH2==CH—COOH
3,4-二甲基戊酸
丙烯酸
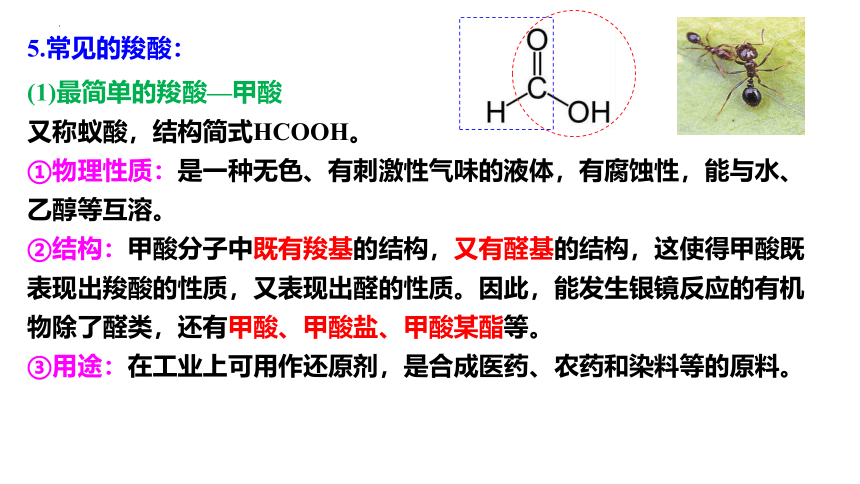
5.常见的羧酸:
(1)最简单的羧酸—甲酸
又称蚁酸,结构简式HCOOH。
①物理性质:是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
②结构:甲酸分子中既有羧基的结构,又有醛基的结构,这使得甲酸既表现出羧酸的性质,又表现出醛的性质。因此,能发生银镜反应的有机物除了醛类,还有甲酸、甲酸盐、甲酸某酯等。
③用途:在工业上可用作还原剂,是合成医药、农药和染料等的原料。
(2)最简单的芳香酸—苯甲酸(安息香酸)
①物理性质:无色晶体,易升华,微溶于水,易溶于乙醇。
②用途:用于合成香料、药物等,苯甲酸及其钠盐或钾盐是常用的食品防腐剂。
(3)最简单的二元酸—乙二酸(俗称草酸) HOOC—COOH
①物理性质:无色晶体,通常含有两分子结晶水,可溶于水和乙醇。
②用途:是二元羧酸中酸性最强的,是化学分析中常用的还原剂,能使KMnO4(H+)褪色、也是重要的化工原料,可作漂白剂。
CH
OH
COOH
CH3
乳酸(2-羟基丙酸)
CH2
OH
COOH
C
COOH
CH2
COOH
柠檬酸
有些有机酸分子中既含有羧基也含有羟基,所以又叫做羟基酸,它们既具有羟基的性质,也具有羧基的性质。
苹果酸
(4)羟基酸
(5)高级脂肪酸
含碳原子数较多的脂肪酸,它们的酸性很弱,在水中溶解度不大甚至难溶于水,常见高级脂肪酸有:
饱和高级脂肪酸:软脂酸(十六酸,棕榈酸) C15H31COOH
硬脂酸(十八酸) C17H35COOH
不饱和高级脂肪酸:油酸(9-十八碳烯酸) C17H33COOH
亚油酸(9,12-十八碳二烯酸)C17H31COOH
不饱和高级脂肪酸比饱和高级脂肪酸酸对人体更有益。
①溶解性:随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。高级脂肪酸是不溶于水的蜡状固体。
②熔、沸点:羧酸的熔、沸点随碳原子数的增多而升高,且与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
6.物理性质:
二.乙酸(俗称醋酸)
1.物理性质:
色、态 气味 熔点 沸点 溶解性
无色液体
有强烈刺激性气味
16.6℃
易溶于水、乙醇
117.9℃
固态
当温度低于熔点时,乙酸凝结成类似冰一样的晶体,所以纯净的乙酸又称为冰醋酸。
2.乙酸分子结构:
分子式:
结构简式:
C2H4O2
CH3COOH
结构式:
C
H
O
O
C
H
H
H
比例模型
球棍模型
羧基上的氢
甲基上的氢
官能团:
—COOH
乙酸的核磁共振氢谱
分析羧基的结构特点,推测乙酸在化学反应中的断键位置,判断乙酸有哪些化学性质。
酸 性
取 代 反 应
δ+
δ-
羧酸的化学性质主要取决于羧基。由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基结构中两个部位的化学键容易断裂。
①当O—H断裂时,会解离出H+,使羧酸表现出酸性;
②当C—O断裂时,—OH可以被其他基团取代,生成酯、酰胺等羧酸衍生物。
3.乙酸的化学性质:
(1)弱酸性
①使石蕊变红,能电离出H+
②能与活泼金属反应产生H2
③能与碱发生中和反应
④能与碱性氧化物反应
⑤能与某些盐发生反应
Mg(OH)2+2CH3COOH→(CH3COO)2Mg+H2O
CaCO3+2CH3COOH→(CH3COO)2Ca+CO2↑+H2O
CH3COOH CH3COO- + H+
【探究】设计实验证明羧酸具有酸性(甲酸、苯甲酸、乙二酸)
实验操作
实验现象
实验结论
溶液的红色最终褪去
甲酸、苯甲酸、乙二酸均呈酸性
【探究】利用下图所示的仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液酸性的酸性强弱。
写出①、②、③中的现象及反应
①中有无色气体产生;2CH3COOH+Na2CO3―→2CH3COONa +CO2↑+H2O
②中溶液变浑浊;
酸性:乙酸>碳酸>苯酚
除去①中挥发的乙酸
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
①先在具支试管中加入3 mL无水乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸,最后加入2 mL冰醋酸和碎瓷片。
②在小试管中加入一定量饱和Na2CO3溶液。
③按右图所示连接好装置。
④先缓慢均匀加热,再集中加热保持微沸2~3 min。
⑤熄灭酒精灯。
⑥观察实验现象。
在饱和碳酸钠溶液的上方有透明的油状液体产生,且能闻到香味。
(2)酯化反应:
羧酸和醇在酸催化下生成酯和水的反应叫酯化反应,属于取代反应。
CH3-C-18O-CH2-CH3 + H2O
=
O
CH3-C-O-H + H-18O-CH2-CH3
浓硫酸
=
O
酯化反应机理:
羧酸脱去羟基,醇脱去氢。
证实反应机理:
同位素示踪法
实验分析:
①浓硫酸的作用是?
②试剂加入的顺序?
催化剂:加快化学反应速率。
吸水剂:吸收生成的水,使平衡右移,提高酯的产率。
无水乙醇、浓硫酸、冰醋酸
③得到的反应产物是否纯净?主要杂质有哪些?
不纯净;主要含乙酸、乙醇。
④饱和Na2CO3溶液有什么作用?
中和乙酸 ;溶解乙醇 ;降低乙酸乙酯在水中的溶解度,使酯分层析出。
⑤为什么导管不插入饱和Na2CO3溶液中?
防止受热不匀发生倒吸。
⑥有无其它防倒吸的方法?
倒扣漏斗
加干燥管
加安全瓶
乙酸与乙醇的酯化反应是可逆的,在常温、无催化剂的条件下需15年才能达到平衡,乙酸、乙醇1:1投料,转化率仅为66.7%。请结合实验分析,实验中哪些方法增大了反应速率,提高了原料的利用率,增大了乙酸乙酯的产率。
增大相对廉价的乙醇的用量,提高乙酸的转化率;
冰醋酸最后加,减少乙酸的挥发;
集中加热保持微沸,有利于产物的生成和蒸出,以提高乙酸乙酯的产率;
浓硫酸作吸水剂,吸收生成的水,增大反应进行的程度;
用饱和碳酸钠溶液收集乙酸乙酯,减少乙酸乙酯的溶解;
使用长导管冷凝,减少乙酸乙酯的挥发。
增大反应速率:
提高原料的利用率,增大乙酸乙酯的产率:
使用无水乙醇和冰醋酸;加热;使用浓硫酸作催化剂;试管倾斜45°,增大受热面积。
(3)酯化反应的类型及常见产物:
①一元醇与一元羧酸之间的酯化反应
②多元醇与一元羧酸之间的酯化反应
③一元醇与多元羧酸之间的酯化反应
链状酯
④多元羧酸与多元醇之间的酯化反应
⑤羟基酸的自身酯化反应
环状酯
代表物 结构简式 羟基氢的活泼性 酸性 与钠反应 与NaOH的反应 与Na2CO3的反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增强
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
第三章 烃的含氧衍生物
第四节 羧酸 羧酸衍生物
第一课时 羧酸
一.羧酸的结构
1. 概念:
2. 分类:
烃基(或氢原子)与羧基 (—COOH) 相连而构成的化合物叫做羧酸
根据羧酸分子中羧基的数目
羧酸
一元羧酸:如丙酸
二元羧酸:如乙二酸,HOOC—COOH
多元羧酸
脂肪酸:如甲酸、乙酸
芳香酸:如
根据与羧基相连的烃基的不同
C
O
OH
H
甲酸
C
O
OH
CH3
乙酸
丙酸
C
O
OH
CH3CH2
3.饱和一元羧酸的通式:
C
O
OH
R
CnH2nO2或CnH2n+1COOH
②在选取的主链中,从羧基碳原子开始给主链上的碳原子编号。
①选择含有羧基的最长碳链作为主链,按主链碳原子数称为某酸。
③在“某酸”名称之前加上取代基的位次号和名称。
4.命名:
CH2==CH—COOH
3,4-二甲基戊酸
丙烯酸
5.常见的羧酸:
(1)最简单的羧酸—甲酸
又称蚁酸,结构简式HCOOH。
①物理性质:是一种无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。
②结构:甲酸分子中既有羧基的结构,又有醛基的结构,这使得甲酸既表现出羧酸的性质,又表现出醛的性质。因此,能发生银镜反应的有机物除了醛类,还有甲酸、甲酸盐、甲酸某酯等。
③用途:在工业上可用作还原剂,是合成医药、农药和染料等的原料。
(2)最简单的芳香酸—苯甲酸(安息香酸)
①物理性质:无色晶体,易升华,微溶于水,易溶于乙醇。
②用途:用于合成香料、药物等,苯甲酸及其钠盐或钾盐是常用的食品防腐剂。
(3)最简单的二元酸—乙二酸(俗称草酸) HOOC—COOH
①物理性质:无色晶体,通常含有两分子结晶水,可溶于水和乙醇。
②用途:是二元羧酸中酸性最强的,是化学分析中常用的还原剂,能使KMnO4(H+)褪色、也是重要的化工原料,可作漂白剂。
CH
OH
COOH
CH3
乳酸(2-羟基丙酸)
CH2
OH
COOH
C
COOH
CH2
COOH
柠檬酸
有些有机酸分子中既含有羧基也含有羟基,所以又叫做羟基酸,它们既具有羟基的性质,也具有羧基的性质。
苹果酸
(4)羟基酸
(5)高级脂肪酸
含碳原子数较多的脂肪酸,它们的酸性很弱,在水中溶解度不大甚至难溶于水,常见高级脂肪酸有:
饱和高级脂肪酸:软脂酸(十六酸,棕榈酸) C15H31COOH
硬脂酸(十八酸) C17H35COOH
不饱和高级脂肪酸:油酸(9-十八碳烯酸) C17H33COOH
亚油酸(9,12-十八碳二烯酸)C17H31COOH
不饱和高级脂肪酸比饱和高级脂肪酸酸对人体更有益。
①溶解性:随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水。甲酸、乙酸等分子中碳原子数较少的羧酸能够与水互溶。高级脂肪酸是不溶于水的蜡状固体。
②熔、沸点:羧酸的熔、沸点随碳原子数的增多而升高,且与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
6.物理性质:
二.乙酸(俗称醋酸)
1.物理性质:
色、态 气味 熔点 沸点 溶解性
无色液体
有强烈刺激性气味
16.6℃
易溶于水、乙醇
117.9℃
固态
当温度低于熔点时,乙酸凝结成类似冰一样的晶体,所以纯净的乙酸又称为冰醋酸。
2.乙酸分子结构:
分子式:
结构简式:
C2H4O2
CH3COOH
结构式:
C
H
O
O
C
H
H
H
比例模型
球棍模型
羧基上的氢
甲基上的氢
官能团:
—COOH
乙酸的核磁共振氢谱
分析羧基的结构特点,推测乙酸在化学反应中的断键位置,判断乙酸有哪些化学性质。
酸 性
取 代 反 应
δ+
δ-
羧酸的化学性质主要取决于羧基。由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时,羧基结构中两个部位的化学键容易断裂。
①当O—H断裂时,会解离出H+,使羧酸表现出酸性;
②当C—O断裂时,—OH可以被其他基团取代,生成酯、酰胺等羧酸衍生物。
3.乙酸的化学性质:
(1)弱酸性
①使石蕊变红,能电离出H+
②能与活泼金属反应产生H2
③能与碱发生中和反应
④能与碱性氧化物反应
⑤能与某些盐发生反应
Mg(OH)2+2CH3COOH→(CH3COO)2Mg+H2O
CaCO3+2CH3COOH→(CH3COO)2Ca+CO2↑+H2O
CH3COOH CH3COO- + H+
【探究】设计实验证明羧酸具有酸性(甲酸、苯甲酸、乙二酸)
实验操作
实验现象
实验结论
溶液的红色最终褪去
甲酸、苯甲酸、乙二酸均呈酸性
【探究】利用下图所示的仪器和药品,设计一个简单的一次性完成的实验装置,验证乙酸、碳酸和苯酚溶液酸性的酸性强弱。
写出①、②、③中的现象及反应
①中有无色气体产生;2CH3COOH+Na2CO3―→2CH3COONa +CO2↑+H2O
②中溶液变浑浊;
酸性:乙酸>碳酸>苯酚
除去①中挥发的乙酸
饱和碳酸钠溶液
乙醇、乙酸、浓硫酸
①先在具支试管中加入3 mL无水乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸,最后加入2 mL冰醋酸和碎瓷片。
②在小试管中加入一定量饱和Na2CO3溶液。
③按右图所示连接好装置。
④先缓慢均匀加热,再集中加热保持微沸2~3 min。
⑤熄灭酒精灯。
⑥观察实验现象。
在饱和碳酸钠溶液的上方有透明的油状液体产生,且能闻到香味。
(2)酯化反应:
羧酸和醇在酸催化下生成酯和水的反应叫酯化反应,属于取代反应。
CH3-C-18O-CH2-CH3 + H2O
=
O
CH3-C-O-H + H-18O-CH2-CH3
浓硫酸
=
O
酯化反应机理:
羧酸脱去羟基,醇脱去氢。
证实反应机理:
同位素示踪法
实验分析:
①浓硫酸的作用是?
②试剂加入的顺序?
催化剂:加快化学反应速率。
吸水剂:吸收生成的水,使平衡右移,提高酯的产率。
无水乙醇、浓硫酸、冰醋酸
③得到的反应产物是否纯净?主要杂质有哪些?
不纯净;主要含乙酸、乙醇。
④饱和Na2CO3溶液有什么作用?
中和乙酸 ;溶解乙醇 ;降低乙酸乙酯在水中的溶解度,使酯分层析出。
⑤为什么导管不插入饱和Na2CO3溶液中?
防止受热不匀发生倒吸。
⑥有无其它防倒吸的方法?
倒扣漏斗
加干燥管
加安全瓶
乙酸与乙醇的酯化反应是可逆的,在常温、无催化剂的条件下需15年才能达到平衡,乙酸、乙醇1:1投料,转化率仅为66.7%。请结合实验分析,实验中哪些方法增大了反应速率,提高了原料的利用率,增大了乙酸乙酯的产率。
增大相对廉价的乙醇的用量,提高乙酸的转化率;
冰醋酸最后加,减少乙酸的挥发;
集中加热保持微沸,有利于产物的生成和蒸出,以提高乙酸乙酯的产率;
浓硫酸作吸水剂,吸收生成的水,增大反应进行的程度;
用饱和碳酸钠溶液收集乙酸乙酯,减少乙酸乙酯的溶解;
使用长导管冷凝,减少乙酸乙酯的挥发。
增大反应速率:
提高原料的利用率,增大乙酸乙酯的产率:
使用无水乙醇和冰醋酸;加热;使用浓硫酸作催化剂;试管倾斜45°,增大受热面积。
(3)酯化反应的类型及常见产物:
①一元醇与一元羧酸之间的酯化反应
②多元醇与一元羧酸之间的酯化反应
③一元醇与多元羧酸之间的酯化反应
链状酯
④多元羧酸与多元醇之间的酯化反应
⑤羟基酸的自身酯化反应
环状酯
代表物 结构简式 羟基氢的活泼性 酸性 与钠反应 与NaOH的反应 与Na2CO3的反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增强
中性
比碳酸弱
比碳酸强
能
能
能
能
能
不能
不能
能
能,不产
生CO2
醇、酚、羧酸中羟基的比较
