2.1.2 钠的氧化物 课件(共17张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.2 钠的氧化物 课件(共17张PPT)2024-2025学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 369.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 18:04:34 | ||
图片预览



文档简介
(共17张PPT)
第一节 钠及其化合物
钠的氧化物
学习目标
1.运用比较的方法研究氧化钠和过氧化钠的性质及其差异。
2.掌握钠的氧化物在生产生活中的用途。
3.掌握过氧化钠与水、 CO2反应的计算。
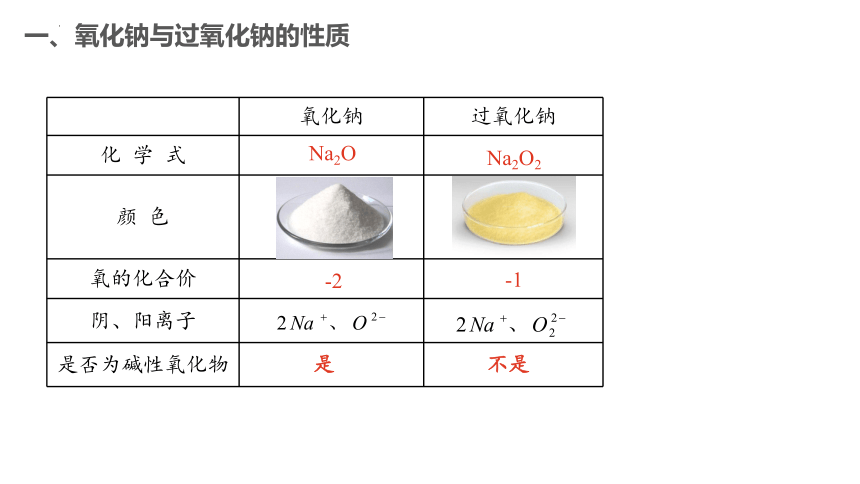
一、氧化钠与过氧化钠的性质
氧化钠 过氧化钠
化 学 式
颜 色
氧的化合价
阴、阳离子
是否为碱性氧化物
Na2O
Na2O2
-2
-1
是
不是
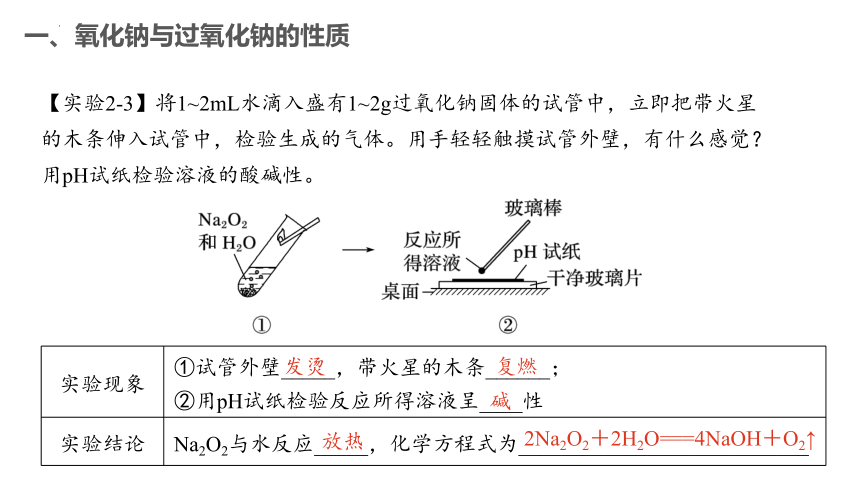
【实验2-3】将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性。
一、氧化钠与过氧化钠的性质
实验现象 ①试管外壁_____,带火星的木条______;
②用pH试纸检验反应所得溶液呈____性
实验结论 Na2O2与水反应_____,化学方程式为___________________________
发烫
复燃
碱
放热
2Na2O2+2H2O===4NaOH+O2↑
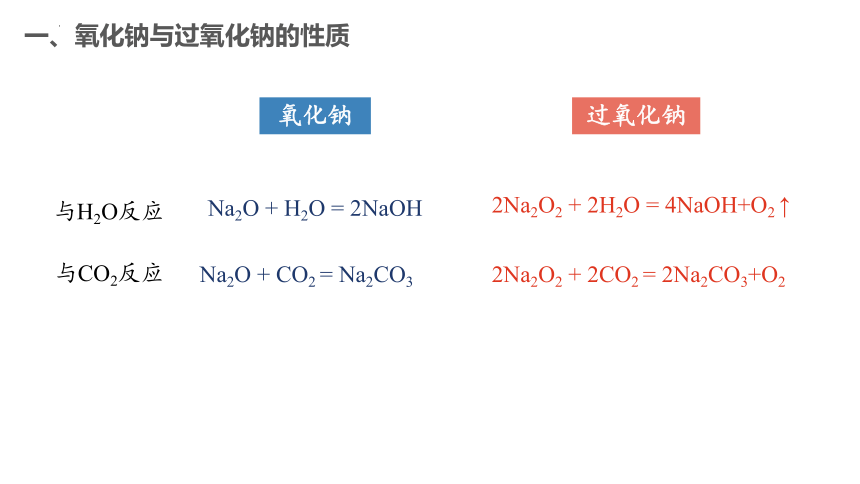
氧化钠
过氧化钠
与H2O反应
与CO2反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
一、氧化钠与过氧化钠的性质
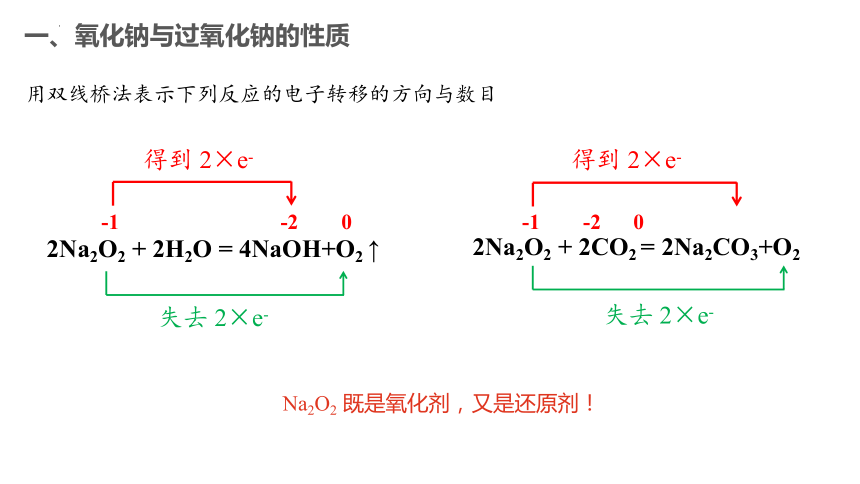
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2 + 2H2O = 4NaOH+O2 ↑
用双线桥法表示下列反应的电子转移的方向与数目
-1 -2 0
得到 2×e-
失去 2×e-
-1 -2 0
得到 2×e-
失去 2×e-
Na2O2 既是氧化剂,又是还原剂!
一、氧化钠与过氧化钠的性质
与HCl反应
2Na2O2+4HCl=4NaCl+2H2O+O2 ↑
Na2O+2HCl=2NaCl+H2O
稳定性
2Na2O+O2 == 2Na2O2(稳定性更好)
一、氧化钠与过氧化钠的性质
氧化钠
过氧化钠
与H2O反应
与CO2反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
过氧化钠特殊的化学性质
1.强氧化性
Na2O2+SO2 == Na2SO4
4Na2O2+4Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+
Na2O2+H2S===S↓+2NaOH
(1)Na2O2与SO2反应
(2)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2能使酚酞试液先变红后褪色
?
2.还原性
遇KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。
遇CO2、H2O、H+则发生自身的氧化还原反应。
3.自身氧化还原反应
过氧化钠特殊的化学性质
1.Na2O2与CO2、H2O反应的顺序
Na2O2
CO2、H2O(g)
视作Na2O2先与CO2反应,待CO2完全反应后,Na2O2再与H2O(g)发生反应
Na2O2与CO2、H2O计算规律
2.增重量等于可燃物质量的规律
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2
2H2O
O2
H2O
Na2O2
增重2H2
增重H2
2Na2O2
2CO2
O2
CO2
Na2O2
增重2CO
增重CO
CO2、水蒸气分别与足量的Na2O2反应时,
固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”
Na2O2与CO2、H2O计算规律
凡分子组成符合(CO)m (H2)n,的物质,mg该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为mg。
无机化合物:H2、CO及H2和CO的混合气体。
有机化合物:CH3OH(甲醇)、HCHO(甲醛)、
CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、
C6H12O6(葡萄糖)等。
Na2O2与CO2、H2O计算规律
2.增重量等于可燃物质量的规律
1.下列关于钠和过氧化钠与水反应的说法不正确的是
①将小块钠投入滴有石蕊溶液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③过氧化钠投入到水中会有大量氢气产生
④过氧化钠投入到滴有酚酞溶液的水中,烧杯中的水变红
A.仅①② B.仅②③ C.仅②③④ D.①②③④
课堂反馈
D
2.下列有关Na2O2的说法不正确的是
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O2在空气中久置变白,涉及有氧化还原反应
D.Na2O2粉末加入Ca(HCO3)2溶液中,产生气体和浑浊
课堂反馈
B
3.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
D
课堂反馈
课堂反馈
4.一定条件下,使26 g CO和O2的混合气体充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增加14 g,则原混合气体中CO和O2的质量比可能是A.9∶4 B.4∶9 C.7∶6 D.1∶1
C
课堂小结
钠的氧化物
氧化钠和过氧化钠的物理性质
氧化钠和过氧化钠的化学性质
过氧化钠的特殊性质
颜色状态
化合价
阴阳离子个数比
与H2O反应
与CO2反应
与盐酸反应
稳定性
与SO2反应
与H2S反应
与Fe3+反应
第一节 钠及其化合物
钠的氧化物
学习目标
1.运用比较的方法研究氧化钠和过氧化钠的性质及其差异。
2.掌握钠的氧化物在生产生活中的用途。
3.掌握过氧化钠与水、 CO2反应的计算。
一、氧化钠与过氧化钠的性质
氧化钠 过氧化钠
化 学 式
颜 色
氧的化合价
阴、阳离子
是否为碱性氧化物
Na2O
Na2O2
-2
-1
是
不是
【实验2-3】将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性。
一、氧化钠与过氧化钠的性质
实验现象 ①试管外壁_____,带火星的木条______;
②用pH试纸检验反应所得溶液呈____性
实验结论 Na2O2与水反应_____,化学方程式为___________________________
发烫
复燃
碱
放热
2Na2O2+2H2O===4NaOH+O2↑
氧化钠
过氧化钠
与H2O反应
与CO2反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
一、氧化钠与过氧化钠的性质
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2 + 2H2O = 4NaOH+O2 ↑
用双线桥法表示下列反应的电子转移的方向与数目
-1 -2 0
得到 2×e-
失去 2×e-
-1 -2 0
得到 2×e-
失去 2×e-
Na2O2 既是氧化剂,又是还原剂!
一、氧化钠与过氧化钠的性质
与HCl反应
2Na2O2+4HCl=4NaCl+2H2O+O2 ↑
Na2O+2HCl=2NaCl+H2O
稳定性
2Na2O+O2 == 2Na2O2(稳定性更好)
一、氧化钠与过氧化钠的性质
氧化钠
过氧化钠
与H2O反应
与CO2反应
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
过氧化钠特殊的化学性质
1.强氧化性
Na2O2+SO2 == Na2SO4
4Na2O2+4Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+
Na2O2+H2S===S↓+2NaOH
(1)Na2O2与SO2反应
(2)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2能使酚酞试液先变红后褪色
?
2.还原性
遇KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。
遇CO2、H2O、H+则发生自身的氧化还原反应。
3.自身氧化还原反应
过氧化钠特殊的化学性质
1.Na2O2与CO2、H2O反应的顺序
Na2O2
CO2、H2O(g)
视作Na2O2先与CO2反应,待CO2完全反应后,Na2O2再与H2O(g)发生反应
Na2O2与CO2、H2O计算规律
2.增重量等于可燃物质量的规律
2Na2O2 + 2H2O = 4NaOH+O2 ↑
2Na2O2 + 2CO2 = 2Na2CO3+O2
2Na2O2
2H2O
O2
H2O
Na2O2
增重2H2
增重H2
2Na2O2
2CO2
O2
CO2
Na2O2
增重2CO
增重CO
CO2、水蒸气分别与足量的Na2O2反应时,
固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”
Na2O2与CO2、H2O计算规律
凡分子组成符合(CO)m (H2)n,的物质,mg该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为mg。
无机化合物:H2、CO及H2和CO的混合气体。
有机化合物:CH3OH(甲醇)、HCHO(甲醛)、
CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、
C6H12O6(葡萄糖)等。
Na2O2与CO2、H2O计算规律
2.增重量等于可燃物质量的规律
1.下列关于钠和过氧化钠与水反应的说法不正确的是
①将小块钠投入滴有石蕊溶液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③过氧化钠投入到水中会有大量氢气产生
④过氧化钠投入到滴有酚酞溶液的水中,烧杯中的水变红
A.仅①② B.仅②③ C.仅②③④ D.①②③④
课堂反馈
D
2.下列有关Na2O2的说法不正确的是
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O2在空气中久置变白,涉及有氧化还原反应
D.Na2O2粉末加入Ca(HCO3)2溶液中,产生气体和浑浊
课堂反馈
B
3.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
D
课堂反馈
课堂反馈
4.一定条件下,使26 g CO和O2的混合气体充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增加14 g,则原混合气体中CO和O2的质量比可能是A.9∶4 B.4∶9 C.7∶6 D.1∶1
C
课堂小结
钠的氧化物
氧化钠和过氧化钠的物理性质
氧化钠和过氧化钠的化学性质
过氧化钠的特殊性质
颜色状态
化合价
阴阳离子个数比
与H2O反应
与CO2反应
与盐酸反应
稳定性
与SO2反应
与H2S反应
与Fe3+反应
