1.2研究有机化合物的一般步骤和方法 第一课时 分离、提纯 课件(共30张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2研究有机化合物的一般步骤和方法 第一课时 分离、提纯 课件(共30张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 18:06:43 | ||
图片预览







文档简介
(共30张PPT)
第二节 研究有机化合物的一般步骤和方法
第一课时 有机化合物的分离、提纯
1、熟知蒸馏法、重结晶法、萃取法提纯有机物的原理
2、能够根据有机物的性质、特点选择其分离方法
学习目标定位
研究有机化合物的基本步骤
粗产品
分离、提纯
定性分析
定量分析
波谱分析
除杂质
确定元素组成
质量分析
测定相对
分子质量
确定实验式
确定分子式
分析结构
确定结构式
从天然资源中提取有机物成分,通常得到的是含有杂质的粗品。工厂生产和实验室合成的有机物往往也混有未参加反应的原料和反应副产物等。进行有机化合物组成、结构、性质和应用的研究,首先要获得纯净的有机化合物。粗品必须经过分离、提纯才能得到较为纯净的物质。
提纯含杂质的有机化合物的基本方法是利用有机化合物与杂质物理性质的差异将它们分离。
在有机化学中常用的分离和提纯方法有蒸馏、萃取和重结晶等。
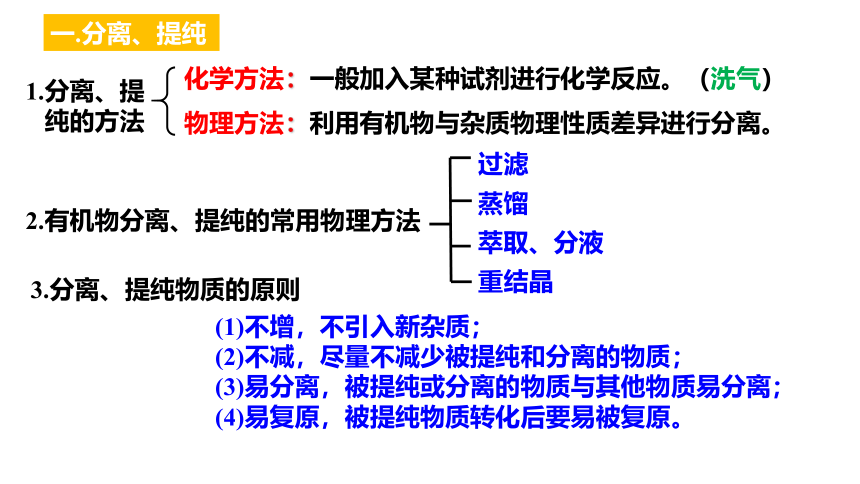
一.分离、提纯
物理方法:利用有机物与杂质物理性质差异进行分离。
化学方法:一般加入某种试剂进行化学反应。(洗气)
1.分离、提
纯的方法
2.有机物分离、提纯的常用物理方法
过滤
蒸馏
萃取、分液
重结晶
3.分离、提纯物质的原则
(1)不增,不引入新杂质;
(2)不减,尽量不减少被提纯和分离的物质;
(3)易分离,被提纯或分离的物质与其他物质易分离;
(4)易复原,被提纯物质转化后要易被复原。
1.蒸馏
(1)适用范围:
液态有机化合物
在一定温度和压强下加热液态混合物,沸点低的物质或组分首先汽化,将其蒸气导出后再进行冷凝,从而达到与沸点高的物质或组分相分离的目的。
(3)条件:
液体有机物中含有少量杂质;有机物热稳定性较强;与杂质的沸点相差较大,一般约大于30℃。
(2)原理:
利用各组分的沸点不同,除去难挥发或不挥发的杂质。
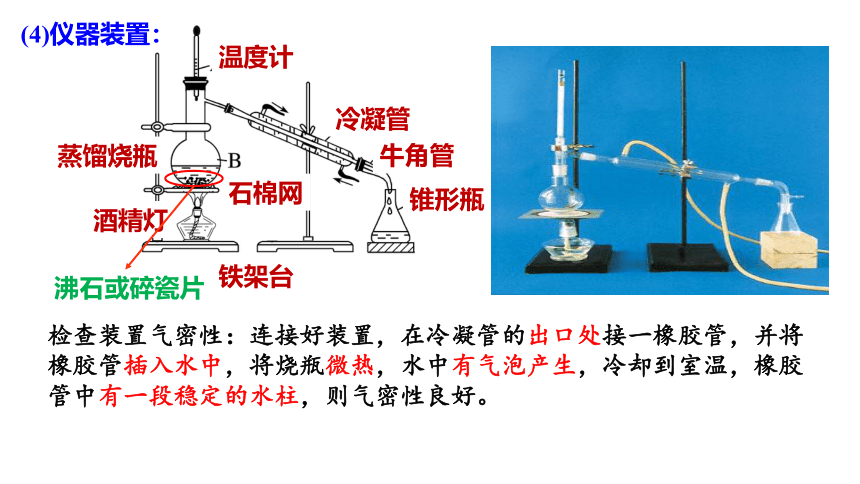
沸石或碎瓷片
温度计
蒸馏烧瓶
冷凝管
牛角管
锥形瓶
石棉网
酒精灯
铁架台
检查装置气密性:连接好装置,在冷凝管的出口处接一橡胶管,并将橡胶管插入水中,将烧瓶微热,水中有气泡产生,冷却到室温,橡胶管中有一段稳定的水柱,则气密性良好。
(4)仪器装置:
(5) 注意事项:
⑥进出水方向:
蒸馏烧瓶支管口处
防止液体暴沸
忘加沸石,应冷却至室温后再补加沸石
不能超过2/3,不能少于1/3,以1/2为宜
从上往下,从左往右
开始蒸馏时,应先开冷凝水,再加热;
蒸馏完毕,应该先撤酒精灯再关冷凝水
不能,需要垫石棉网
拆装置则相反
①组建装置的的顺序:
⑦加热与冷凝的顺序:
⑤蒸馏烧瓶能否直接加热:
③蒸馏烧瓶中放少量沸石或碎瓷片:
④蒸馏烧瓶中所盛放液体量:
②温度计水银球的部位:
下口流入,上口流出
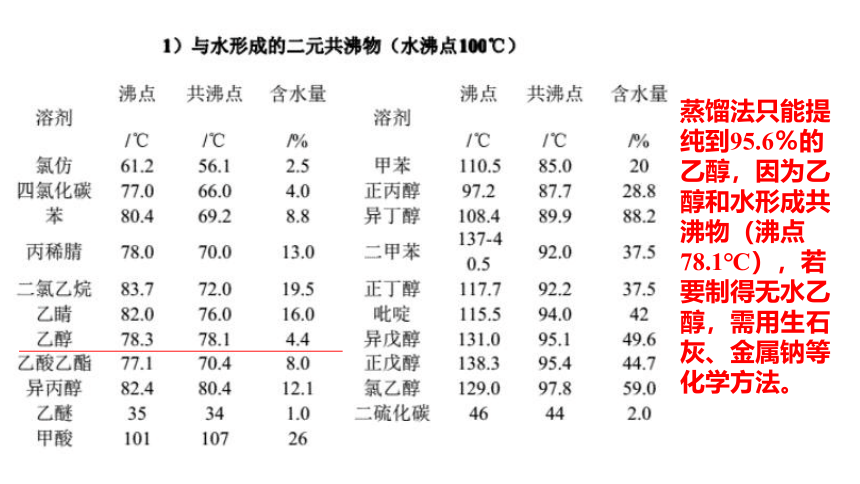
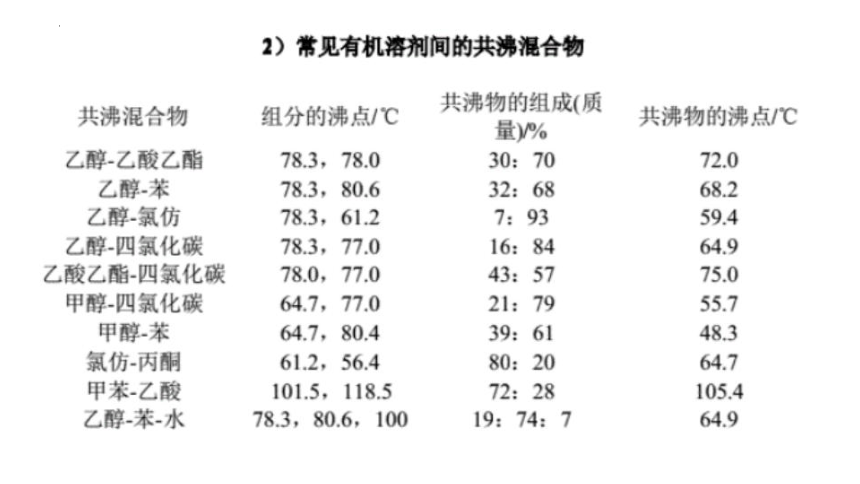
蒸馏法只能提纯到95.6%的乙醇,因为乙醇和水形成共沸物(沸点78.1℃),若要制得无水乙醇,需用生石灰、金属钠等化学方法。
2.萃取
①液—液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程。
(1)萃取原理:
②固—液萃取原理:用溶剂从固体物质中溶解出待分离组分的过程。
(2)萃取剂(萃取用的溶剂)选择的条件:
②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
①萃取剂和原溶剂不互溶。
③萃取剂与原溶液中的成分不反应。
④常用萃取剂:乙醚、乙酸乙酯、二氯甲烷、苯(密度小于水)、
四氯化碳(密度大于水)等。
(4)萃取装置:
分液漏斗
铁架台
烧杯
分液漏斗使用前必须检查是否漏液,若漏液可在活塞上涂少量凡士林。
检漏方法:关闭分液漏斗活塞,向分液漏斗中注入少量的水,看活塞处是否漏水,若不漏水,把活塞旋转180°,再看是否漏水;塞上瓶塞,倒置看是否漏水,若不漏水,放正后把瓶塞旋转180°,再倒置看是否漏水。
(3)分液:将萃取后互不相容的两层液体分开的操作。
分液可单独进行(水和植物油),但萃取之后一般要进行分液。
①用量筒量取10 ml碘的饱和水溶液,倒入分液漏斗,然后再注入4 ml四氯化碳,盖好玻璃塞。
②用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触;振荡后打开活塞,使漏斗内气体放出。
③将分液漏斗放在铁架台上,静置。
④待液体分层后,将分液漏斗颈上的玻璃塞打开(或使玻璃塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下,及时关闭活塞,再将上层液体从分液漏斗上口倒出。
(5)萃取操作:
(6)注意事项:
①分液漏斗使用前必须检查是否漏液。
②分液漏斗内液体总量不超过容积的2/3。
③右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡。
④振荡时,要不时旋开活塞放气,以防止分液漏斗内压强过大造成危险。
⑤静置后四氯化碳层变紫红色,水层黄色变浅或变为无色
⑥分液时,分液漏斗下端要紧靠烧杯内壁,以防液滴飞溅。
⑦先将分液漏斗颈上的玻璃塞打开(或使玻璃塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开。
⑧下层液体从下口流出,上层液体从上口倒出。
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
3.重结晶
(1)适用范围:
提纯固体有机化合物
(2)选择溶剂的要求:
①不与被提纯物质发生化学反应 。
②杂质在此溶剂中溶解度很小或很大,易于除去。
③被提纯的有机物在此溶剂中的溶解度受温度的影响较大;该有机物在热溶液中的溶解度较大,冷溶液中的溶解度较小,能够进行冷却结晶。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
温度/℃ 25 50 75
水中溶解度/g 0.34 0.85 2.2
资料:
1.苯甲酸可用作食品防腐剂。
2.纯净的苯甲酸为具有苯或甲醛气味的鳞片状或针状得无色结晶。
3.熔点122℃,沸点249℃,在100℃时迅速升华。
4.苯甲酸微溶于水,易溶于乙醇等有机溶剂。
(3)重结晶法提纯苯甲酸
(4)仪器:玻璃棒、烧杯、石棉网、铁架台、三脚架、 酒精灯、漏斗
(5)实验步骤:
①观察粗苯甲酸样品的状态。
②将1.0 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热、搅拌,使粗苯甲酸充分溶解。
③使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
④待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
加热溶解
趁热过滤
冷却结晶
粗苯甲酸
过滤洗涤
干燥称重
(6)注意事项:
①为了减少趁热过滤过程中的损失,一般再加入少量蒸馏水。
②降温时应慢慢冷却,不能骤冷,否则形成的结晶会吸附更多的杂质。
(7)讨论:
①重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
苯甲酸在不同温度的蒸馏水中溶解度不同。
加热溶解、趁热过滤、冷却结晶、过滤洗涤、干燥称量。
②溶解粗苯甲酸时加热作用是什么?趁热过滤的目的是什么?
加热是为了增大苯甲酸的溶解度,得到热的饱和苯甲酸溶液。
趁热过滤是为了防止溶液冷却苯甲酸提前结晶析出。
③实验操作中多次用到了玻璃棒,分别起到了哪些作用?
溶解时搅拌,加快溶解速度;过滤、洗涤时引流;干燥时用于转移晶体。
④如何检验提纯后的苯甲酸中氯化钠已被除净?
取少量最后一次洗涤后的液体,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无沉淀产生,则氯化钠被除净。
⑤在重结晶过程中进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?
洗去不溶性固体表面的苯甲酸。
⑥在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
洗去除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
⑦温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
温度过低,杂质的溶解度也会降低,部分杂质会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成热饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
之前再加少量蒸馏水,漏斗要预热
不能骤冷
3.重结晶
结晶的三种类型
蒸发结晶:通过蒸发,减少一部分溶剂使溶液达到饱和而析出晶体。此法适用于溶解度随温度变化不大的溶液,如NaCl的提纯。
蒸发浓缩,冷却结晶:将热的饱和溶液慢慢冷却后析出晶体。此法适用于溶解度随温度变化较大的溶液或结晶水合物,如KNO3的提纯。
重 结 晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
NaCl中混有少量的KNO3 :
KNO3中混有少量的NaCl:
蒸发浓缩、降温结晶
蒸发结晶、趁热过滤
1903年俄国植物生理学家和化学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,让溶有绿色植物色素的石油醚溶液自上而下地通过,结果植物色素被碳酸钙吸附,由一条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和确定维生素结构时应用了色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。常用的固定相有硅胶、氧化铝、碳酸钙、活性炭等。20世纪40年代后发展出了纸色谱、薄层色谱、气相色谱和高效液相色谱等多种色谱方法。
4.色谱法
分离提纯方法的选择
首先要熟记各种分离和提纯方法的适用范围,然后根据被提纯物与杂质性质的差异选择合适的分离提纯方法。
物理方法
获取
分离、提纯
纯净物
蒸馏
萃取
沸点差异
分离
分离
溶解性差异
关注三点:分离原理——实验仪器——操作步骤
本课总结
重结晶
分离
温度和溶解性差异
色谱法
分离
吸附性差异
蒸 馏
分离提纯液态有机化合物
温度计水银球的位置在蒸馏烧瓶支管口处
加入碎瓷片,防止暴沸
冷凝管中水的流向:下口流入,上口流出
萃取分液
分为液液萃取和固液萃取
萃取剂的选择原则
分液的步骤和注意事项
下层液体从下面放出,上层液体从上面倒出
重 结 晶
被分离物和杂质为固态
杂质在所选溶剂中溶解度很大或很小,易于除去
被提纯的物质在所选溶剂中溶解度受温度影响较大,能够冷却结晶
(1)若滤渣是所需的物质,洗涤的目的是除去晶体表面的可溶性杂质,得到更纯净的沉淀物。
(2)若滤液是所需的物质,洗涤的目的是洗涤过滤所得到的滤渣,把有用的物质如目标产物尽可能洗出来。
1.洗涤沉淀的目的
(1)蒸馏水:主要适用于除去沉淀吸附的可溶性杂质。
(2)冷水:除去沉淀的可溶性杂质,降低沉淀在水中的溶解度而减少沉淀损失。
(3)沉淀的饱和溶液:减小沉淀的溶解。
(4)有机溶剂(酒精、丙酮等):适用于易溶于水的固体,既减少了固体溶解,又利用有机溶剂的挥发性,除去固体表面的水分,产品易干燥。
2.常用洗涤剂
注洗涤液 (沿玻璃棒向漏斗中注入洗涤液)
↓
标准 (使洗涤液完全浸没沉淀或晶体)
↓
重复 (待洗涤液流尽后,重复操作2~3次)
3.沉淀洗涤的答题规范
取样 (取少量最后一次洗涤后的液体于一洁净的试管中)
↓
加试剂 [加入xx试剂(必要时加热,如检验NH4+)]
↓
现象 (不产生xx沉淀、溶液不变xx色或不产生xx气体)
↓
结论 (说明沉淀已经洗涤干净)
4.沉淀是否洗净的答题规范
第二节 研究有机化合物的一般步骤和方法
第一课时 有机化合物的分离、提纯
1、熟知蒸馏法、重结晶法、萃取法提纯有机物的原理
2、能够根据有机物的性质、特点选择其分离方法
学习目标定位
研究有机化合物的基本步骤
粗产品
分离、提纯
定性分析
定量分析
波谱分析
除杂质
确定元素组成
质量分析
测定相对
分子质量
确定实验式
确定分子式
分析结构
确定结构式
从天然资源中提取有机物成分,通常得到的是含有杂质的粗品。工厂生产和实验室合成的有机物往往也混有未参加反应的原料和反应副产物等。进行有机化合物组成、结构、性质和应用的研究,首先要获得纯净的有机化合物。粗品必须经过分离、提纯才能得到较为纯净的物质。
提纯含杂质的有机化合物的基本方法是利用有机化合物与杂质物理性质的差异将它们分离。
在有机化学中常用的分离和提纯方法有蒸馏、萃取和重结晶等。
一.分离、提纯
物理方法:利用有机物与杂质物理性质差异进行分离。
化学方法:一般加入某种试剂进行化学反应。(洗气)
1.分离、提
纯的方法
2.有机物分离、提纯的常用物理方法
过滤
蒸馏
萃取、分液
重结晶
3.分离、提纯物质的原则
(1)不增,不引入新杂质;
(2)不减,尽量不减少被提纯和分离的物质;
(3)易分离,被提纯或分离的物质与其他物质易分离;
(4)易复原,被提纯物质转化后要易被复原。
1.蒸馏
(1)适用范围:
液态有机化合物
在一定温度和压强下加热液态混合物,沸点低的物质或组分首先汽化,将其蒸气导出后再进行冷凝,从而达到与沸点高的物质或组分相分离的目的。
(3)条件:
液体有机物中含有少量杂质;有机物热稳定性较强;与杂质的沸点相差较大,一般约大于30℃。
(2)原理:
利用各组分的沸点不同,除去难挥发或不挥发的杂质。
沸石或碎瓷片
温度计
蒸馏烧瓶
冷凝管
牛角管
锥形瓶
石棉网
酒精灯
铁架台
检查装置气密性:连接好装置,在冷凝管的出口处接一橡胶管,并将橡胶管插入水中,将烧瓶微热,水中有气泡产生,冷却到室温,橡胶管中有一段稳定的水柱,则气密性良好。
(4)仪器装置:
(5) 注意事项:
⑥进出水方向:
蒸馏烧瓶支管口处
防止液体暴沸
忘加沸石,应冷却至室温后再补加沸石
不能超过2/3,不能少于1/3,以1/2为宜
从上往下,从左往右
开始蒸馏时,应先开冷凝水,再加热;
蒸馏完毕,应该先撤酒精灯再关冷凝水
不能,需要垫石棉网
拆装置则相反
①组建装置的的顺序:
⑦加热与冷凝的顺序:
⑤蒸馏烧瓶能否直接加热:
③蒸馏烧瓶中放少量沸石或碎瓷片:
④蒸馏烧瓶中所盛放液体量:
②温度计水银球的部位:
下口流入,上口流出
蒸馏法只能提纯到95.6%的乙醇,因为乙醇和水形成共沸物(沸点78.1℃),若要制得无水乙醇,需用生石灰、金属钠等化学方法。
2.萃取
①液—液萃取:利用待分离组分在两种互不相溶的溶剂中的溶解性不同,将其从一种溶剂转移到另一种溶剂的过程。
(1)萃取原理:
②固—液萃取原理:用溶剂从固体物质中溶解出待分离组分的过程。
(2)萃取剂(萃取用的溶剂)选择的条件:
②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
①萃取剂和原溶剂不互溶。
③萃取剂与原溶液中的成分不反应。
④常用萃取剂:乙醚、乙酸乙酯、二氯甲烷、苯(密度小于水)、
四氯化碳(密度大于水)等。
(4)萃取装置:
分液漏斗
铁架台
烧杯
分液漏斗使用前必须检查是否漏液,若漏液可在活塞上涂少量凡士林。
检漏方法:关闭分液漏斗活塞,向分液漏斗中注入少量的水,看活塞处是否漏水,若不漏水,把活塞旋转180°,再看是否漏水;塞上瓶塞,倒置看是否漏水,若不漏水,放正后把瓶塞旋转180°,再倒置看是否漏水。
(3)分液:将萃取后互不相容的两层液体分开的操作。
分液可单独进行(水和植物油),但萃取之后一般要进行分液。
①用量筒量取10 ml碘的饱和水溶液,倒入分液漏斗,然后再注入4 ml四氯化碳,盖好玻璃塞。
②用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触;振荡后打开活塞,使漏斗内气体放出。
③将分液漏斗放在铁架台上,静置。
④待液体分层后,将分液漏斗颈上的玻璃塞打开(或使玻璃塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下,及时关闭活塞,再将上层液体从分液漏斗上口倒出。
(5)萃取操作:
(6)注意事项:
①分液漏斗使用前必须检查是否漏液。
②分液漏斗内液体总量不超过容积的2/3。
③右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡。
④振荡时,要不时旋开活塞放气,以防止分液漏斗内压强过大造成危险。
⑤静置后四氯化碳层变紫红色,水层黄色变浅或变为无色
⑥分液时,分液漏斗下端要紧靠烧杯内壁,以防液滴飞溅。
⑦先将分液漏斗颈上的玻璃塞打开(或使玻璃塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开。
⑧下层液体从下口流出,上层液体从上口倒出。
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将杂质除去。
3.重结晶
(1)适用范围:
提纯固体有机化合物
(2)选择溶剂的要求:
①不与被提纯物质发生化学反应 。
②杂质在此溶剂中溶解度很小或很大,易于除去。
③被提纯的有机物在此溶剂中的溶解度受温度的影响较大;该有机物在热溶液中的溶解度较大,冷溶液中的溶解度较小,能够进行冷却结晶。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
温度/℃ 25 50 75
水中溶解度/g 0.34 0.85 2.2
资料:
1.苯甲酸可用作食品防腐剂。
2.纯净的苯甲酸为具有苯或甲醛气味的鳞片状或针状得无色结晶。
3.熔点122℃,沸点249℃,在100℃时迅速升华。
4.苯甲酸微溶于水,易溶于乙醇等有机溶剂。
(3)重结晶法提纯苯甲酸
(4)仪器:玻璃棒、烧杯、石棉网、铁架台、三脚架、 酒精灯、漏斗
(5)实验步骤:
①观察粗苯甲酸样品的状态。
②将1.0 g粗苯甲酸放入100 mL烧杯,加入50 mL蒸馏水。加热、搅拌,使粗苯甲酸充分溶解。
③使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
④待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
加热溶解
趁热过滤
冷却结晶
粗苯甲酸
过滤洗涤
干燥称重
(6)注意事项:
①为了减少趁热过滤过程中的损失,一般再加入少量蒸馏水。
②降温时应慢慢冷却,不能骤冷,否则形成的结晶会吸附更多的杂质。
(7)讨论:
①重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
苯甲酸在不同温度的蒸馏水中溶解度不同。
加热溶解、趁热过滤、冷却结晶、过滤洗涤、干燥称量。
②溶解粗苯甲酸时加热作用是什么?趁热过滤的目的是什么?
加热是为了增大苯甲酸的溶解度,得到热的饱和苯甲酸溶液。
趁热过滤是为了防止溶液冷却苯甲酸提前结晶析出。
③实验操作中多次用到了玻璃棒,分别起到了哪些作用?
溶解时搅拌,加快溶解速度;过滤、洗涤时引流;干燥时用于转移晶体。
④如何检验提纯后的苯甲酸中氯化钠已被除净?
取少量最后一次洗涤后的液体,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无沉淀产生,则氯化钠被除净。
⑤在重结晶过程中进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?
洗去不溶性固体表面的苯甲酸。
⑥在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
洗去除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的损耗。
⑦温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
温度过低,杂质的溶解度也会降低,部分杂质会析出,达不到提纯苯甲酸的目的;温度极低时,溶剂(水)也会结晶,给实验操作带来麻烦。
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
溶于溶剂,制成热饱和溶液,趁热过滤
冷却,结晶,过滤,洗涤
之前再加少量蒸馏水,漏斗要预热
不能骤冷
3.重结晶
结晶的三种类型
蒸发结晶:通过蒸发,减少一部分溶剂使溶液达到饱和而析出晶体。此法适用于溶解度随温度变化不大的溶液,如NaCl的提纯。
蒸发浓缩,冷却结晶:将热的饱和溶液慢慢冷却后析出晶体。此法适用于溶解度随温度变化较大的溶液或结晶水合物,如KNO3的提纯。
重 结 晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
NaCl中混有少量的KNO3 :
KNO3中混有少量的NaCl:
蒸发浓缩、降温结晶
蒸发结晶、趁热过滤
1903年俄国植物生理学家和化学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,让溶有绿色植物色素的石油醚溶液自上而下地通过,结果植物色素被碳酸钙吸附,由一条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和确定维生素结构时应用了色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。常用的固定相有硅胶、氧化铝、碳酸钙、活性炭等。20世纪40年代后发展出了纸色谱、薄层色谱、气相色谱和高效液相色谱等多种色谱方法。
4.色谱法
分离提纯方法的选择
首先要熟记各种分离和提纯方法的适用范围,然后根据被提纯物与杂质性质的差异选择合适的分离提纯方法。
物理方法
获取
分离、提纯
纯净物
蒸馏
萃取
沸点差异
分离
分离
溶解性差异
关注三点:分离原理——实验仪器——操作步骤
本课总结
重结晶
分离
温度和溶解性差异
色谱法
分离
吸附性差异
蒸 馏
分离提纯液态有机化合物
温度计水银球的位置在蒸馏烧瓶支管口处
加入碎瓷片,防止暴沸
冷凝管中水的流向:下口流入,上口流出
萃取分液
分为液液萃取和固液萃取
萃取剂的选择原则
分液的步骤和注意事项
下层液体从下面放出,上层液体从上面倒出
重 结 晶
被分离物和杂质为固态
杂质在所选溶剂中溶解度很大或很小,易于除去
被提纯的物质在所选溶剂中溶解度受温度影响较大,能够冷却结晶
(1)若滤渣是所需的物质,洗涤的目的是除去晶体表面的可溶性杂质,得到更纯净的沉淀物。
(2)若滤液是所需的物质,洗涤的目的是洗涤过滤所得到的滤渣,把有用的物质如目标产物尽可能洗出来。
1.洗涤沉淀的目的
(1)蒸馏水:主要适用于除去沉淀吸附的可溶性杂质。
(2)冷水:除去沉淀的可溶性杂质,降低沉淀在水中的溶解度而减少沉淀损失。
(3)沉淀的饱和溶液:减小沉淀的溶解。
(4)有机溶剂(酒精、丙酮等):适用于易溶于水的固体,既减少了固体溶解,又利用有机溶剂的挥发性,除去固体表面的水分,产品易干燥。
2.常用洗涤剂
注洗涤液 (沿玻璃棒向漏斗中注入洗涤液)
↓
标准 (使洗涤液完全浸没沉淀或晶体)
↓
重复 (待洗涤液流尽后,重复操作2~3次)
3.沉淀洗涤的答题规范
取样 (取少量最后一次洗涤后的液体于一洁净的试管中)
↓
加试剂 [加入xx试剂(必要时加热,如检验NH4+)]
↓
现象 (不产生xx沉淀、溶液不变xx色或不产生xx气体)
↓
结论 (说明沉淀已经洗涤干净)
4.沉淀是否洗净的答题规范
