4.2蛋白质 课件(共26张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 4.2蛋白质 课件(共26张PPT)2024-2025学年高二下学期化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-05 18:10:00 | ||
图片预览






文档简介
(共26张PPT)
第四章 生物大分子
第二节 蛋白质
“高精度的新冠病毒完整结构图展示给我们:它的表面蛋白会‘变脸’:有抗原暴露状态,抗原埋藏状态,还有膜融合后态。体外重组只有模仿出它的‘变脸’才能揭示真规律。
高精度病毒完整结构图有助于人类开发出更高效的疫苗。
【结论】从最简单的病毒、细菌等微生物直至人类,生物体内的绝大多数生命过程都与蛋白质密切相关,可以说没有蛋白质就没有生命。氨基酸是组成蛋白质的基本结构单位,要认识蛋白质,必须首先认识氨基酸。
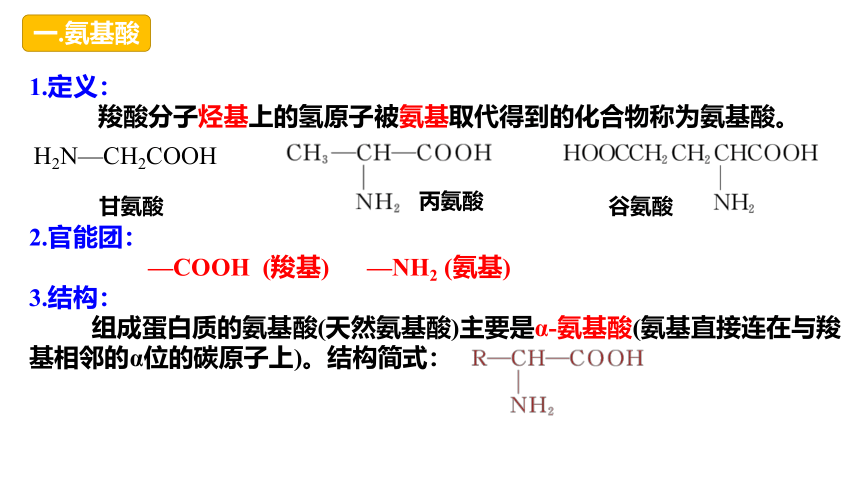
一.氨基酸
1.定义:
羧酸分子烃基上的氢原子被氨基取代得到的化合物称为氨基酸。
2.官能团:
—COOH (羧基) —NH2 (氨基)
3.结构:
组成蛋白质的氨基酸(天然氨基酸)主要是α-氨基酸(氨基直接连在与羧基相邻的α位的碳原子上)。结构简式:
H2N—CH2COOH
甘氨酸
丙氨酸
谷氨酸
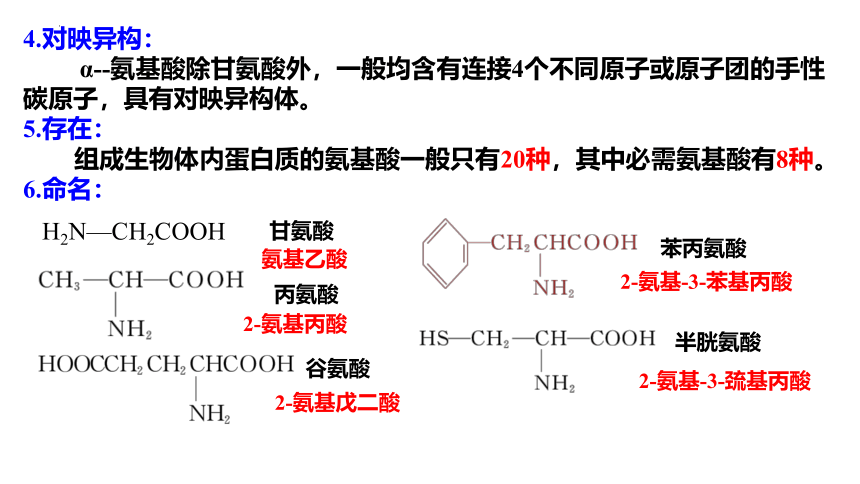
4.对映异构:
α -氨基酸除甘氨酸外,一般均含有连接4个不同原子或原子团的手性碳原子,具有对映异构体。
5.存在:
组成生物体内蛋白质的氨基酸一般只有20种,其中必需氨基酸有8种。
6.命名:
H2N—CH2COOH
甘氨酸
丙氨酸
谷氨酸
氨基乙酸
2-氨基丙酸
2-氨基戊二酸
苯丙氨酸
半胱氨酸
2-氨基-3-巯基丙酸
2-氨基-3-苯基丙酸
7.物理性质:
天然氨基酸均为无色晶体,熔点较高(多在200~300℃熔化时分解)。一般能溶于水,而难溶于乙醇、乙醚等有机溶剂。
8.化学性质:
①两性
氨基酸分子中—COOH是酸性基团,—NH2是碱性基团,因此氨基酸是两性化合物,能与酸、碱反应生成盐。
注:常见的既能与酸反应又能与碱反应的物质:
(1)金属:Al
(2)两性化合物:Al2O3、Al(OH)3
(3)弱酸的铵盐:(NH4)2CO3、CH3COONH4
(4)多元弱酸的酸式盐:NaHCO3、NH4HCO3
(5)氨基酸和蛋白质
②成肽反应
两个氨基酸分子(可以相同,也可以不同)在一定条件下,通过羧基与氨基间缩合脱去水,形成含有肽键( )的化合物,发生成肽反应,该反应属于取代反应。
反应机理:酸脱羟基,氨脱氢
肽键可简写为“—CONH—”,不能写成“—CNHO—”,两者的连接方式不同。
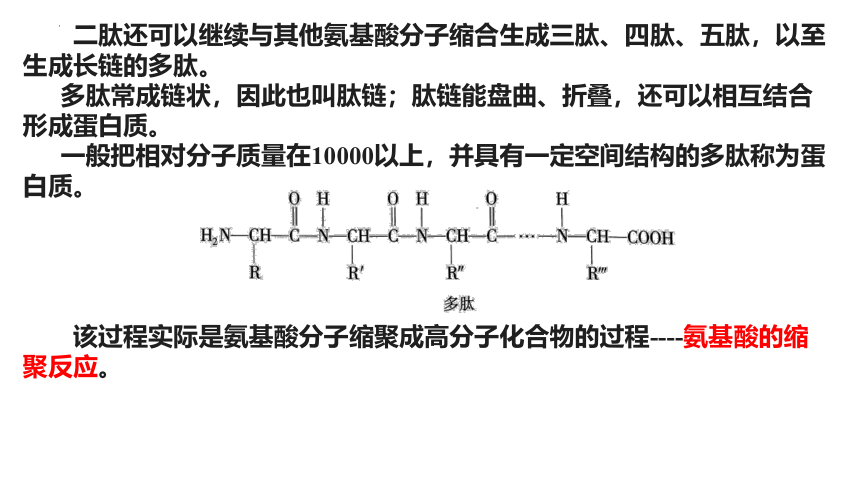
由两个氨基酸分子缩合后形成的含有肽键的化合物称为二肽。
二肽还可以继续与其他氨基酸分子缩合生成三肽、四肽、五肽,以至生成长链的多肽。
多肽常成链状,因此也叫肽链;肽链能盘曲、折叠,还可以相互结合形成蛋白质。
一般把相对分子质量在10000以上,并具有一定空间结构的多肽称为蛋白质。
该过程实际是氨基酸分子缩聚成高分子化合物的过程----氨基酸的缩聚反应。
写出苯丙氨酸与甘氨酸发生成肽反应生成多肽的化学方程式:
【小结】
缩聚反应:由一种单体进行缩聚反应,生成的小分子物质的量一般为n-1;由两种单体进行缩聚反应,生成的小分子物质的量一般为2n-1。
由n个同种氨基酸分子发生成肽反应,生成一个肽链时,会生成(n-1)个水分子和(n-1)个肽键。
二.蛋白质
1.定义:
蛋白质是由多种氨基酸通过肽键等相互连接形成的一类生物大分子(天然有机高分子化合物)。
2.元素组成:
蛋白质中主要含有C、H、O、N、S等元素,有些蛋白质还含有P、Fe、Zn、Cu等元素。其溶液具有胶体的某些性质。
蛋白质含量的测定:
由于生物组织中绝大部分氮元素来自蛋白质,而且各种来源不同的蛋白质的含氮量都比较接近,平均为16%。因此生物样品中的1 g氮元素大致相当于6.25 g蛋白质,由此可以通过测定样品中氮元素的质量分数计算出其中蛋白质的含量。
3.结构:
各种蛋白质在生物体内所具有的不同功能与蛋白质的结构密切相关。蛋白质的结构不仅取决于多肽链的氨基酸种类、数目及排列顺序,还与其特定的空间结构有关。
中国科学院生物化学研究所、有机化学研究所和北京大学化学系等单位的多位科学家经过长期不懈努力,在1965年首先合成了结晶牛胰岛素。
4.蛋白质的四级结构
4.化学性质:
①两性
形成蛋白质的多肽是由多个氨基酸缩合形成的,在多肽链的两端必然存在着自由的羧基(酸性基团)和氨基(碱性基团),所以蛋白质与氨基酸一样具有两性,能与酸、碱反应。
②水解
蛋白质在酸、碱或酶的作用下,水解生成相对分子质量较小的多肽,最终水解得到氨基酸。天然蛋白质水解的最终产物都是α-氨基酸。
HO
H
O
H
H—N—CH2—C—
O
H
—N—CH2—C—OH
③盐析
少量的某些可溶性盐(如硫酸铵、硫酸钠、氯化钠等)能促进蛋白质的溶解。但当这些盐在蛋白质溶液中达到一定浓度时,反而使蛋白质的溶解度降低而使其从溶液中析出,这种作用称为盐析。
实验操作 在试管中加入2mL饱和(NH4)2SO4溶液,
向其中加入几滴鸡蛋清溶液,振荡,
观察现象。再继续加入蒸馏水振荡,
观察现象。
实验现象
结论
加入(NH4)2SO4溶液,产生白色沉淀,加入H2O之后,沉淀溶解。
蛋白质的盐析是一个可逆过程,析出的蛋白质在水中仍能溶解,并不影响其活性。采用多次盐析和溶解,可以分离提纯蛋白质。
①蛋白质的盐析是物理变化,可逆过程,不影响蛋白质的活性;
②应选择轻金属的盐溶液[NaCl、Na2SO4、 (NH4)2SO4等] 进行盐析;
③要选择盐的浓溶液(或饱和溶液)进行盐析,且用量要大,因为少量的盐能促进蛋白质溶解;
④易溶于水的蛋白质可以进行盐析,不溶性蛋白质没有盐析的性质;
⑤多次盐析和溶解,可分离提纯蛋白质 。
④变性
a.概念:在某些物理或化学因素的影响下,蛋白质的性质和生理功能发生改变的现象称为蛋白质的变性。
b.物理因素:加热、加压、搅拌、振荡、超声波、紫外线和放射线等。
c.化学因素:强酸、强碱、重金属盐、乙醇、甲醛、丙酮等。
实验操作
实验现象
结论
三支试管内均产生白色沉淀,加水后沉淀均不溶解
变性后的蛋白质在水中不能重新溶解,变性会使蛋白质的结构发生变化,失去生理活性,发生了不可逆的变化。
在日常生活中有时需要利用蛋白质变性,如食物加热、乙醇、苯酚和可消毒等;有时防止蛋白质变性,疫苗等生物制剂要低温保存;登山防晒护目是为了防止蛋白质变性。
1.因误服铅、汞等重金属盐中毒的患者在急救时,为什么可口服牛奶、蛋清或豆浆?
2.为什么紫外线可用于环境和物品消毒,放射线可用于医疗器械灭菌?
误服重金属盐,可口服牛奶、蛋清或豆浆,其目的是使重金属盐与牛奶等发生变性作用,从而减少人体蛋白质变性。
紫外线用于环境和物品消毒,放射线用于医疗器械消毒,都是利用紫外线或放射线使细菌和病毒中的蛋白发生变性而使其死亡。
蛋白质盐析和变性的区别
盐析 变性
变化条件 浓的轻金属盐 受热、紫外线、强酸、强碱、重金属盐、某些有机物
变化实质 物理变化(溶解度降低) 化学变化(蛋白质性质改变)
变化过程 可逆 不可逆
用途 分离、提纯蛋白质 杀菌、消毒
⑤显色反应
含有苯环的蛋白质遇浓硝酸会有白色沉淀产生,加热后沉淀变黄色。
实验操作
实验现象
结论
加入浓硝酸生成白色沉淀,加热后,沉淀变黄
含有苯环的蛋白质(天然蛋白质都含苯环)沾上浓硝酸会出现黄色,可用于检验蛋白质。
⑥蛋白质灼烧有烧焦羽毛气味。
5.蛋白质的用途
(1)食物(人类必须的营养物质)
(2)工业原料:
动物的毛、蚕丝 (纺织原料)
动物的皮 (皮革)
动物的骨、皮、蹄 (动物胶)
牛奶中的酪素 (酪素塑料)
三.酶
1.定义:
酶是一类由细胞产生的、对生物体内的化学反应具有催化作用的有机化合物,其中绝大多数是蛋白质。
2.来源:
3.功能:
活细胞产生的
具有生物催化作用,反应结束后,酶本身保持不变。
4.酶的催化作用的特点:
(2)催化反应条件温和,一般在接近体温和中性的条件下进行,此时酶的催化作活性最高。超过适宜的温度时,酶将失去活性;
(3)具有高度的专一性。如蛋白酶只能催化蛋白质的水解反应,淀粉酶只对淀粉和糖原等多糖的水解起催化作用
(1)具有高效的催化作用,一般是普通催化剂的107倍
5.酶的应用:
(1)淀粉酶应用于食品、发酵、纺织、制药等工业;
(2)蛋白酶应用于医药、制革等工业;
(3)脂肪酶应用于脂肪水解、羊毛脱脂等;
(4)酶还可用于疾病的诊断。
第四章 生物大分子
第二节 蛋白质
“高精度的新冠病毒完整结构图展示给我们:它的表面蛋白会‘变脸’:有抗原暴露状态,抗原埋藏状态,还有膜融合后态。体外重组只有模仿出它的‘变脸’才能揭示真规律。
高精度病毒完整结构图有助于人类开发出更高效的疫苗。
【结论】从最简单的病毒、细菌等微生物直至人类,生物体内的绝大多数生命过程都与蛋白质密切相关,可以说没有蛋白质就没有生命。氨基酸是组成蛋白质的基本结构单位,要认识蛋白质,必须首先认识氨基酸。
一.氨基酸
1.定义:
羧酸分子烃基上的氢原子被氨基取代得到的化合物称为氨基酸。
2.官能团:
—COOH (羧基) —NH2 (氨基)
3.结构:
组成蛋白质的氨基酸(天然氨基酸)主要是α-氨基酸(氨基直接连在与羧基相邻的α位的碳原子上)。结构简式:
H2N—CH2COOH
甘氨酸
丙氨酸
谷氨酸
4.对映异构:
α -氨基酸除甘氨酸外,一般均含有连接4个不同原子或原子团的手性碳原子,具有对映异构体。
5.存在:
组成生物体内蛋白质的氨基酸一般只有20种,其中必需氨基酸有8种。
6.命名:
H2N—CH2COOH
甘氨酸
丙氨酸
谷氨酸
氨基乙酸
2-氨基丙酸
2-氨基戊二酸
苯丙氨酸
半胱氨酸
2-氨基-3-巯基丙酸
2-氨基-3-苯基丙酸
7.物理性质:
天然氨基酸均为无色晶体,熔点较高(多在200~300℃熔化时分解)。一般能溶于水,而难溶于乙醇、乙醚等有机溶剂。
8.化学性质:
①两性
氨基酸分子中—COOH是酸性基团,—NH2是碱性基团,因此氨基酸是两性化合物,能与酸、碱反应生成盐。
注:常见的既能与酸反应又能与碱反应的物质:
(1)金属:Al
(2)两性化合物:Al2O3、Al(OH)3
(3)弱酸的铵盐:(NH4)2CO3、CH3COONH4
(4)多元弱酸的酸式盐:NaHCO3、NH4HCO3
(5)氨基酸和蛋白质
②成肽反应
两个氨基酸分子(可以相同,也可以不同)在一定条件下,通过羧基与氨基间缩合脱去水,形成含有肽键( )的化合物,发生成肽反应,该反应属于取代反应。
反应机理:酸脱羟基,氨脱氢
肽键可简写为“—CONH—”,不能写成“—CNHO—”,两者的连接方式不同。
由两个氨基酸分子缩合后形成的含有肽键的化合物称为二肽。
二肽还可以继续与其他氨基酸分子缩合生成三肽、四肽、五肽,以至生成长链的多肽。
多肽常成链状,因此也叫肽链;肽链能盘曲、折叠,还可以相互结合形成蛋白质。
一般把相对分子质量在10000以上,并具有一定空间结构的多肽称为蛋白质。
该过程实际是氨基酸分子缩聚成高分子化合物的过程----氨基酸的缩聚反应。
写出苯丙氨酸与甘氨酸发生成肽反应生成多肽的化学方程式:
【小结】
缩聚反应:由一种单体进行缩聚反应,生成的小分子物质的量一般为n-1;由两种单体进行缩聚反应,生成的小分子物质的量一般为2n-1。
由n个同种氨基酸分子发生成肽反应,生成一个肽链时,会生成(n-1)个水分子和(n-1)个肽键。
二.蛋白质
1.定义:
蛋白质是由多种氨基酸通过肽键等相互连接形成的一类生物大分子(天然有机高分子化合物)。
2.元素组成:
蛋白质中主要含有C、H、O、N、S等元素,有些蛋白质还含有P、Fe、Zn、Cu等元素。其溶液具有胶体的某些性质。
蛋白质含量的测定:
由于生物组织中绝大部分氮元素来自蛋白质,而且各种来源不同的蛋白质的含氮量都比较接近,平均为16%。因此生物样品中的1 g氮元素大致相当于6.25 g蛋白质,由此可以通过测定样品中氮元素的质量分数计算出其中蛋白质的含量。
3.结构:
各种蛋白质在生物体内所具有的不同功能与蛋白质的结构密切相关。蛋白质的结构不仅取决于多肽链的氨基酸种类、数目及排列顺序,还与其特定的空间结构有关。
中国科学院生物化学研究所、有机化学研究所和北京大学化学系等单位的多位科学家经过长期不懈努力,在1965年首先合成了结晶牛胰岛素。
4.蛋白质的四级结构
4.化学性质:
①两性
形成蛋白质的多肽是由多个氨基酸缩合形成的,在多肽链的两端必然存在着自由的羧基(酸性基团)和氨基(碱性基团),所以蛋白质与氨基酸一样具有两性,能与酸、碱反应。
②水解
蛋白质在酸、碱或酶的作用下,水解生成相对分子质量较小的多肽,最终水解得到氨基酸。天然蛋白质水解的最终产物都是α-氨基酸。
HO
H
O
H
H—N—CH2—C—
O
H
—N—CH2—C—OH
③盐析
少量的某些可溶性盐(如硫酸铵、硫酸钠、氯化钠等)能促进蛋白质的溶解。但当这些盐在蛋白质溶液中达到一定浓度时,反而使蛋白质的溶解度降低而使其从溶液中析出,这种作用称为盐析。
实验操作 在试管中加入2mL饱和(NH4)2SO4溶液,
向其中加入几滴鸡蛋清溶液,振荡,
观察现象。再继续加入蒸馏水振荡,
观察现象。
实验现象
结论
加入(NH4)2SO4溶液,产生白色沉淀,加入H2O之后,沉淀溶解。
蛋白质的盐析是一个可逆过程,析出的蛋白质在水中仍能溶解,并不影响其活性。采用多次盐析和溶解,可以分离提纯蛋白质。
①蛋白质的盐析是物理变化,可逆过程,不影响蛋白质的活性;
②应选择轻金属的盐溶液[NaCl、Na2SO4、 (NH4)2SO4等] 进行盐析;
③要选择盐的浓溶液(或饱和溶液)进行盐析,且用量要大,因为少量的盐能促进蛋白质溶解;
④易溶于水的蛋白质可以进行盐析,不溶性蛋白质没有盐析的性质;
⑤多次盐析和溶解,可分离提纯蛋白质 。
④变性
a.概念:在某些物理或化学因素的影响下,蛋白质的性质和生理功能发生改变的现象称为蛋白质的变性。
b.物理因素:加热、加压、搅拌、振荡、超声波、紫外线和放射线等。
c.化学因素:强酸、强碱、重金属盐、乙醇、甲醛、丙酮等。
实验操作
实验现象
结论
三支试管内均产生白色沉淀,加水后沉淀均不溶解
变性后的蛋白质在水中不能重新溶解,变性会使蛋白质的结构发生变化,失去生理活性,发生了不可逆的变化。
在日常生活中有时需要利用蛋白质变性,如食物加热、乙醇、苯酚和可消毒等;有时防止蛋白质变性,疫苗等生物制剂要低温保存;登山防晒护目是为了防止蛋白质变性。
1.因误服铅、汞等重金属盐中毒的患者在急救时,为什么可口服牛奶、蛋清或豆浆?
2.为什么紫外线可用于环境和物品消毒,放射线可用于医疗器械灭菌?
误服重金属盐,可口服牛奶、蛋清或豆浆,其目的是使重金属盐与牛奶等发生变性作用,从而减少人体蛋白质变性。
紫外线用于环境和物品消毒,放射线用于医疗器械消毒,都是利用紫外线或放射线使细菌和病毒中的蛋白发生变性而使其死亡。
蛋白质盐析和变性的区别
盐析 变性
变化条件 浓的轻金属盐 受热、紫外线、强酸、强碱、重金属盐、某些有机物
变化实质 物理变化(溶解度降低) 化学变化(蛋白质性质改变)
变化过程 可逆 不可逆
用途 分离、提纯蛋白质 杀菌、消毒
⑤显色反应
含有苯环的蛋白质遇浓硝酸会有白色沉淀产生,加热后沉淀变黄色。
实验操作
实验现象
结论
加入浓硝酸生成白色沉淀,加热后,沉淀变黄
含有苯环的蛋白质(天然蛋白质都含苯环)沾上浓硝酸会出现黄色,可用于检验蛋白质。
⑥蛋白质灼烧有烧焦羽毛气味。
5.蛋白质的用途
(1)食物(人类必须的营养物质)
(2)工业原料:
动物的毛、蚕丝 (纺织原料)
动物的皮 (皮革)
动物的骨、皮、蹄 (动物胶)
牛奶中的酪素 (酪素塑料)
三.酶
1.定义:
酶是一类由细胞产生的、对生物体内的化学反应具有催化作用的有机化合物,其中绝大多数是蛋白质。
2.来源:
3.功能:
活细胞产生的
具有生物催化作用,反应结束后,酶本身保持不变。
4.酶的催化作用的特点:
(2)催化反应条件温和,一般在接近体温和中性的条件下进行,此时酶的催化作活性最高。超过适宜的温度时,酶将失去活性;
(3)具有高度的专一性。如蛋白酶只能催化蛋白质的水解反应,淀粉酶只对淀粉和糖原等多糖的水解起催化作用
(1)具有高效的催化作用,一般是普通催化剂的107倍
5.酶的应用:
(1)淀粉酶应用于食品、发酵、纺织、制药等工业;
(2)蛋白酶应用于医药、制革等工业;
(3)脂肪酶应用于脂肪水解、羊毛脱脂等;
(4)酶还可用于疾病的诊断。
