3.2 热力学第一定律 3.3 能量守恒定律 课件(共17张PPT)-2024-2025学年高二下学期物理人教版(2019)选择性必修第三册+
文档属性
| 名称 | 3.2 热力学第一定律 3.3 能量守恒定律 课件(共17张PPT)-2024-2025学年高二下学期物理人教版(2019)选择性必修第三册+ |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2024-08-06 09:31:06 | ||
图片预览






文档简介
(共17张PPT)
第2节 热力学第一定律
新教材人教版 物理(高中选择性必修第三册)
第三章 热力学定律
课堂引入
另一方面也向我们表明,为了改变系统的状态,做功和传热这两种方法是等价的。也就是说,一定数量的功与确定数量的热相对应。
一方面表明,以不同的方式对系统做功时,只要系统始末两个状态是确定的,做功的数量就是确定的;
焦耳的实验
ΔU=W
单纯地对系统做功做功:
单纯地对系统传热:
△U=Q
当外界既对系统做功又对系统传热时,内能的变化量就应该是:
△U=Q+ W
一、热力学第一定律
1、内容:一个热力学系统的内能变化量等于外界向它传递的热量与外界对它所做的功的和.
2、物理意义:热力学第一定律不仅反映了做功与传热在改变系统内能方面是等效的,而且给出了功、热量跟系统内能改变之间的定量关系.
3、表达式:
ΔU :物体内能的增加量
W: 外界对物体做的功
Q: 物体吸收的热量
ΔU=W + Q
4、推广:上式也适用于物体对外做功、向外界散热和内能减少的情况。但要注意各量的符号.
5、几种特殊情况
(1)若过程是绝热的,即Q=0,则ΔU=W,系统内能的增加量等于外界对物体做的功。
(2)若过程中不做功(单纯传热),即W=0,则ΔU=Q,系统内能的增加量等于物体从外界吸收的热量。
(3)若过程的始末状态系统的内能不变,即ΔU=0,则W=-Q(或Q=-W),外界对系统做的功等于系统放出的热量(或系统吸收的热量等于系统对外界做的功)。
(4)对于理想气体,温度变化,内能一定变化,等温过程ΔU=0。
【特别提醒】
(1)当做功和热传递同时发生时,物体的内能可能增加,也可能减小,还可能保持不变。
(2)物体内能发生变化可能是由做功引起的,也可能是由热传递引起的,还可能是两者共同作用的结果。
一、热力学第一定律
新课讲授
【例题】如图,一台四冲程内燃机,活塞在压缩冲程某段时间内移动的距离为0.1 m,这段过程活塞对气体的压力逐渐增大,其做的功相当于2×103 N的恒力使活塞移动相同距离所做的功(如图甲)。内燃机工作时汽缸温度高于环境温度,该过程中压缩气体传递给汽缸的热量为25 J。
(1)求上述压缩过程中气体内能的变化量;
(2)燃烧后的高压气体对活塞做功,气体推动活塞移动0.1 m,其做的功相当于9×103 N的恒力使活塞移动相同距离所做的功(如图乙),该做功过程气体传递给汽缸的热量为30 J,求此做功过程气体内能的变化量。
一、热力学第一定律
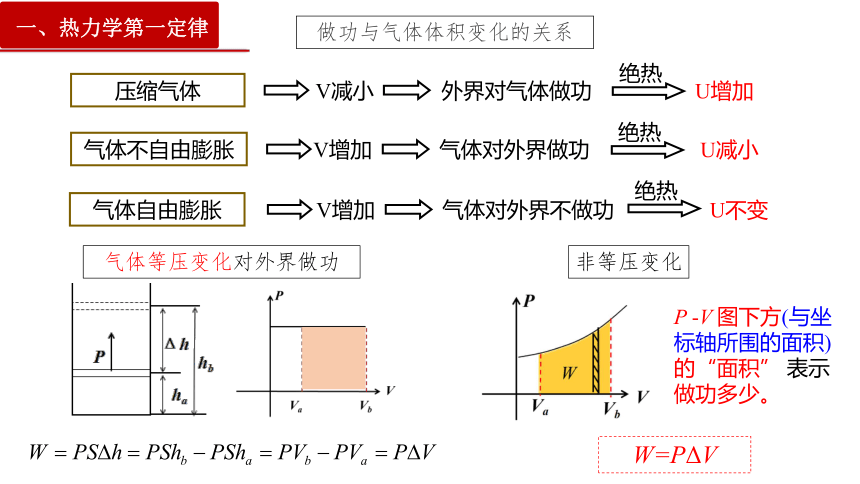
压缩气体
V减小
外界对气体做功
绝热
U增加
气体不自由膨胀
V增加
气体对外界做功
绝热
U减小
气体自由膨胀
V增加
气体对外界不做功
绝热
U不变
做功与气体体积变化的关系
一、热力学第一定律
气体等压变化对外界做功
P -V 图下方(与坐标轴所围的面积)的“面积” 表示做功多少。
W=PΔV
非等压变化
第3节 能量守恒定律
新教材人教版 物理(高中选择性必修第三册)
第三章 热力学定律
一、探索能量守恒的足迹
1.人类对能量的认识与能量之间的转化
风能
水能
光能
电能
2.能量之间的转化
电能与磁能的转化
电能与内能的转化
一、探索能量守恒的足迹
3.能量守恒观念的形成
机械能转化为内能
电场能转化为磁场能
内能转化为电能
磁场能转化为电能
俄国化学家盖斯:任何一个化学反应,不论是一步完成,还是分几步完成,放出的总热量相同。表明一个系统(即参加化学反应的几种物质)存在着一个与热量相关的物理量,在一个确定的化学反应中这个量是不变的。
德国医生迈尔通过比对不同地区人血颜色的差异,认识到食物中化学能与内能的等效性,即生物体内能量的输入和输出是平衡的。另外,他还通过海水在暴风雨中较热的现象,猜想热与机械运动的等效性。他在1841年和1842年连续写出“论‘自然力’(指能量)守恒”的论文,并推算了多少热与多少功相当。因此,迈尔是公认的第一个提出能量守恒思想的人。
一、探索能量守恒的足迹
人类对能量的认识过程,体现了科学前辈们对“守恒”这一科学思想的追寻。
焦耳的实验精确地测量了做功与传热之间的等价关系,从而为能量守恒定律奠定了牢固的实验基础,也为能量守恒的定量描述迈出了重要的一步。
德国科学家亥姆霍兹在不了解迈尔和焦耳研究的情况下,从永动机不可能制成这一事实出发,考察了自然界不同的“力”(指能量)之间的相互关系,提出了“张力”(即势能)与“活力”(即动能)的转化。他还分析了在电磁现象和生物机体中能量的守恒问题。
一、探索能量守恒的足迹
盖斯
迈尔
焦耳
亥姆霍兹
化学反应放出的热量与反应步骤无关
功热等价
提出能量守恒的思想
概括和总结能量守恒定律
能量守恒不是由某一个人通过某一项的研究而得到的。
一、探索能量守恒的足迹
二、能量守恒定律
1、内容:能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为其他形式,或者从一个物体转移到别的物体,在转化或转移的过程中,能量的总量保持不变.
例如:
自由落体运动:
势能→动能
摩擦生热:
机械能→内能
热机中的气体推动活塞做功:
内能→机械能
电流通过电阻丝:
电能→内能
电流通过白炽灯:
电能→内能→光能
燃料燃烧:
化学能→内能
2、能量守恒定律的历史意义:能的转化和守恒定律是19世纪自然科学中三大发现之一(能量守恒定律与电子的发现、达尔文的进化论并称19世纪自然科学中三大发现),也庄严宣告了永动机幻想的彻底破灭.
能量守恒定律是认识自然、改造自然的有力武器,这个定律将广泛的自然科学技术领域联系起来,使不同领域的科学工作者有一系列的共同语言.
二、能量守恒定律
3、能量守恒定律的特例
机械能守恒定律
能量守恒在机械能范围内的表现
热力学第一定律
能量守恒在热力学范围内的表现
区别:热力学第一定律和机械能守恒定律能够给出具体的定量形式,而能量守恒定律却给不出。
力学中:机械能守恒定律
电学中:闭合电路欧姆定律
电磁感应中:楞次定律
热学中:热力学第一定律
能量守恒的观点也在不断地发展,相对论建立以后,基本粒子的研究使我们认识到,能量其实是与质量相关联的一个物理量。在20世纪30年代初,奥地利物理学家泡利根据能量守恒定律预言了中微子。
5、能量是与质量相关联的一个物理量
4、能量守恒是自然界的普遍规律
三、永动机不可能制成
17 18世纪,许多人致力于制造一种机器,它不需要任何动力或燃料,却能不断地对外做功,史称“第一类永动机”。图展示了其中的一些设计。然而,为此目的的任何尝试都失败了。这是为什么呢?
永动机的思想违背了能量守恒定律,所以是不可能制成的。
永动机给我们的启示:人类利用和改造自然时,必须遵循自然规律。
热力学第一定律的另一种表述:第一类永动机是不可能制成的。
如图所示,一定质量的理想气体在状态A时压强为1.5 × 105Pa,经历A→B→C→A的过程,已知B→C过程中气体做功数值是C→A过程中气体做功数值的3倍,下列说法中正确的是( )
A.C→A的过程中外界对气体做功300J
B.B→C的过程中气体对外界做功600J
C.整个过程中气体从外界吸收600J的热量
D.整个过程中气体从外界吸收450J的热量
AC
课堂练习
【答案】AC
【详解】A.在C→A过程中,气体体积减小,外界对气体做功,根据WCA = p V得WCA = 300J,A正确;
B.由题知B→C过程中气体做功数值是C→A过程中气体做功数值的3倍,则B→C的过程中气体对外界做功900J,B错误;
CD.A→B→C→A整个过程中,温度不变,则内能 U = 0,A→B过程,气体体积不变,做功为零;B→C的过程中气体对外界做功900J;C→A的过程中外界对气体做功300J,根据热力学第一定律 U = W + Q表达式中的W表示外界对气体做的功,故
W = WCA - WBC = - 600J,Q = U - W = 600J则整个过程中气体从外界吸收600J的热量,C正确、D错误。
故选AC。
课堂练习
第2节 热力学第一定律
新教材人教版 物理(高中选择性必修第三册)
第三章 热力学定律
课堂引入
另一方面也向我们表明,为了改变系统的状态,做功和传热这两种方法是等价的。也就是说,一定数量的功与确定数量的热相对应。
一方面表明,以不同的方式对系统做功时,只要系统始末两个状态是确定的,做功的数量就是确定的;
焦耳的实验
ΔU=W
单纯地对系统做功做功:
单纯地对系统传热:
△U=Q
当外界既对系统做功又对系统传热时,内能的变化量就应该是:
△U=Q+ W
一、热力学第一定律
1、内容:一个热力学系统的内能变化量等于外界向它传递的热量与外界对它所做的功的和.
2、物理意义:热力学第一定律不仅反映了做功与传热在改变系统内能方面是等效的,而且给出了功、热量跟系统内能改变之间的定量关系.
3、表达式:
ΔU :物体内能的增加量
W: 外界对物体做的功
Q: 物体吸收的热量
ΔU=W + Q
4、推广:上式也适用于物体对外做功、向外界散热和内能减少的情况。但要注意各量的符号.
5、几种特殊情况
(1)若过程是绝热的,即Q=0,则ΔU=W,系统内能的增加量等于外界对物体做的功。
(2)若过程中不做功(单纯传热),即W=0,则ΔU=Q,系统内能的增加量等于物体从外界吸收的热量。
(3)若过程的始末状态系统的内能不变,即ΔU=0,则W=-Q(或Q=-W),外界对系统做的功等于系统放出的热量(或系统吸收的热量等于系统对外界做的功)。
(4)对于理想气体,温度变化,内能一定变化,等温过程ΔU=0。
【特别提醒】
(1)当做功和热传递同时发生时,物体的内能可能增加,也可能减小,还可能保持不变。
(2)物体内能发生变化可能是由做功引起的,也可能是由热传递引起的,还可能是两者共同作用的结果。
一、热力学第一定律
新课讲授
【例题】如图,一台四冲程内燃机,活塞在压缩冲程某段时间内移动的距离为0.1 m,这段过程活塞对气体的压力逐渐增大,其做的功相当于2×103 N的恒力使活塞移动相同距离所做的功(如图甲)。内燃机工作时汽缸温度高于环境温度,该过程中压缩气体传递给汽缸的热量为25 J。
(1)求上述压缩过程中气体内能的变化量;
(2)燃烧后的高压气体对活塞做功,气体推动活塞移动0.1 m,其做的功相当于9×103 N的恒力使活塞移动相同距离所做的功(如图乙),该做功过程气体传递给汽缸的热量为30 J,求此做功过程气体内能的变化量。
一、热力学第一定律
压缩气体
V减小
外界对气体做功
绝热
U增加
气体不自由膨胀
V增加
气体对外界做功
绝热
U减小
气体自由膨胀
V增加
气体对外界不做功
绝热
U不变
做功与气体体积变化的关系
一、热力学第一定律
气体等压变化对外界做功
P -V 图下方(与坐标轴所围的面积)的“面积” 表示做功多少。
W=PΔV
非等压变化
第3节 能量守恒定律
新教材人教版 物理(高中选择性必修第三册)
第三章 热力学定律
一、探索能量守恒的足迹
1.人类对能量的认识与能量之间的转化
风能
水能
光能
电能
2.能量之间的转化
电能与磁能的转化
电能与内能的转化
一、探索能量守恒的足迹
3.能量守恒观念的形成
机械能转化为内能
电场能转化为磁场能
内能转化为电能
磁场能转化为电能
俄国化学家盖斯:任何一个化学反应,不论是一步完成,还是分几步完成,放出的总热量相同。表明一个系统(即参加化学反应的几种物质)存在着一个与热量相关的物理量,在一个确定的化学反应中这个量是不变的。
德国医生迈尔通过比对不同地区人血颜色的差异,认识到食物中化学能与内能的等效性,即生物体内能量的输入和输出是平衡的。另外,他还通过海水在暴风雨中较热的现象,猜想热与机械运动的等效性。他在1841年和1842年连续写出“论‘自然力’(指能量)守恒”的论文,并推算了多少热与多少功相当。因此,迈尔是公认的第一个提出能量守恒思想的人。
一、探索能量守恒的足迹
人类对能量的认识过程,体现了科学前辈们对“守恒”这一科学思想的追寻。
焦耳的实验精确地测量了做功与传热之间的等价关系,从而为能量守恒定律奠定了牢固的实验基础,也为能量守恒的定量描述迈出了重要的一步。
德国科学家亥姆霍兹在不了解迈尔和焦耳研究的情况下,从永动机不可能制成这一事实出发,考察了自然界不同的“力”(指能量)之间的相互关系,提出了“张力”(即势能)与“活力”(即动能)的转化。他还分析了在电磁现象和生物机体中能量的守恒问题。
一、探索能量守恒的足迹
盖斯
迈尔
焦耳
亥姆霍兹
化学反应放出的热量与反应步骤无关
功热等价
提出能量守恒的思想
概括和总结能量守恒定律
能量守恒不是由某一个人通过某一项的研究而得到的。
一、探索能量守恒的足迹
二、能量守恒定律
1、内容:能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为其他形式,或者从一个物体转移到别的物体,在转化或转移的过程中,能量的总量保持不变.
例如:
自由落体运动:
势能→动能
摩擦生热:
机械能→内能
热机中的气体推动活塞做功:
内能→机械能
电流通过电阻丝:
电能→内能
电流通过白炽灯:
电能→内能→光能
燃料燃烧:
化学能→内能
2、能量守恒定律的历史意义:能的转化和守恒定律是19世纪自然科学中三大发现之一(能量守恒定律与电子的发现、达尔文的进化论并称19世纪自然科学中三大发现),也庄严宣告了永动机幻想的彻底破灭.
能量守恒定律是认识自然、改造自然的有力武器,这个定律将广泛的自然科学技术领域联系起来,使不同领域的科学工作者有一系列的共同语言.
二、能量守恒定律
3、能量守恒定律的特例
机械能守恒定律
能量守恒在机械能范围内的表现
热力学第一定律
能量守恒在热力学范围内的表现
区别:热力学第一定律和机械能守恒定律能够给出具体的定量形式,而能量守恒定律却给不出。
力学中:机械能守恒定律
电学中:闭合电路欧姆定律
电磁感应中:楞次定律
热学中:热力学第一定律
能量守恒的观点也在不断地发展,相对论建立以后,基本粒子的研究使我们认识到,能量其实是与质量相关联的一个物理量。在20世纪30年代初,奥地利物理学家泡利根据能量守恒定律预言了中微子。
5、能量是与质量相关联的一个物理量
4、能量守恒是自然界的普遍规律
三、永动机不可能制成
17 18世纪,许多人致力于制造一种机器,它不需要任何动力或燃料,却能不断地对外做功,史称“第一类永动机”。图展示了其中的一些设计。然而,为此目的的任何尝试都失败了。这是为什么呢?
永动机的思想违背了能量守恒定律,所以是不可能制成的。
永动机给我们的启示:人类利用和改造自然时,必须遵循自然规律。
热力学第一定律的另一种表述:第一类永动机是不可能制成的。
如图所示,一定质量的理想气体在状态A时压强为1.5 × 105Pa,经历A→B→C→A的过程,已知B→C过程中气体做功数值是C→A过程中气体做功数值的3倍,下列说法中正确的是( )
A.C→A的过程中外界对气体做功300J
B.B→C的过程中气体对外界做功600J
C.整个过程中气体从外界吸收600J的热量
D.整个过程中气体从外界吸收450J的热量
AC
课堂练习
【答案】AC
【详解】A.在C→A过程中,气体体积减小,外界对气体做功,根据WCA = p V得WCA = 300J,A正确;
B.由题知B→C过程中气体做功数值是C→A过程中气体做功数值的3倍,则B→C的过程中气体对外界做功900J,B错误;
CD.A→B→C→A整个过程中,温度不变,则内能 U = 0,A→B过程,气体体积不变,做功为零;B→C的过程中气体对外界做功900J;C→A的过程中外界对气体做功300J,根据热力学第一定律 U = W + Q表达式中的W表示外界对气体做的功,故
W = WCA - WBC = - 600J,Q = U - W = 600J则整个过程中气体从外界吸收600J的热量,C正确、D错误。
故选AC。
课堂练习
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
