【同步课堂】2024-2025学年华师大版科学九上 2.2.2重要的酸 课件(20页ppt)
文档属性
| 名称 | 【同步课堂】2024-2025学年华师大版科学九上 2.2.2重要的酸 课件(20页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-08-07 09:03:57 | ||
图片预览








文档简介
(共20张PPT)
2.2.2 重要的酸(二)
九年级上化学
第二章 酸和碱
分类学习
酸作为初中化学中物质的一个大类,说明他们具有很多相似的性质。今天就让我们来探索一些酸的通性吧!
探究酸的化学性质
(1)酸能使指示剂变色
实验1 如果分别向装有硫酸和盐酸的溶液中滴加紫色石蕊,我们会看到什么现象?
现象:滴加石蕊后,溶液变成红色
那么如果换用无色酚酞进行实验呢?现象又是如何呢?
探究酸的化学性质
实验二:
向装有镁条、锌粒、铁片和铜片的试管中分别加入酸
现象:镁、锌、铁的试管中有气泡产生,镁的反应最剧烈,铜的试管中没有明显现象
说明:酸能与镁、锌、铁反应,而铜不行
结论:酸能与某些金属发生反应
何为活泼金属------P47金属活动性顺序表
(2)酸能与某些金属发生反应(活泼金属)
排在氢前的为活泼金属,排在越前面的金属,金属越活泼,反应越剧烈。
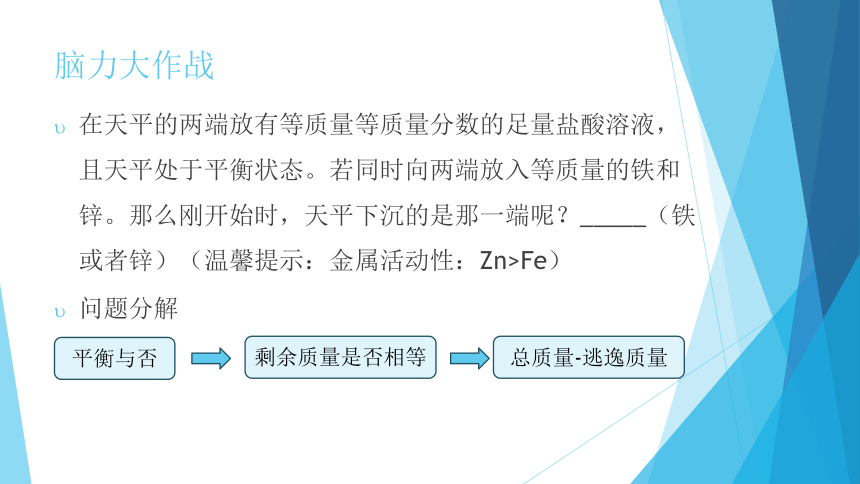
脑力大作战
在天平的两端放有等质量等质量分数的足量盐酸溶液,且天平处于平衡状态。若同时向两端放入等质量的铁和锌。那么刚开始时,天平下沉的是那一端呢?_____(铁或者锌)(温馨提示:金属活动性:Zn>Fe)
问题分解
平衡与否
剩余质量是否相等
总质量-逃逸质量
反思与总结-----书写方程式,你发现了什么规律
镁与盐酸反应
锌与盐酸反应
铁与盐酸反应
仔细观察上述方程,你发现在物质种类上有什么特点?
置换反应:一种单质和另一种化合物反应生成另一种单质和一种化合物的反应。
Mg+2HCl==MgCl2+H2↑
Zn+2HCl==ZnCl2+H2↑
Fe+2HCl==FeCl2+H2↑
思考与辨析:
置换反应只能是金属和酸的反应吗?
置换反应的其他例子:
氢气还原氧化铜:
碳还原氧化铜:
C+2CuO=△=CO2+2Cu
H2+CuO=△=H2O+Cu
牛刀小试
如何用化学方法除去混在铜粉中的少量铁粉?简述过程。(温馨提示:金属活动性顺序 Fe>(H)>Cu)
答:加入足量的盐酸,使铁粉充分反应:
Fe+2HCl=FeCl +H ↑
铜粉与盐酸不反应,待铁粉反应完全后过滤,滤纸上留下的固体物质为铜,洗涤、干燥即可得到纯净的铜粉。
探究酸的化学性质
当铁器使用久了会生锈,你有什么好办法可以除去铁锈呢?
实验四 向氧化铜中加入稀硫酸,观察现象
实验三:向生锈的铁钉中加入稀硫酸,观察现象
(a)方程式:
(b)现象:
(a)方程式:
(b)现象:
红棕色固体逐渐溶解,溶液变成黄色
黑色固体逐渐溶解,溶液变成蓝色
(3)酸可以与金属氧化物反应
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O
观察与思考
从盐酸溶解铁锈的实验过程中,我们发现在实验的最后还产生了气泡,你认为这个气泡是怎么形成的?根据这一现象,你觉得用稀盐酸去清除保温杯中的茶垢合适吗?
探究酸的化学性质
(4)稀盐酸和稀硫酸与碱反应
实验4 向装有氢氧化钠的溶液中滴加酸,观察现象
思考:无明显现象是不是说明他们不能反应呢?又该如何证明呢?
酸碱指示剂
还有其他证明酸和碱发生反应的例子吗?
氢氧化钡与硫酸反应
观察与思考
写出方程式:
氢氧化钠和稀盐酸:
氢氧化钡和硫酸:
中和反应:酸和碱作用生成盐和水的反应。
NaOH+HCl==NaCl+H2O
Ba(OH)2+H2SO4==BaSO4↓+2H2O
观察与辨析
下列反应是中和反应吗
1 氢氧化钾和硫酸反应
2 氯化钙和碳酸钠反应
3 稀盐酸与碳酸钠反应
思考: 生成盐和水的反应就是中和反应吗?
复分解反应:两种化合物相互交换成分生成另两种化合物的反应。
概念辨析
复分解反应:两种化合物相互交换成分生成另两种化合物的反应。
中和反应:酸和碱作用生成盐和水的反应。
VS
中和反应
复分解反应
探索复分解反应发生的条件
是不是两种化合物相遇就可以发生复分解反应呢?如果不是,那么复分解反应的发生需要满足什么条件呢?
复分解反应的条件:
(1)生成物中有气体
(2)生成物中有沉淀
(3)生成物中有水
温馨提示:三个条件是或的关系哦
知识结构的完善
正确的化学方程式:
化学式正确、配平正确、条件、状态标注正确、如果是复分解反应还要满足复分解反应条件(有气体、沉淀或水生成)
判断下列反应能否发生
1 氯化铜和硝酸钠 2 氯化钙与碳酸钠
3 氯化钾和氢氧化钠 4 氢氧化铁和稀盐酸
小结:
在判断复分解反应是否发生时,我们可以先假设反应发生,然后判断产物是否符合复分解反应的条件
探究酸的化学性质
(5)酸能与盐反应
(a)方程式:
(b)现象:产生不溶于稀硝酸的白色沉淀
(a)方程式:
(b)现象:产生不溶于稀硝酸的白色沉淀
实验:稀盐酸与硝酸银反应
实验:稀硫酸与氯化钡反应
BaCl2+H2SO4==BaSO4↓+2HCl
思考与提升
酸能与所有盐发生反应吗?
答案是否定的例如:
(1)硫酸与氯化钠
(2)盐酸与硫酸铜
小结:酸的通性
(1)酸能使指示剂变色
(2)酸能与部分金属发生反应
(3)酸能与金属氧化物反应
(4)酸能与碱发生反应
(5)酸能与某些盐反应
2.2.2 重要的酸(二)
九年级上化学
第二章 酸和碱
分类学习
酸作为初中化学中物质的一个大类,说明他们具有很多相似的性质。今天就让我们来探索一些酸的通性吧!
探究酸的化学性质
(1)酸能使指示剂变色
实验1 如果分别向装有硫酸和盐酸的溶液中滴加紫色石蕊,我们会看到什么现象?
现象:滴加石蕊后,溶液变成红色
那么如果换用无色酚酞进行实验呢?现象又是如何呢?
探究酸的化学性质
实验二:
向装有镁条、锌粒、铁片和铜片的试管中分别加入酸
现象:镁、锌、铁的试管中有气泡产生,镁的反应最剧烈,铜的试管中没有明显现象
说明:酸能与镁、锌、铁反应,而铜不行
结论:酸能与某些金属发生反应
何为活泼金属------P47金属活动性顺序表
(2)酸能与某些金属发生反应(活泼金属)
排在氢前的为活泼金属,排在越前面的金属,金属越活泼,反应越剧烈。
脑力大作战
在天平的两端放有等质量等质量分数的足量盐酸溶液,且天平处于平衡状态。若同时向两端放入等质量的铁和锌。那么刚开始时,天平下沉的是那一端呢?_____(铁或者锌)(温馨提示:金属活动性:Zn>Fe)
问题分解
平衡与否
剩余质量是否相等
总质量-逃逸质量
反思与总结-----书写方程式,你发现了什么规律
镁与盐酸反应
锌与盐酸反应
铁与盐酸反应
仔细观察上述方程,你发现在物质种类上有什么特点?
置换反应:一种单质和另一种化合物反应生成另一种单质和一种化合物的反应。
Mg+2HCl==MgCl2+H2↑
Zn+2HCl==ZnCl2+H2↑
Fe+2HCl==FeCl2+H2↑
思考与辨析:
置换反应只能是金属和酸的反应吗?
置换反应的其他例子:
氢气还原氧化铜:
碳还原氧化铜:
C+2CuO=△=CO2+2Cu
H2+CuO=△=H2O+Cu
牛刀小试
如何用化学方法除去混在铜粉中的少量铁粉?简述过程。(温馨提示:金属活动性顺序 Fe>(H)>Cu)
答:加入足量的盐酸,使铁粉充分反应:
Fe+2HCl=FeCl +H ↑
铜粉与盐酸不反应,待铁粉反应完全后过滤,滤纸上留下的固体物质为铜,洗涤、干燥即可得到纯净的铜粉。
探究酸的化学性质
当铁器使用久了会生锈,你有什么好办法可以除去铁锈呢?
实验四 向氧化铜中加入稀硫酸,观察现象
实验三:向生锈的铁钉中加入稀硫酸,观察现象
(a)方程式:
(b)现象:
(a)方程式:
(b)现象:
红棕色固体逐渐溶解,溶液变成黄色
黑色固体逐渐溶解,溶液变成蓝色
(3)酸可以与金属氧化物反应
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O
观察与思考
从盐酸溶解铁锈的实验过程中,我们发现在实验的最后还产生了气泡,你认为这个气泡是怎么形成的?根据这一现象,你觉得用稀盐酸去清除保温杯中的茶垢合适吗?
探究酸的化学性质
(4)稀盐酸和稀硫酸与碱反应
实验4 向装有氢氧化钠的溶液中滴加酸,观察现象
思考:无明显现象是不是说明他们不能反应呢?又该如何证明呢?
酸碱指示剂
还有其他证明酸和碱发生反应的例子吗?
氢氧化钡与硫酸反应
观察与思考
写出方程式:
氢氧化钠和稀盐酸:
氢氧化钡和硫酸:
中和反应:酸和碱作用生成盐和水的反应。
NaOH+HCl==NaCl+H2O
Ba(OH)2+H2SO4==BaSO4↓+2H2O
观察与辨析
下列反应是中和反应吗
1 氢氧化钾和硫酸反应
2 氯化钙和碳酸钠反应
3 稀盐酸与碳酸钠反应
思考: 生成盐和水的反应就是中和反应吗?
复分解反应:两种化合物相互交换成分生成另两种化合物的反应。
概念辨析
复分解反应:两种化合物相互交换成分生成另两种化合物的反应。
中和反应:酸和碱作用生成盐和水的反应。
VS
中和反应
复分解反应
探索复分解反应发生的条件
是不是两种化合物相遇就可以发生复分解反应呢?如果不是,那么复分解反应的发生需要满足什么条件呢?
复分解反应的条件:
(1)生成物中有气体
(2)生成物中有沉淀
(3)生成物中有水
温馨提示:三个条件是或的关系哦
知识结构的完善
正确的化学方程式:
化学式正确、配平正确、条件、状态标注正确、如果是复分解反应还要满足复分解反应条件(有气体、沉淀或水生成)
判断下列反应能否发生
1 氯化铜和硝酸钠 2 氯化钙与碳酸钠
3 氯化钾和氢氧化钠 4 氢氧化铁和稀盐酸
小结:
在判断复分解反应是否发生时,我们可以先假设反应发生,然后判断产物是否符合复分解反应的条件
探究酸的化学性质
(5)酸能与盐反应
(a)方程式:
(b)现象:产生不溶于稀硝酸的白色沉淀
(a)方程式:
(b)现象:产生不溶于稀硝酸的白色沉淀
实验:稀盐酸与硝酸银反应
实验:稀硫酸与氯化钡反应
BaCl2+H2SO4==BaSO4↓+2HCl
思考与提升
酸能与所有盐发生反应吗?
答案是否定的例如:
(1)硫酸与氯化钠
(2)盐酸与硫酸铜
小结:酸的通性
(1)酸能使指示剂变色
(2)酸能与部分金属发生反应
(3)酸能与金属氧化物反应
(4)酸能与碱发生反应
(5)酸能与某些盐反应
