广东省肇庆市2023-2024学年高一下学期期末考试 化学试题 (PDF版含答案)
文档属性
| 名称 | 广东省肇庆市2023-2024学年高一下学期期末考试 化学试题 (PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 995.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-06 16:49:47 | ||
图片预览

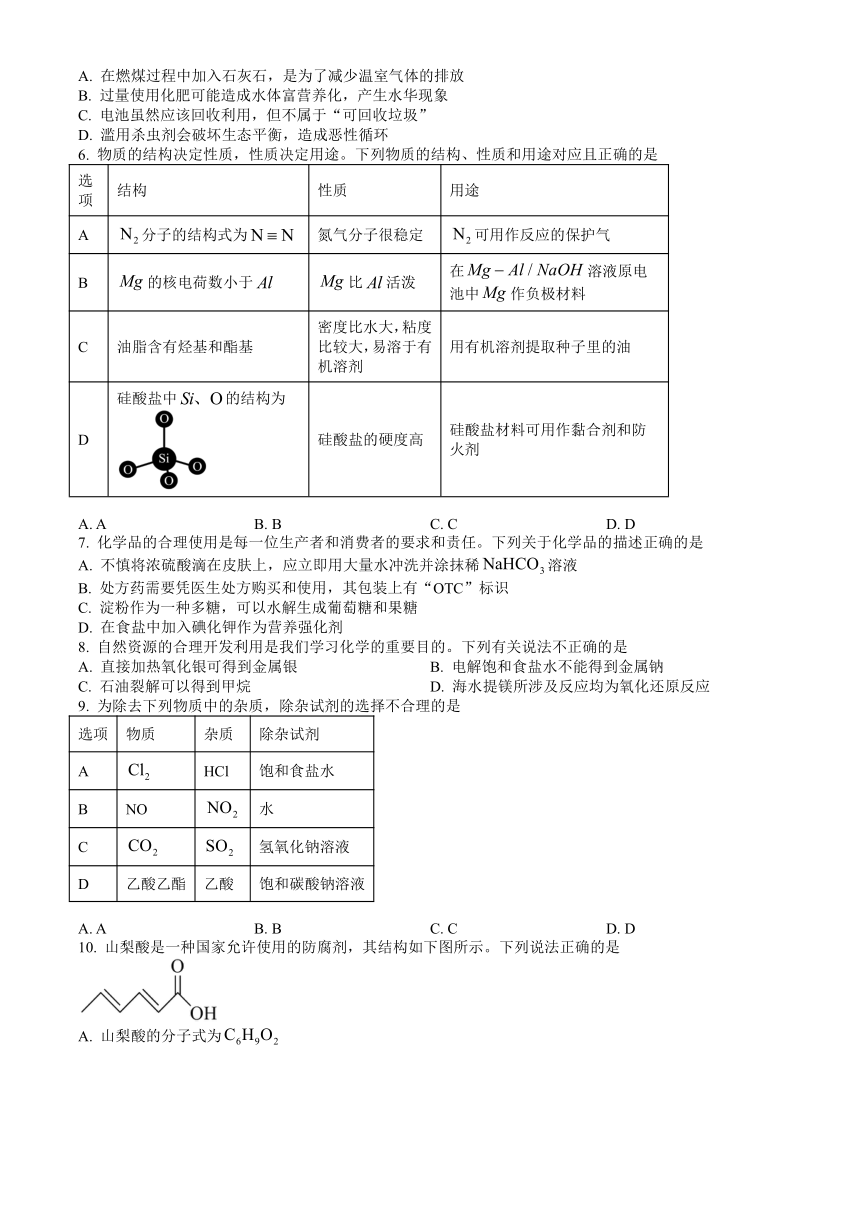

文档简介
肇庆市 2023-2024 学年高一下学期期末考试
化 学
注意事项:
1.本试卷共 100分,考试时间 75分钟。
2.答卷前,考生务必将自己的姓名、准考证号填写在试卷和答题卡上。回答选择题时,选出每
小题答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,
再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H:1 C:12 N:14 O:16
一、选择题:本题共包括 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,
每小题 4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 广东省是岭南文化的重要传承地。下列非遗物品中材质不属于硅酸盐的是
A.石湾陶艺 B.潮州木雕 C.肇庆端砚 D.广东砖雕
A. A B. B C. C D. D
2.“神舟十八号”载人飞船发射圆满成功,中国人的航天梦又向前迈进了一步。下列说法不正确的是
A. 为神舟系列飞船发射和返回提供保障的特种玻璃纤维是一种无机非金属材料
B. 首次在飞船上采用的锂离子蓄电池是一种一次电池
C. 火箭燃料的助燃剂N2O4是一种非金属氧化物
D. 航天员食用的燕麦片中所含的纤维素是一种人体所需的糖类物质
3. 下列化学用语表述正确的是
A. 甲烷的空间填充模型:
B. 聚丙烯的结构简式:
C. 四氯化碳的电子式:
D. CH2BrCH2Br 的名称:1,2-二溴乙烷
4. “劳动是人类生存和社会发展的基础”。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 环保工程师测定雨水的 pH≈5.6 雨水中溶解了CO2
B 某同学用热的碱性溶液洗涤沾有油脂的碗碟 油脂的饱和程度越高,熔点越高
C 面点师用含碳酸氢铵的膨松剂制作饼干 碳酸氢铵受热易分解
D 炼化工人将煤气化或液化后再利用 提高煤的利用率
A. A B. B C. C D. D
5.“绿水青山就是金山银山”。下列说法不正确的是
A. 在燃煤过程中加入石灰石,是为了减少温室气体的排放
B. 过量使用化肥可能造成水体富营养化,产生水华现象
C. 电池虽然应该回收利用,但不属于“可回收垃圾”
D. 滥用杀虫剂会破坏生态平衡,造成恶性循环
6. 物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途对应且正确的是
选
结构 性质 用途
项
A N2分子的结构式为N N 氮气分子很稳定 N2可用作反应的保护气
在Mg Al / NaOH 溶液原电
B Mg的核电荷数小于 Al Mg比 Al活泼
池中Mg作负极材料
密度比水大,粘度
C 油脂含有烃基和酯基 比较大,易溶于有 用有机溶剂提取种子里的油
机溶剂
硅酸盐中 Si、O的结构为
D 硅酸盐材料可用作黏合剂和防硅酸盐的硬度高
火剂
A. A B. B C. C D. D
7. 化学品的合理使用是每一位生产者和消费者的要求和责任。下列关于化学品的描述正确的是
A. 不慎将浓硫酸滴在皮肤上,应立即用大量水冲洗并涂抹稀NaHCO3溶液
B. 处方药需要凭医生处方购买和使用,其包装上有“OTC”标识
C. 淀粉作为一种多糖,可以水解生成葡萄糖和果糖
D. 在食盐中加入碘化钾作为营养强化剂
8. 自然资源的合理开发利用是我们学习化学的重要目的。下列有关说法不正确的是
A. 直接加热氧化银可得到金属银 B. 电解饱和食盐水不能得到金属钠
C. 石油裂解可以得到甲烷 D. 海水提镁所涉及反应均为氧化还原反应
9. 为除去下列物质中的杂质,除杂试剂的选择不合理的是
选项 物质 杂质 除杂试剂
A Cl2 HCl 饱和食盐水
B NO NO2 水
C CO2 SO2 氢氧化钠溶液
D 乙酸乙酯 乙酸 饱和碳酸钠溶液
A. A B. B C. C D. D
10. 山梨酸是一种国家允许使用的防腐剂,其结构如下图所示。下列说法正确的是
A. 山梨酸的分子式为C6H9O2
B. 山梨酸与丙烯酸( )互为同系物
C. 1 mol山梨酸与 Na反应最多生成 0.5 mol H2
D. 1 mol山梨酸最多可以与 3 mol Br2 发生加成反应
11. 工业上以二氧化硫和空气混合制取三氧化硫:2SO2 g +O2 g 2SO3 g (放热反应)。在一定温度
下向某刚性密闭容器中充入 2mol SO2 g 和 2mol O2 g 发生反应,下列描述不能说明该反应达到平衡
状态的是
A. 混合气体中SO2 的物质的量不再改变
B. 2v正 O2 v逆 SO3
C. 混合气体中O2的含量不再改变
D. 混合气体中SO2 、O2和SO3物质的量之比为 2∶1∶2
12. 下列化学反应的化学方程式或离子方程式书写正确的是
A. Cu与浓硝酸反应:Cu 2H NO 3 Cu
2 H2O NO2
B. 蔗糖的水解反应:C 催化剂12H22O11 蔗糖 H2O 2C6H12O6 葡萄糖
C. 2 将二氧化硫通入硫化氢溶液中:SO2 4H 2S 3S 2H2O
D. 硫酸铁铵[NH4Fe SO4 2 ]与过量氢氧化钡溶液的反应:
NH 4 Fe
3 2SO2 4 4OH
2Ba2 NH3 H2O Fe OH 2BaSO 3 4
13. 下图所示的实验装置中,能达到实验目的的是
实验装
置
实验目 A.检验 X溶液中含有SO2 4 B.制备并收集NO的 2
实验装
置
实验目 C.用喷泉实验验证NH3的溶解性 D.探究CH4 和Cl2发生取代反应的
A. A B. B C. C D. D
14. 下列有关电池的描述不正确的是
选 A.铜锌H2SO4溶液原电池 B.铜锌CuSO4溶液原电池项
电
池
描 负极质量减小,正极质量几乎不
负极质量减小,正极质量增大
述 变
选 C.铅酸蓄电池 D.氢氧燃料电池
项
电
池
描
负极质量增大,正极质量减小 负极和正极质量均几乎不变
述
A. A B. B C. C D. D
15. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 足量 Cu 与 1 mol S充分反应,转移电子的数目为NA
B. 常温下,将 1 mol Cu放入足量稀硝酸中,生成 NO分子的数目为 2 NA
C. 标准状况下,11.2 L乙酸中乙酸分子的数目为 0.5 NA
D. 1 mol正丁烷和异丁烷的混合物在空气中充分燃烧消耗O2分子的数目为 6.5 NA
16. 合成氨工业对农业、工业意义重大,随着科学技术的发展,人们对氨的需求量日益增长。已知:合成氨
反应中,生成 2 mol NH3时放出 92.4 kJ的热量。下列说法正确的是
A. 若向容器中加入 0.5 mol N2 g 和 1.5 mol H2 g 充分反应,则放出的热量为 46.2kJ
B. 断裂 1 mol N N键和 3 mol H H键需要吸收的能量之和小于形成 6 mol N H键放出的能量
C. 若升高温度合成氨的产率变高,说明升高温度合成氨的速率变快,氨分解的速率变慢
D. 不改变其他条件,延长反应时间有利于提高氢气的平衡转化率
二、非选择题:本题共 4小题,共 56分。
17. SO2 是一种常见的无机物,它既是重要的物质资源,也是环境污染物之一,某学习小组改进教材中关
于SO2 的制备和性质探究实验。回答下列问题:
(1)装置 A中铜与浓硫酸反应的化学方程式为______。
(2)查阅资料可知,可以用Na 2SO3 固体(粉末状)和稀硫酸溶液反应制备SO2 ,该反应的优点是无需使用
加热装置,则可选择的发生装置为______(填序号)。
(3)小组同学通过记录实验现象探究了SO2 的性质,完成下列表格。
装置 现象 解释
C ①_____ SO2 具有漂白性
D ②浅黄绿色变为无色 其中发生反应的离子方程式为______
E ③_____ SO2 具有______
(4)若直接将SO2 通入品红溶液中,容易发生“倒吸”现象,小组同学增加如图防倒吸装置 B,请在虚线
框中画出该装置______。
(5)装置 F的作用是尾气处理,盛放的试剂为_____,其中发生反应的离子方程式为____。
18. 铝土矿(主要成分为Al2O3,还含有Fe2O3和SiO2 )是生产金属铝的最佳原料,其总产量的 90%以上用于
生产金属铝。工业上利用铝土矿制备金属铝的工艺流程如下:
回答下列问题:
(1)“浸取”时为了使Al2O3转化为 Al OH ,试剂①可以选用______,发生反应的离子方程式为4
______,“浸渣 1”为______。
(2)试剂②可以选用______,加入试剂②的用量应______(填“少量”或“足量”),分离H2SiO3的方法为
______。
(3)“电解”过程发生反应的化学方程式为_______。
(4)利用铝热反应可以制备许多过渡金属单质,由Fe2O3制备 Fe的铝热反应的化学方程式为______。
19. 采用催化还原的处理方法可避免生产硝酸时产生的尾气(NOx )污染环境,回答下列问题。
(1)氮氧化物对环境的污染之一是形成酸雨,写出 NO在空气中转化为HNO3的化学方程式:_____。
(2)一定温度下,向体积为 2.0L的刚性密闭容器中充入 0.45 mol NH3和 0.50mol NO2 ,发生反应:
8NH3 g 6NO2 g 7N2 g 12H2O g 。测得部分气体的物质的量随时间变化关系如图所示。
①该反应中作为还原剂的是______(填化学式,下同),曲线 B表示______的物质的量,随时间的变化关系。
②0~5.0 min内,N 的物质的量浓度的变化量为______mol L 12 (保留 2位有效数字,下同),NO2 的平均
反应速率为_______;平衡时NH3的转化率为_______。
③为了提高该氧化还原反应的速率,可以采取的措施是______(填序号)。
a.加入适宜的催化剂 b.降低温度 c.减小压强 d.提高NH3的浓度
20. 有机玻璃(PMMA)俗称“亚克力”,是一种应用广泛的热塑性塑料。一种合成有机玻璃的工艺流程如下:
已知: O 2 /Cu (R、 代表烃基或氢原子)
回答下列问题:
(1)A的名称为_______。
(2)A→B的反应中除了生成 B,另一种副产物的结构简式为________,其与 B的关系为______。
(3)C的结构简式为______。
(4)E中所含官能团名称为_______。
(5)E转化为 F的化学方程式为_______,反应类型为________。
(6)F在一定条件下发生自身加成聚合反应得到 pMMA,PMMA的结构简式为_______。
参考答案
一、选择题:本题共包括 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,
每小题 4分。
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D B A A A D C C
题号 11 12 13 14 15 16
答案 D D C C D B
17. (1)Cu 2H2SO4 CuSO4 2H2O SO2
(2)b
3 2 ( )品红溶液褪色 Cl2 SO2 2H2O SO4 2Cl 4H 紫红色变为无色 ④. 还原性
(4)
(5) 氢氧化钠溶液 SO2 2OH
-=SO2 3 H2O
18. (1 2 ) 氢氧化钠溶液 Al2O3 2OH 3H2O 2[Al OH ]4 、 SiO2 2OH SiO3 H2O
Fe2O3
(2) 盐酸溶液 足量 过滤
通电
(3) 2Al2O3 4Al 3O2
熔融
(4) 2Al Fe2O3 2Fe Al2O3
19. (1) 4NO+3O2+2H 2O=4HNO3
(2)①. NH3 H2O g
②. 0.12mol / L 0.02mol L-1 min -1 59.26%
③ a、d
20. (1)丙烯
(2) CH3CH2CH2OH 同分异构体
(3)
(4)碳碳双键、羧基
(5) 取代(酯化)反应
(6)
化 学
注意事项:
1.本试卷共 100分,考试时间 75分钟。
2.答卷前,考生务必将自己的姓名、准考证号填写在试卷和答题卡上。回答选择题时,选出每
小题答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,
再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H:1 C:12 N:14 O:16
一、选择题:本题共包括 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,
每小题 4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 广东省是岭南文化的重要传承地。下列非遗物品中材质不属于硅酸盐的是
A.石湾陶艺 B.潮州木雕 C.肇庆端砚 D.广东砖雕
A. A B. B C. C D. D
2.“神舟十八号”载人飞船发射圆满成功,中国人的航天梦又向前迈进了一步。下列说法不正确的是
A. 为神舟系列飞船发射和返回提供保障的特种玻璃纤维是一种无机非金属材料
B. 首次在飞船上采用的锂离子蓄电池是一种一次电池
C. 火箭燃料的助燃剂N2O4是一种非金属氧化物
D. 航天员食用的燕麦片中所含的纤维素是一种人体所需的糖类物质
3. 下列化学用语表述正确的是
A. 甲烷的空间填充模型:
B. 聚丙烯的结构简式:
C. 四氯化碳的电子式:
D. CH2BrCH2Br 的名称:1,2-二溴乙烷
4. “劳动是人类生存和社会发展的基础”。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 环保工程师测定雨水的 pH≈5.6 雨水中溶解了CO2
B 某同学用热的碱性溶液洗涤沾有油脂的碗碟 油脂的饱和程度越高,熔点越高
C 面点师用含碳酸氢铵的膨松剂制作饼干 碳酸氢铵受热易分解
D 炼化工人将煤气化或液化后再利用 提高煤的利用率
A. A B. B C. C D. D
5.“绿水青山就是金山银山”。下列说法不正确的是
A. 在燃煤过程中加入石灰石,是为了减少温室气体的排放
B. 过量使用化肥可能造成水体富营养化,产生水华现象
C. 电池虽然应该回收利用,但不属于“可回收垃圾”
D. 滥用杀虫剂会破坏生态平衡,造成恶性循环
6. 物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途对应且正确的是
选
结构 性质 用途
项
A N2分子的结构式为N N 氮气分子很稳定 N2可用作反应的保护气
在Mg Al / NaOH 溶液原电
B Mg的核电荷数小于 Al Mg比 Al活泼
池中Mg作负极材料
密度比水大,粘度
C 油脂含有烃基和酯基 比较大,易溶于有 用有机溶剂提取种子里的油
机溶剂
硅酸盐中 Si、O的结构为
D 硅酸盐材料可用作黏合剂和防硅酸盐的硬度高
火剂
A. A B. B C. C D. D
7. 化学品的合理使用是每一位生产者和消费者的要求和责任。下列关于化学品的描述正确的是
A. 不慎将浓硫酸滴在皮肤上,应立即用大量水冲洗并涂抹稀NaHCO3溶液
B. 处方药需要凭医生处方购买和使用,其包装上有“OTC”标识
C. 淀粉作为一种多糖,可以水解生成葡萄糖和果糖
D. 在食盐中加入碘化钾作为营养强化剂
8. 自然资源的合理开发利用是我们学习化学的重要目的。下列有关说法不正确的是
A. 直接加热氧化银可得到金属银 B. 电解饱和食盐水不能得到金属钠
C. 石油裂解可以得到甲烷 D. 海水提镁所涉及反应均为氧化还原反应
9. 为除去下列物质中的杂质,除杂试剂的选择不合理的是
选项 物质 杂质 除杂试剂
A Cl2 HCl 饱和食盐水
B NO NO2 水
C CO2 SO2 氢氧化钠溶液
D 乙酸乙酯 乙酸 饱和碳酸钠溶液
A. A B. B C. C D. D
10. 山梨酸是一种国家允许使用的防腐剂,其结构如下图所示。下列说法正确的是
A. 山梨酸的分子式为C6H9O2
B. 山梨酸与丙烯酸( )互为同系物
C. 1 mol山梨酸与 Na反应最多生成 0.5 mol H2
D. 1 mol山梨酸最多可以与 3 mol Br2 发生加成反应
11. 工业上以二氧化硫和空气混合制取三氧化硫:2SO2 g +O2 g 2SO3 g (放热反应)。在一定温度
下向某刚性密闭容器中充入 2mol SO2 g 和 2mol O2 g 发生反应,下列描述不能说明该反应达到平衡
状态的是
A. 混合气体中SO2 的物质的量不再改变
B. 2v正 O2 v逆 SO3
C. 混合气体中O2的含量不再改变
D. 混合气体中SO2 、O2和SO3物质的量之比为 2∶1∶2
12. 下列化学反应的化学方程式或离子方程式书写正确的是
A. Cu与浓硝酸反应:Cu 2H NO 3 Cu
2 H2O NO2
B. 蔗糖的水解反应:C 催化剂12H22O11 蔗糖 H2O 2C6H12O6 葡萄糖
C. 2 将二氧化硫通入硫化氢溶液中:SO2 4H 2S 3S 2H2O
D. 硫酸铁铵[NH4Fe SO4 2 ]与过量氢氧化钡溶液的反应:
NH 4 Fe
3 2SO2 4 4OH
2Ba2 NH3 H2O Fe OH 2BaSO 3 4
13. 下图所示的实验装置中,能达到实验目的的是
实验装
置
实验目 A.检验 X溶液中含有SO2 4 B.制备并收集NO的 2
实验装
置
实验目 C.用喷泉实验验证NH3的溶解性 D.探究CH4 和Cl2发生取代反应的
A. A B. B C. C D. D
14. 下列有关电池的描述不正确的是
选 A.铜锌H2SO4溶液原电池 B.铜锌CuSO4溶液原电池项
电
池
描 负极质量减小,正极质量几乎不
负极质量减小,正极质量增大
述 变
选 C.铅酸蓄电池 D.氢氧燃料电池
项
电
池
描
负极质量增大,正极质量减小 负极和正极质量均几乎不变
述
A. A B. B C. C D. D
15. 设NA为阿伏加德罗常数的值。下列说法正确的是
A. 足量 Cu 与 1 mol S充分反应,转移电子的数目为NA
B. 常温下,将 1 mol Cu放入足量稀硝酸中,生成 NO分子的数目为 2 NA
C. 标准状况下,11.2 L乙酸中乙酸分子的数目为 0.5 NA
D. 1 mol正丁烷和异丁烷的混合物在空气中充分燃烧消耗O2分子的数目为 6.5 NA
16. 合成氨工业对农业、工业意义重大,随着科学技术的发展,人们对氨的需求量日益增长。已知:合成氨
反应中,生成 2 mol NH3时放出 92.4 kJ的热量。下列说法正确的是
A. 若向容器中加入 0.5 mol N2 g 和 1.5 mol H2 g 充分反应,则放出的热量为 46.2kJ
B. 断裂 1 mol N N键和 3 mol H H键需要吸收的能量之和小于形成 6 mol N H键放出的能量
C. 若升高温度合成氨的产率变高,说明升高温度合成氨的速率变快,氨分解的速率变慢
D. 不改变其他条件,延长反应时间有利于提高氢气的平衡转化率
二、非选择题:本题共 4小题,共 56分。
17. SO2 是一种常见的无机物,它既是重要的物质资源,也是环境污染物之一,某学习小组改进教材中关
于SO2 的制备和性质探究实验。回答下列问题:
(1)装置 A中铜与浓硫酸反应的化学方程式为______。
(2)查阅资料可知,可以用Na 2SO3 固体(粉末状)和稀硫酸溶液反应制备SO2 ,该反应的优点是无需使用
加热装置,则可选择的发生装置为______(填序号)。
(3)小组同学通过记录实验现象探究了SO2 的性质,完成下列表格。
装置 现象 解释
C ①_____ SO2 具有漂白性
D ②浅黄绿色变为无色 其中发生反应的离子方程式为______
E ③_____ SO2 具有______
(4)若直接将SO2 通入品红溶液中,容易发生“倒吸”现象,小组同学增加如图防倒吸装置 B,请在虚线
框中画出该装置______。
(5)装置 F的作用是尾气处理,盛放的试剂为_____,其中发生反应的离子方程式为____。
18. 铝土矿(主要成分为Al2O3,还含有Fe2O3和SiO2 )是生产金属铝的最佳原料,其总产量的 90%以上用于
生产金属铝。工业上利用铝土矿制备金属铝的工艺流程如下:
回答下列问题:
(1)“浸取”时为了使Al2O3转化为 Al OH ,试剂①可以选用______,发生反应的离子方程式为4
______,“浸渣 1”为______。
(2)试剂②可以选用______,加入试剂②的用量应______(填“少量”或“足量”),分离H2SiO3的方法为
______。
(3)“电解”过程发生反应的化学方程式为_______。
(4)利用铝热反应可以制备许多过渡金属单质,由Fe2O3制备 Fe的铝热反应的化学方程式为______。
19. 采用催化还原的处理方法可避免生产硝酸时产生的尾气(NOx )污染环境,回答下列问题。
(1)氮氧化物对环境的污染之一是形成酸雨,写出 NO在空气中转化为HNO3的化学方程式:_____。
(2)一定温度下,向体积为 2.0L的刚性密闭容器中充入 0.45 mol NH3和 0.50mol NO2 ,发生反应:
8NH3 g 6NO2 g 7N2 g 12H2O g 。测得部分气体的物质的量随时间变化关系如图所示。
①该反应中作为还原剂的是______(填化学式,下同),曲线 B表示______的物质的量,随时间的变化关系。
②0~5.0 min内,N 的物质的量浓度的变化量为______mol L 12 (保留 2位有效数字,下同),NO2 的平均
反应速率为_______;平衡时NH3的转化率为_______。
③为了提高该氧化还原反应的速率,可以采取的措施是______(填序号)。
a.加入适宜的催化剂 b.降低温度 c.减小压强 d.提高NH3的浓度
20. 有机玻璃(PMMA)俗称“亚克力”,是一种应用广泛的热塑性塑料。一种合成有机玻璃的工艺流程如下:
已知: O 2 /Cu (R、 代表烃基或氢原子)
回答下列问题:
(1)A的名称为_______。
(2)A→B的反应中除了生成 B,另一种副产物的结构简式为________,其与 B的关系为______。
(3)C的结构简式为______。
(4)E中所含官能团名称为_______。
(5)E转化为 F的化学方程式为_______,反应类型为________。
(6)F在一定条件下发生自身加成聚合反应得到 pMMA,PMMA的结构简式为_______。
参考答案
一、选择题:本题共包括 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16小题,
每小题 4分。
题号 1 2 3 4 5 6 7 8 9 10
答案 B B D B A A A D C C
题号 11 12 13 14 15 16
答案 D D C C D B
17. (1)Cu 2H2SO4 CuSO4 2H2O SO2
(2)b
3 2 ( )品红溶液褪色 Cl2 SO2 2H2O SO4 2Cl 4H 紫红色变为无色 ④. 还原性
(4)
(5) 氢氧化钠溶液 SO2 2OH
-=SO2 3 H2O
18. (1 2 ) 氢氧化钠溶液 Al2O3 2OH 3H2O 2[Al OH ]4 、 SiO2 2OH SiO3 H2O
Fe2O3
(2) 盐酸溶液 足量 过滤
通电
(3) 2Al2O3 4Al 3O2
熔融
(4) 2Al Fe2O3 2Fe Al2O3
19. (1) 4NO+3O2+2H 2O=4HNO3
(2)①. NH3 H2O g
②. 0.12mol / L 0.02mol L-1 min -1 59.26%
③ a、d
20. (1)丙烯
(2) CH3CH2CH2OH 同分异构体
(3)
(4)碳碳双键、羧基
(5) 取代(酯化)反应
(6)
同课章节目录
