氧化还原反应 高一上学期化学人教版(2019)必修一(共54张PPT)
文档属性
| 名称 | 氧化还原反应 高一上学期化学人教版(2019)必修一(共54张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 11:50:32 | ||
图片预览










文档简介
(共54张PPT)
第一章第二节
氧化还原反应
1.3.1氧化还原反应
高一必修一
课堂目标
1、通过概念建立过程,并运用比较、分类、归纳、 概括等方法对信息进行加工从而理解电离、电解质、 非电解质的含义。
2、掌握书写电离方程式的一般方法及其正误判断。
3、学会举一反三,利用概念区分物质的归属问题。
目录
多角度看氧化还原反应
氧化还原反应与其他反 应类型之间的关系
电子转移的表示方法
01
02
03
《元丰行示德逢》节选
雷蟠电掣云滔滔, 夜半载雨输亭皋。 旱禾秀发埋牛尻, 豆死更苏肥荚毛。
以上两句诗是《元丰行示德逢》的中心句子,所讲的是“雷雨发庄稼”的
农谚知识。里面所蕴含的化学反应如上
这三中反应属于什么反应类型呢
②2NO+0 = 2NO
③3NO +H O=—2HNO +NO
古 诗 词 中 的 化 学
类型 定义 代表式 特点 举例 化合 由两种或两种以 多变 C+O,点燃co N + O 放 电2NO与2NO+O =2NO 是化合反应 3NO +H O=2HNO +NO是复分解反应
为什么3NO +H O=2HNO +NO不是复分解反应 那又是什么反应类型呢 带着这个问题让我们进入接 下来新课程的学习吧! 刀 解反 应 相变换成分,生成 另外两种化合物 的反应 AB+CD→ AD+CB 相互 交换 酸碱中和反应 沉淀反应
反 应 类 型
PART
01
多角度看氧化还原反应
课本P22
在初中,我们根据反应中物质得到氧或失去氧,把化学反应分为氧
化反应或还原反应。
只有得氧(或失氧)的反应才是氧化反应(或还原反应)吗
铁丝在空气中红热,在氧气中剧烈燃烧 占 燃
Fe+O = Fe O 个
回 顾 旧 知
C+O 燃 CO 个
图2-11硫分别在空气和氧气里燃烧 图2-12木炭分别在空气和氧气中燃烧
SO 个
S+O —
点燃
物质 反应物
发生的反应
得氧物质 C、CO
氧化反应
失氧物质 CuO、Fe O
还原反应
课本P22
1、从得失氧的角度认识氧化还原反应(初中角度)
得 失 氧 的 角 度
(2)FeCO +3CO 高温 2Fe+3CO
2Cu+CO 个
(1)2CuO+C
高温
失氧,被还原(还原反应)
得氧,被氧化(氧化反应)
高温
Fe2O3 十 3 CO =2Fe 十 3 CO2
失氧,被还原(还原反应)
得 失 氧 的 角 度
课本P22
1、从得失氧的角度认识氧化还原反应(初中角度)
得氧,被氧化(氧化反应)
高温
+C=2Cu+CO
得氧失氧同时发生
氧化还原同时发生
2CuO
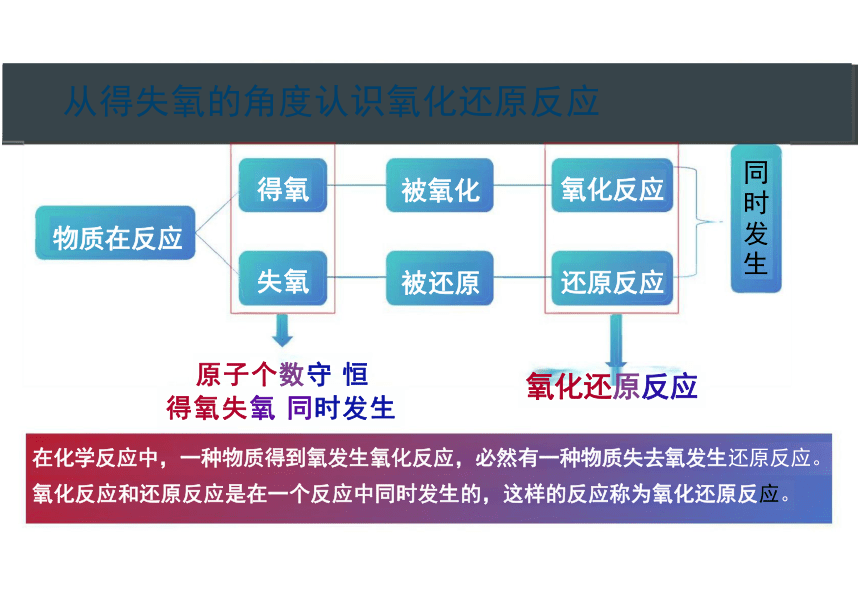
从得失氧的角度认识氧化还原反应
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。
氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
原子个数守 恒
得氧失氧 同时发生
氧化反应
还原反应
被氧化
被还原
得氧
失氧
氧化还原反应
物质在反应
同时发生
从化合价的角度认识氧化还原反应
判断下列物质是否属于氧化还原反应
Fe+CuSO =FeSO +Cu
NaOH+HCl=NaCl+H O
通电
2H O=O 个 +2 H 个
根据上述例子我们发现不能简单地从得氧失氧来判断,那同
学们还知道能从哪个角度来解释氧化还原反应吗
思考
X
化合价口决
钾钠氢银正一价,钙镁钡锌正二价。 氟氯溴碘负一价,通常氧是负二价 一二铜二三铁,三铝四硅碳。 单质为零价,化合物和为零。 氢氧根负一铵正一。 所有酸根皆为负,一硝三磷二硫碳
通常用氧来反推 其他元素的化合 价态
从化合价的角度认识氧化还原反应
从化合价的角度认识氧化还原反应
化合价升高,被氧化(氧化反应)
+2 0 高温 0 十4
2CuO 十 C = 2Cu 十 CO2|
化合价降低,被还原(还原反应)
化合价升高,被氧化(氧化反应)
+3 +2 高温 0 +4
Fe2O3 十 3 CO = 2Fe 十 3 CO2
化合价降低,被还原(还原反应)
2CuO 十 C 高温 2Cu +CO2
01
Cu 元 素 失氧 +2→0 化合价降低 被氧化
02
C元素 得氧 0→+4 化合价升高 被还原
氧化还原反应的发生与化合价的升降有关
失氧 +2→0 化合价降低 被氧化
得氧 0→+2 化合价升高 被还原
01
Fe元素
02
C元素
化 合 价 的 角 度
同时发生
同时发生
化合价降低,被还原(还原反应)
化合价降低,被还原(还原反应)
0 +2 +2 0
Fe + CuSO =2FeSO +Cu
化合价升高,被氧化(氧化反应)
从化合价的角度认识氧化还原反应
化合价升高,被氧化(氧化反应)
十4
2Cu + CO2|
+2
2Cu O+C
0 高温
并不只有得失氧的反应会发生氧化还原反应
01
无 +2→0 化合价降低 被氧化 Cu 元素
02
无 0→+2 化合价升高 被还原 Fe元素
Cu 元素 失氧 +2→0 化合价降低 被氧化
C元素 得氧 0→+4 化合价升高 被还原
化 合 价 的 角 度
2CuO 十 C 高温 2Cu +CO2
同时发生
同时发生
01
02
从化合价的角度认识氧化还原反应
化合价降低,被还原(还原反应)
Na + 2l, 燃 C 1
化合价升高,被氧化(氧化反应)
元素化合价没发生变化
NaOH +HCl =NaCl +H O
l
-
Na
+1
可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,
也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。
01
Na元素
02
C1元 素
化合价降低
化合价升高
01
NaOH
02
HCI
无 只
原子
离
痪
还
花
化 合 价 的 角 度
+2→0
0→+4
被氧化
被还原
无
无
同时发生
无
无
无
无
无
无
无
无
NaCI
+Cl
点燃
二
Na
是否得失氧 有无化合价升降
是否发生氧化还原反应
高 温 2CuO +C= 2Cu+CO2 得失氧
氧化还原反应
化合价升降 反应前后有元素化合价发生变化,是氧化还原反应的重要特征。 无 化 合 价 开 降
羊 化 还 原 反 应
NaOH +HCl =NaCl +H O 无 无
无
化 合 价 的 角 度
从得失氧的角度认识氧化还原反应
升高 被氧化 氧化反应
为什么化合价升 降会同时发生
降低 被还原 还原反应
我们知道化合价态是元素得失电子后形成离子的表现手法,那么
也就意味着氧化还原反应实际上是与电子转移有关
得失电子守恒
化合价升降同时发生
氧化还原反应
元素化合价
同时发生
从电子转移的角度认识氧化还原反应
①金属与非金属的反应:以 Na+Cl N aC1的电子转移动态视频为例
离子化合物:强 碱、多数盐、活发金属的氧化物等。
钠离子与氯离子之间以离子键的形式结合。
离子键是由电子转移 (失去电子者为阳离子,获得电子者为阴离 子)形成的。
Na+ C-
Na+ Cl-
化合价升降的原因 ——电子得失
化合价的升降是什么原因引起的
-17
17
回顾
② 非金属与非金属的反应:H +Cl 2 HCI
电子对偏离,化合价升高,被氧化,发生氧化反应
H
共价键
原子间通过共用电子对所形成的相互作用力
共价化合物
共用电子对偏向氯
+1 -1
Cl
电 子 转 移 的 角 度
化合价升降原因—— 共 用电子对的偏移
0 0 点燃 +1-1
H +Cl =2HCl
只含共价键的化合物,如HCI、AIC. 等
廿价键
根离子结合时国子对
但因为电子本就册 回 丰 ,P所以又月及工
共用电子对的偏移
化合价的升降需要共用电子对的偏移,
而酸碱中和反凡只交换离子 ,并无发生
③复分解反应:NaOH +HCl =NaCl +H O
电 子 转 移 的 角 度
电子转移或产生共用电
子一开始并无电
H O
是否发生氧化还 原反应 是否有化合价 的升降 发生/没发生 化合价升降的 原因 氧化还原反应的 本质 ①金属与非金属的反应:Na+Cl 点 燃 NaCI 氧化结论: 有电子转移(电子得失或共用 偏移)的反应是氧化还原反应。
失 对
② 电子对 氧化 M 出 ③ 复 分 解 反 应 :NaOH +HCl =NaCl +H O 无 无 无电子得失与 共用电子对偏移
电 子 转 移 的 角 度
N +O 2NO :N::o :
2NO+O =2NO :0D n:日o: 3NO +H O= 2HNO +NO
同学们还记得课堂开始之前的“雷雨发庄稼”吗 这三个
化学反应是否为氧化还原反应呢 同学们能否利用刚刚 的知识从三个角度来分析呢
雷 雨 发 庄 稼
思考
失氧,化合价降低,电子对偏离,被还原(还原反应)
0 0 放电 +2 -2
N + O = 2NO
得氧,化合价升高,电子对偏离,被氧化(氧化反应)
失氧,化合价降低,电子对偏离,被还原(还原反应)
+2 0 +4-2
2NO + O = 2NO
得氧,化合价升高,电子对偏离,被氧化(氧化反应)
失氧,化合价降低,电子对偏离,被还原(还原反应)
+4 +5
3NO + H O=2HNO + NO
得氧,化合价升高,电子对偏离,被氧化(氧化反应)
雷 雨 发 庄 稼
得失氧 化合价升降 电子得失与 共用电子对偏移 氧化还原反应 N +O 放电2NO 得失氧 “雷雨发庄稼”的三个化 学反应均为氧化还原反应
还 原 反 应
得失氧
北还原反应
3NO +H O=2HNO +NO 得失氧 化合价升降 共用电子对偏移 氧化还原反应
雷 雨 发 庄 稼
1、从得氧失氧角度分析
物质得到氧被氧化,物质失去氧被还原。
(仅局限于得氧失氧的反应)
2、从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
(元素化合价升降是氧化还原反应的表观特征,可作为氧化还原反应的判 断依据)
3、从电子转移角度分析(氧化还原反应的本质是电子转移)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
氧化还原反应
概念:
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质 失去氧发生还原反应。氧化反应和还原反应是在一个反应中同时
发生的,这样的反应称为氧化还原反应
本质:
电子转移(电子得失或共用电子对偏移) 特征: 化合价开降。有升必有降,开降相等
可用来判断是否发 生氧化还原反应
氧 化 还 原 反 应
化合价升高 失去电子 氧化反应 被氧化 氧化产物
反应物 变价特征转移电子(实质) 反 应 过程 产物
化合价降低 得到电子 还原反应 被还原 还原产物
口诀:升失氧化,降得还原
氧化还原反应
发生 · 生成
发生 生成
概念辨析
得氧、失氧与氧化还原反应没有必然的关系,凡是有化合价升
降的化学反应都是氧化还原反应。如Na+C 点燃 NaCI
氧化还原反应可以只有一种元素被氧化还原,如3NO +H O=
2HNO +NO, NO 既被氧化又被还原。(歧化反应/归中反应)
2、氧化还原反应当一种元素被还原,必有另一种元素被氧化吗
1、只有得氧(或失氧)的反应才是氧化反应(或还原反应)吗
我国“四大发明”在人类发展史上起到了非常重要的作用,其
中黑火药的爆炸反应为
2KNO +S+3C 点燃 K S+N 个+3CO 个。该反应中被
氧化的元素是( A )
A.C B.N C.N 和S D.N 和C
巩固练习
下列有关氧化还原反应的叙述正确的是( C )
A .元素化合价升高的反应是还原反应
B. 物质在反应中失去电子,此物质中的某一元素化合价降低
C. 有电子转移的反应是氧化还原反应
D. 有化合价升降的反应不一定是氧化还原反应
巩固练习
下列氧化还原反应发生在同种元素之间的是(B)
A.Zn+2HCl=ZnCl +H 个
B.2H S+SO =3S+2H O
C.
D.
巩固练习
“铜绿”即是铜锈,它的化学成分是Cu (OH) CO (碱式碳酸铜)。
铜在潮湿的空气中生锈的化学反应为2Cu+O +CO +
H O=Cu(OH) CO 。 下列有关该反应的说法正确的是( D ) A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O 失电子,所以是氧化还原反应
解析:在该反应中,Cu 元素的化合价由0变成+2,失去电子,被氧化;0元素的化合价 由0变成-2,得到电子,被还原,其余元素的化合价都没有发生变化。
巩固练习
(NH ) Cr O 是一种受热易分解的盐。下列各组对(NH ) Cr O 受热
分解产物的判断,符合实际的是( )
A.CrO +NH +H O D
B.Cr O +NH +H O
C.CrO +N +H O
D.Cr O +N +H O
解析:氧化还原反应中必须符合元素的化合价有升有降
巩固练习
PART
02
氧化还原反应与其他 反应类型之间的关系
思考
“雷雨发庄稼”所发生的三个化学反应是氧化还原反应,
但同时有两个反应也是属于其他反应类型,那么氧化还原 反应又与其他反应类型有什么关系呢
反 应 类 型
3NO +H O=2HNO +NO 是复分解反应
2NO与2NO+O =2NO 是化合反应
N +O
化学反应(反应条件未标) 基本类型 是否为氧化还原反应 CaCO ==CaO+CO 个
分解反应 × 1、复分解反应不是氧化还原反应 2、哪种化合反应或者分解反应一定 是氧化还原反应 3、置换反应一定是氧化还原反应 分解反应 复分解反应 X 复分解反应 X 置换反应
X 2Na+Cl =2NaCl 化合反应 H O+CaO ==Ca(OH) 化合反应 ×
氧化还原反应与四大基本反应类型之间的关系
置换反应定义:
置换反应是一种单质与化合物反 成另外一种单质和化合物的化学反应 如活泼金属与非氧化性酸的反应、金属跟盐中较不活泼金属阳离子
Fe+CuSO =FeSO +Cu、2Na+2H O====2NaOH+H 个等
1、复分解反应不是氧化还原反应
2、哪种化合反应或者分解反应一定是氧化还原反应
3、置换反应一定是氧化还原反应
氧化还原反应与四大基本反应类型之间的关系
1、按四大基本反应类型分类
化合反应(A+B→C) <
分解反应( A→ B+C)
置换反应(A+ BC→ B+AC)
复分解反应(AB+CD→AD 丛
2、按是否进行氧化还原分类
氧化还原反应
非氧化还原反应
反应类型的分类
有单质参加或有单质生成的反应
不一定是氧化还原反应,例如同 素异形体之间的转化并没有发生 化合价的改变
如石墨转化为金刚石就不是氧化 还原反应;或者氧气转化为臭氧 也不是氧化还原反应
分应
氧化还原反应
置换反应
复分解反应
反应类型的分类
巩固练习
A.Cl +2NaI===2NaCl+I
B.NH HCO ==△==NH 个+H O+CO 个
C.4Fe(OH) +O +2H O===4Fe(OH)
解 析 :A: 置换反应,B: 非氧化还原的分解反应,C 有单质参加的化合反应
D: 氧化还原反应
氧化还原反应与四种基本反应类
型的关系如图所示,则下列化学反应
分解 反应
2
氧化还原反应3
置换反应4
属于阴影3区域的是( )
ACD
化合 反应
催化剂
反应2NO+2CO"==N +2CO 可应用于汽车尾气的净化。下
列判断正确的是( C
A .该反应是置换反应
B. 该反应是复分解反应
C.CO 被氧化
D.NO 发生氧化反应
巩固练习
化合物X 和Y 能发生如下化学反应
①X+H O→W+H ②Y+H O→N+O
下列关于反应①②的说法正确的是()
A.反应①②均属于氧化还原反应
B.反应①属于氧化还原反应,反应②属于非氧化还原反应
C.反应①属于复分解反应,反应②属于氧化还原反应
D 解析:反应①②均是由化合物与化合物反应生成单质与另一种物质的反应,则反 应中一定有元素化合价发生变化,故反应①②均属于氧化还原反应
巩固练习
PART
03
电子转移的
表示方法
电子转移的表示方法
氧化还原反应的特征是化合价升降,本质是电子转移
我们该如何表示转移的过程
思考
3.标出“失去”、“得到”的电子总数
注意:失电子数=得电子数 得失电子守恒
Mg+Cl =MgCl
1.标出变价元素的化合价
2.用双箭号表示,箭头从 反应物指向生成物的同一种元素。
“双线桥”法
1.标出变价元
2.明确有变价)箭号不跨过等号 ,起点为失电子元素
g→ 终点为得电子元素。 ( 起 失 终 得 )
3.用单箭号表只标电子转移总数,不标得与失
2e-
g
2
M
0
Mg+Cl =MgCl
“单线桥”法
Mg+Cl =MgCl
注意
(1)双线桥法:①标变价,②指同素,③标得失
实例:用双线桥法标出铜和浓硝酸反应电子转移的方向和数目:
失去2e-
Cu +4HNO =Cu(NO ) +2NO2|+2 H O
得到2e-
(2)单线桥法:①标变价,②确总数,③指得失
实例:用单线桥法标出铜和稀硝酸反应电子转移的方向和数目:
6e-
3Cu +8HNO =3Cu(NO ) +2NO2|+4H O
电子转移的表示方法
+2×3e-, 化合价降低,被氧化
高温
B.Fe O +3CO— 2Fe+3CO
—3×2e,化合价升高,被还原 得到2×3e-, 化合价降低,被还原
高温
D.Fe O +3CO— 2Fe+3CO
失去3×2e-,化合价升高,被氧化
得到2×3e~,化合价降低,被氧化
A.Fe O +3CO 高温2Fe+3CO
失去3×2e~,化合价升高,被还原
得到3×2e-,化合价降低,被还原 高温
C.Fe O +3CO— 2Fe+3CO
失去2×3e-,化合价升高,被氧化
解析:氧化铁得到2×3e -,化合价降低,被还原;一氧化碳失去3×2e -,
化合价升高,被氧化。得失电子不能用“+”“-”表示。
下列电子转移的表示方法中正确的是 (D)
氧化还原反应
一、导入:“雷雨发庄稼”
二、多角度认识氧化还原
1、得失氧角度
2、化合价升降角度( 特 征 )
3、电子转移角度( 本 质 ) 口诀:升失氧化,降得还原
三、与四大基本反应类型的关系
四、电子转移的表示方法
总 结
THANK YOU
THIS POWERPOINT DESIGNED BY CREATIVITY
第一章第二节
氧化还原反应
1.3.1氧化还原反应
高一必修一
课堂目标
1、通过概念建立过程,并运用比较、分类、归纳、 概括等方法对信息进行加工从而理解电离、电解质、 非电解质的含义。
2、掌握书写电离方程式的一般方法及其正误判断。
3、学会举一反三,利用概念区分物质的归属问题。
目录
多角度看氧化还原反应
氧化还原反应与其他反 应类型之间的关系
电子转移的表示方法
01
02
03
《元丰行示德逢》节选
雷蟠电掣云滔滔, 夜半载雨输亭皋。 旱禾秀发埋牛尻, 豆死更苏肥荚毛。
以上两句诗是《元丰行示德逢》的中心句子,所讲的是“雷雨发庄稼”的
农谚知识。里面所蕴含的化学反应如上
这三中反应属于什么反应类型呢
②2NO+0 = 2NO
③3NO +H O=—2HNO +NO
古 诗 词 中 的 化 学
类型 定义 代表式 特点 举例 化合 由两种或两种以 多变 C+O,点燃co N + O 放 电2NO与2NO+O =2NO 是化合反应 3NO +H O=2HNO +NO是复分解反应
为什么3NO +H O=2HNO +NO不是复分解反应 那又是什么反应类型呢 带着这个问题让我们进入接 下来新课程的学习吧! 刀 解反 应 相变换成分,生成 另外两种化合物 的反应 AB+CD→ AD+CB 相互 交换 酸碱中和反应 沉淀反应
反 应 类 型
PART
01
多角度看氧化还原反应
课本P22
在初中,我们根据反应中物质得到氧或失去氧,把化学反应分为氧
化反应或还原反应。
只有得氧(或失氧)的反应才是氧化反应(或还原反应)吗
铁丝在空气中红热,在氧气中剧烈燃烧 占 燃
Fe+O = Fe O 个
回 顾 旧 知
C+O 燃 CO 个
图2-11硫分别在空气和氧气里燃烧 图2-12木炭分别在空气和氧气中燃烧
SO 个
S+O —
点燃
物质 反应物
发生的反应
得氧物质 C、CO
氧化反应
失氧物质 CuO、Fe O
还原反应
课本P22
1、从得失氧的角度认识氧化还原反应(初中角度)
得 失 氧 的 角 度
(2)FeCO +3CO 高温 2Fe+3CO
2Cu+CO 个
(1)2CuO+C
高温
失氧,被还原(还原反应)
得氧,被氧化(氧化反应)
高温
Fe2O3 十 3 CO =2Fe 十 3 CO2
失氧,被还原(还原反应)
得 失 氧 的 角 度
课本P22
1、从得失氧的角度认识氧化还原反应(初中角度)
得氧,被氧化(氧化反应)
高温
+C=2Cu+CO
得氧失氧同时发生
氧化还原同时发生
2CuO
从得失氧的角度认识氧化还原反应
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。
氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
原子个数守 恒
得氧失氧 同时发生
氧化反应
还原反应
被氧化
被还原
得氧
失氧
氧化还原反应
物质在反应
同时发生
从化合价的角度认识氧化还原反应
判断下列物质是否属于氧化还原反应
Fe+CuSO =FeSO +Cu
NaOH+HCl=NaCl+H O
通电
2H O=O 个 +2 H 个
根据上述例子我们发现不能简单地从得氧失氧来判断,那同
学们还知道能从哪个角度来解释氧化还原反应吗
思考
X
化合价口决
钾钠氢银正一价,钙镁钡锌正二价。 氟氯溴碘负一价,通常氧是负二价 一二铜二三铁,三铝四硅碳。 单质为零价,化合物和为零。 氢氧根负一铵正一。 所有酸根皆为负,一硝三磷二硫碳
通常用氧来反推 其他元素的化合 价态
从化合价的角度认识氧化还原反应
从化合价的角度认识氧化还原反应
化合价升高,被氧化(氧化反应)
+2 0 高温 0 十4
2CuO 十 C = 2Cu 十 CO2|
化合价降低,被还原(还原反应)
化合价升高,被氧化(氧化反应)
+3 +2 高温 0 +4
Fe2O3 十 3 CO = 2Fe 十 3 CO2
化合价降低,被还原(还原反应)
2CuO 十 C 高温 2Cu +CO2
01
Cu 元 素 失氧 +2→0 化合价降低 被氧化
02
C元素 得氧 0→+4 化合价升高 被还原
氧化还原反应的发生与化合价的升降有关
失氧 +2→0 化合价降低 被氧化
得氧 0→+2 化合价升高 被还原
01
Fe元素
02
C元素
化 合 价 的 角 度
同时发生
同时发生
化合价降低,被还原(还原反应)
化合价降低,被还原(还原反应)
0 +2 +2 0
Fe + CuSO =2FeSO +Cu
化合价升高,被氧化(氧化反应)
从化合价的角度认识氧化还原反应
化合价升高,被氧化(氧化反应)
十4
2Cu + CO2|
+2
2Cu O+C
0 高温
并不只有得失氧的反应会发生氧化还原反应
01
无 +2→0 化合价降低 被氧化 Cu 元素
02
无 0→+2 化合价升高 被还原 Fe元素
Cu 元素 失氧 +2→0 化合价降低 被氧化
C元素 得氧 0→+4 化合价升高 被还原
化 合 价 的 角 度
2CuO 十 C 高温 2Cu +CO2
同时发生
同时发生
01
02
从化合价的角度认识氧化还原反应
化合价降低,被还原(还原反应)
Na + 2l, 燃 C 1
化合价升高,被氧化(氧化反应)
元素化合价没发生变化
NaOH +HCl =NaCl +H O
l
-
Na
+1
可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,
也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围。
01
Na元素
02
C1元 素
化合价降低
化合价升高
01
NaOH
02
HCI
无 只
原子
离
痪
还
花
化 合 价 的 角 度
+2→0
0→+4
被氧化
被还原
无
无
同时发生
无
无
无
无
无
无
无
无
NaCI
+Cl
点燃
二
Na
是否得失氧 有无化合价升降
是否发生氧化还原反应
高 温 2CuO +C= 2Cu+CO2 得失氧
氧化还原反应
化合价升降 反应前后有元素化合价发生变化,是氧化还原反应的重要特征。 无 化 合 价 开 降
羊 化 还 原 反 应
NaOH +HCl =NaCl +H O 无 无
无
化 合 价 的 角 度
从得失氧的角度认识氧化还原反应
升高 被氧化 氧化反应
为什么化合价升 降会同时发生
降低 被还原 还原反应
我们知道化合价态是元素得失电子后形成离子的表现手法,那么
也就意味着氧化还原反应实际上是与电子转移有关
得失电子守恒
化合价升降同时发生
氧化还原反应
元素化合价
同时发生
从电子转移的角度认识氧化还原反应
①金属与非金属的反应:以 Na+Cl N aC1的电子转移动态视频为例
离子化合物:强 碱、多数盐、活发金属的氧化物等。
钠离子与氯离子之间以离子键的形式结合。
离子键是由电子转移 (失去电子者为阳离子,获得电子者为阴离 子)形成的。
Na+ C-
Na+ Cl-
化合价升降的原因 ——电子得失
化合价的升降是什么原因引起的
-17
17
回顾
② 非金属与非金属的反应:H +Cl 2 HCI
电子对偏离,化合价升高,被氧化,发生氧化反应
H
共价键
原子间通过共用电子对所形成的相互作用力
共价化合物
共用电子对偏向氯
+1 -1
Cl
电 子 转 移 的 角 度
化合价升降原因—— 共 用电子对的偏移
0 0 点燃 +1-1
H +Cl =2HCl
只含共价键的化合物,如HCI、AIC. 等
廿价键
根离子结合时国子对
但因为电子本就册 回 丰 ,P所以又月及工
共用电子对的偏移
化合价的升降需要共用电子对的偏移,
而酸碱中和反凡只交换离子 ,并无发生
③复分解反应:NaOH +HCl =NaCl +H O
电 子 转 移 的 角 度
电子转移或产生共用电
子一开始并无电
H O
是否发生氧化还 原反应 是否有化合价 的升降 发生/没发生 化合价升降的 原因 氧化还原反应的 本质 ①金属与非金属的反应:Na+Cl 点 燃 NaCI 氧化结论: 有电子转移(电子得失或共用 偏移)的反应是氧化还原反应。
失 对
② 电子对 氧化 M 出 ③ 复 分 解 反 应 :NaOH +HCl =NaCl +H O 无 无 无电子得失与 共用电子对偏移
电 子 转 移 的 角 度
N +O 2NO :N::o :
2NO+O =2NO :0D n:日o: 3NO +H O= 2HNO +NO
同学们还记得课堂开始之前的“雷雨发庄稼”吗 这三个
化学反应是否为氧化还原反应呢 同学们能否利用刚刚 的知识从三个角度来分析呢
雷 雨 发 庄 稼
思考
失氧,化合价降低,电子对偏离,被还原(还原反应)
0 0 放电 +2 -2
N + O = 2NO
得氧,化合价升高,电子对偏离,被氧化(氧化反应)
失氧,化合价降低,电子对偏离,被还原(还原反应)
+2 0 +4-2
2NO + O = 2NO
得氧,化合价升高,电子对偏离,被氧化(氧化反应)
失氧,化合价降低,电子对偏离,被还原(还原反应)
+4 +5
3NO + H O=2HNO + NO
得氧,化合价升高,电子对偏离,被氧化(氧化反应)
雷 雨 发 庄 稼
得失氧 化合价升降 电子得失与 共用电子对偏移 氧化还原反应 N +O 放电2NO 得失氧 “雷雨发庄稼”的三个化 学反应均为氧化还原反应
还 原 反 应
得失氧
北还原反应
3NO +H O=2HNO +NO 得失氧 化合价升降 共用电子对偏移 氧化还原反应
雷 雨 发 庄 稼
1、从得氧失氧角度分析
物质得到氧被氧化,物质失去氧被还原。
(仅局限于得氧失氧的反应)
2、从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
(元素化合价升降是氧化还原反应的表观特征,可作为氧化还原反应的判 断依据)
3、从电子转移角度分析(氧化还原反应的本质是电子转移)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
氧化还原反应
概念:
在化学反应中,一种物质得到氧发生氧化反应,必然有一种物质 失去氧发生还原反应。氧化反应和还原反应是在一个反应中同时
发生的,这样的反应称为氧化还原反应
本质:
电子转移(电子得失或共用电子对偏移) 特征: 化合价开降。有升必有降,开降相等
可用来判断是否发 生氧化还原反应
氧 化 还 原 反 应
化合价升高 失去电子 氧化反应 被氧化 氧化产物
反应物 变价特征转移电子(实质) 反 应 过程 产物
化合价降低 得到电子 还原反应 被还原 还原产物
口诀:升失氧化,降得还原
氧化还原反应
发生 · 生成
发生 生成
概念辨析
得氧、失氧与氧化还原反应没有必然的关系,凡是有化合价升
降的化学反应都是氧化还原反应。如Na+C 点燃 NaCI
氧化还原反应可以只有一种元素被氧化还原,如3NO +H O=
2HNO +NO, NO 既被氧化又被还原。(歧化反应/归中反应)
2、氧化还原反应当一种元素被还原,必有另一种元素被氧化吗
1、只有得氧(或失氧)的反应才是氧化反应(或还原反应)吗
我国“四大发明”在人类发展史上起到了非常重要的作用,其
中黑火药的爆炸反应为
2KNO +S+3C 点燃 K S+N 个+3CO 个。该反应中被
氧化的元素是( A )
A.C B.N C.N 和S D.N 和C
巩固练习
下列有关氧化还原反应的叙述正确的是( C )
A .元素化合价升高的反应是还原反应
B. 物质在反应中失去电子,此物质中的某一元素化合价降低
C. 有电子转移的反应是氧化还原反应
D. 有化合价升降的反应不一定是氧化还原反应
巩固练习
下列氧化还原反应发生在同种元素之间的是(B)
A.Zn+2HCl=ZnCl +H 个
B.2H S+SO =3S+2H O
C.
D.
巩固练习
“铜绿”即是铜锈,它的化学成分是Cu (OH) CO (碱式碳酸铜)。
铜在潮湿的空气中生锈的化学反应为2Cu+O +CO +
H O=Cu(OH) CO 。 下列有关该反应的说法正确的是( D ) A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O 失电子,所以是氧化还原反应
解析:在该反应中,Cu 元素的化合价由0变成+2,失去电子,被氧化;0元素的化合价 由0变成-2,得到电子,被还原,其余元素的化合价都没有发生变化。
巩固练习
(NH ) Cr O 是一种受热易分解的盐。下列各组对(NH ) Cr O 受热
分解产物的判断,符合实际的是( )
A.CrO +NH +H O D
B.Cr O +NH +H O
C.CrO +N +H O
D.Cr O +N +H O
解析:氧化还原反应中必须符合元素的化合价有升有降
巩固练习
PART
02
氧化还原反应与其他 反应类型之间的关系
思考
“雷雨发庄稼”所发生的三个化学反应是氧化还原反应,
但同时有两个反应也是属于其他反应类型,那么氧化还原 反应又与其他反应类型有什么关系呢
反 应 类 型
3NO +H O=2HNO +NO 是复分解反应
2NO与2NO+O =2NO 是化合反应
N +O
化学反应(反应条件未标) 基本类型 是否为氧化还原反应 CaCO ==CaO+CO 个
分解反应 × 1、复分解反应不是氧化还原反应 2、哪种化合反应或者分解反应一定 是氧化还原反应 3、置换反应一定是氧化还原反应 分解反应 复分解反应 X 复分解反应 X 置换反应
X 2Na+Cl =2NaCl 化合反应 H O+CaO ==Ca(OH) 化合反应 ×
氧化还原反应与四大基本反应类型之间的关系
置换反应定义:
置换反应是一种单质与化合物反 成另外一种单质和化合物的化学反应 如活泼金属与非氧化性酸的反应、金属跟盐中较不活泼金属阳离子
Fe+CuSO =FeSO +Cu、2Na+2H O====2NaOH+H 个等
1、复分解反应不是氧化还原反应
2、哪种化合反应或者分解反应一定是氧化还原反应
3、置换反应一定是氧化还原反应
氧化还原反应与四大基本反应类型之间的关系
1、按四大基本反应类型分类
化合反应(A+B→C) <
分解反应( A→ B+C)
置换反应(A+ BC→ B+AC)
复分解反应(AB+CD→AD 丛
2、按是否进行氧化还原分类
氧化还原反应
非氧化还原反应
反应类型的分类
有单质参加或有单质生成的反应
不一定是氧化还原反应,例如同 素异形体之间的转化并没有发生 化合价的改变
如石墨转化为金刚石就不是氧化 还原反应;或者氧气转化为臭氧 也不是氧化还原反应
分应
氧化还原反应
置换反应
复分解反应
反应类型的分类
巩固练习
A.Cl +2NaI===2NaCl+I
B.NH HCO ==△==NH 个+H O+CO 个
C.4Fe(OH) +O +2H O===4Fe(OH)
解 析 :A: 置换反应,B: 非氧化还原的分解反应,C 有单质参加的化合反应
D: 氧化还原反应
氧化还原反应与四种基本反应类
型的关系如图所示,则下列化学反应
分解 反应
2
氧化还原反应3
置换反应4
属于阴影3区域的是( )
ACD
化合 反应
催化剂
反应2NO+2CO"==N +2CO 可应用于汽车尾气的净化。下
列判断正确的是( C
A .该反应是置换反应
B. 该反应是复分解反应
C.CO 被氧化
D.NO 发生氧化反应
巩固练习
化合物X 和Y 能发生如下化学反应
①X+H O→W+H ②Y+H O→N+O
下列关于反应①②的说法正确的是()
A.反应①②均属于氧化还原反应
B.反应①属于氧化还原反应,反应②属于非氧化还原反应
C.反应①属于复分解反应,反应②属于氧化还原反应
D 解析:反应①②均是由化合物与化合物反应生成单质与另一种物质的反应,则反 应中一定有元素化合价发生变化,故反应①②均属于氧化还原反应
巩固练习
PART
03
电子转移的
表示方法
电子转移的表示方法
氧化还原反应的特征是化合价升降,本质是电子转移
我们该如何表示转移的过程
思考
3.标出“失去”、“得到”的电子总数
注意:失电子数=得电子数 得失电子守恒
Mg+Cl =MgCl
1.标出变价元素的化合价
2.用双箭号表示,箭头从 反应物指向生成物的同一种元素。
“双线桥”法
1.标出变价元
2.明确有变价)箭号不跨过等号 ,起点为失电子元素
g→ 终点为得电子元素。 ( 起 失 终 得 )
3.用单箭号表只标电子转移总数,不标得与失
2e-
g
2
M
0
Mg+Cl =MgCl
“单线桥”法
Mg+Cl =MgCl
注意
(1)双线桥法:①标变价,②指同素,③标得失
实例:用双线桥法标出铜和浓硝酸反应电子转移的方向和数目:
失去2e-
Cu +4HNO =Cu(NO ) +2NO2|+2 H O
得到2e-
(2)单线桥法:①标变价,②确总数,③指得失
实例:用单线桥法标出铜和稀硝酸反应电子转移的方向和数目:
6e-
3Cu +8HNO =3Cu(NO ) +2NO2|+4H O
电子转移的表示方法
+2×3e-, 化合价降低,被氧化
高温
B.Fe O +3CO— 2Fe+3CO
—3×2e,化合价升高,被还原 得到2×3e-, 化合价降低,被还原
高温
D.Fe O +3CO— 2Fe+3CO
失去3×2e-,化合价升高,被氧化
得到2×3e~,化合价降低,被氧化
A.Fe O +3CO 高温2Fe+3CO
失去3×2e~,化合价升高,被还原
得到3×2e-,化合价降低,被还原 高温
C.Fe O +3CO— 2Fe+3CO
失去2×3e-,化合价升高,被氧化
解析:氧化铁得到2×3e -,化合价降低,被还原;一氧化碳失去3×2e -,
化合价升高,被氧化。得失电子不能用“+”“-”表示。
下列电子转移的表示方法中正确的是 (D)
氧化还原反应
一、导入:“雷雨发庄稼”
二、多角度认识氧化还原
1、得失氧角度
2、化合价升降角度( 特 征 )
3、电子转移角度( 本 质 ) 口诀:升失氧化,降得还原
三、与四大基本反应类型的关系
四、电子转移的表示方法
总 结
THANK YOU
THIS POWERPOINT DESIGNED BY CREATIVITY
