电解质 高一上学期化学人教版(2019)必修一(共45张PPT)
文档属性
| 名称 | 电解质 高一上学期化学人教版(2019)必修一(共45张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 11:51:35 | ||
图片预览









文档简介
(共45张PPT)
第一章第二节
离子反应
1.2.1电解质的电离
高一必修一
课堂目标
1、通过概念建立过程,并运用比较、分类、归纳、 概括等方法对信息进行加工从而理解电离、电解质、 非电解质的含义。
2、掌握书写电离方程式的一般方法及其正误判断。
3、学会举一反三,利用概念区分物质的归属问题。
目录
01 物质的导电性
02 电解质与非电解质
03 电离与电离方程式
04 电解质的应用
PART
01
物质的导电性
生活中的导电物质
生活经验告诉我们,充电线它是由几根导线和绝缘的外壳组成的。
这些导线是铜线,而绝缘的外壳是热塑性塑料,同学们知道为什 么导线能够导电而绝缘外壳不导电吗
除了金属可以导电以外,同学们还能知道哪些物质可以导电呢
让我们带着这个问题来学习接下来新的知识
电,而塑料等绝缘体无法导电。
思考
思考
Closed Circuit
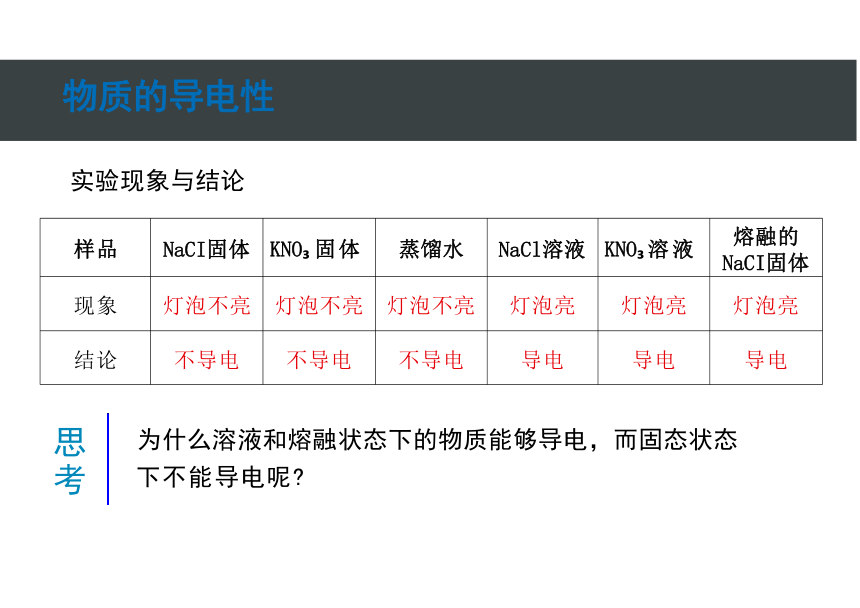
样品 NaCI固体 KNO 固体 蒸馏水 NaCl溶液 KNO 溶液
熔融的 NaCI固体
现象 灯泡不亮 灯泡不亮 灯泡不亮 灯泡亮 灯泡亮
灯泡亮
结论 不导电 不导电 不导电 导电 导电
导电
物质的导电性
为什么溶液和熔融状态下的物质能够导电,而固态状态
下不能导电呢
实验现象与结论
思考
氯化钠溶液和熔融的氯化钠导电的原因(结合课本图1-10至12与视频)
Na+ Na+和Cl-之间的离
子子键在熔融下断键,
与患源正极 点源鱼极
下 ,Na+ 和Cl-开始
做定向运动,电流
NaCl溶液能够导电
图1-12 Na 熔融的N意图能够导电
导电的原因
与更遵的极 和 电极 在外加电场的作用
相连的电极 相连的电极
Cl
开始产生。
导电的原因
除了固体的化合物无法导电外,部分有机化合物如蔗糖、乙醇等
在任何状态下也无法导电,同学们可以用刚刚的知识来解释吗
同学们能否用之前学习分类的方法再将这些物质进行
导电性分类呢
些无法导电的物质我们称之为绝缘体。
思考
思考
物质的导电性分类
离子化合物由阳离子和阴
根据前面的内容我们将物质的导电性分类如下 离子组成的化合物,共价 化合物是原子间以共用电 子对所组成的化合物分子。
本身可以导电 金属单质、
碳、硅等
本身不导电,但在水溶液 酸碱盐 或熔融状态下导电 金属氧化物
只在水中
导电
在水溶液中 和熔融状态 下都能导电
本身不导电,任何状态下
都不导电
共价 化合物
离子 化合物
共价键 离 子 键
物质的导电性
蔗糖 乙醇
PART
02
电解质与 非电解质
电解质中含有共价化合物和离子化合物。
其中共价化合物只能在水溶液中才能导电, 离子化合物两种状态下均能导电,因此只 要满足一种情况即可
电解质与非电解质
非电解质 在水溶液里和熔融状态 下均不能导电的化合物
归属于既不是
电解质也不是
满悲房解愿兄
在水溶液或熔融
状态下能否导电
不导电
化合物分类如下
能导电
一般地,同一物质
共价键>离子键
化 合 物
电解质 非电解质 相同点 均为化合物 在水溶液里或熔融状态下能 在水溶液中和熔融状态下不 哪些物质属于电解质,哪些又属于非电解质呢
本质区别 在水溶液里或熔融状态下自 身能发生电离 在水溶液里和熔融状态下自 身不能发生电离 在水溶液里或熔 融状态下的存在 形式 离子(离子或分子) 分子
电 解 质 与 非 电 解 质
强电解质
在水溶液里或熔融状态
下完全电离的电解质
弱电解质
在水溶液里或熔融状态
下部分电离的电解质
电解质与非电解质
根据强弱电解质
的概念,同学们
能找出哪些物质
属于强电解质,
哪些又属于弱电
解质吗
在水溶液或熔融
状态的电离程度
部分电离
电解质分类如下
完全电离
电解质
强碱 NaOH、KOH 等四大强碱
绝大多数盐 NaCl、KNO 、Cad
弱酸 CH COOH等
弱碱 NH ·H O 、Fe(OH) 等
水
电解质与非电解质
氨水:混合物
—水合氨:纯净物
举例
CuSO 溶液混合物
CuSO ·5H O 是纯净物
强电解质 弱电解质
电解质
强酸 H SO 、HCI 、HNO 等六大强酸
强弱电解质分类如下
1、导电的物质一定是电解质 电解质一定能导电 不能导电的 物质一定是非电解质
导电的物质不一定是电解质,例如:金属单质和混合物属于既 不是电解质也不属于非电解质等等;电解质不一定能导电,例 如:固体氯化钠等等;不能导电的物质不一定是非电解质,
例如:单质,混合物不管在水溶液中或熔融状态下是否能够导 电 ,既不是电解质也不属于非电解质。
概念辨析
2、非电解质一定是共价化合物 共价化合物一定是非电解质
非电解质可分为共价价化合物中的非金属氧化物、非酸性气态 氢、部分有机化合物,因此非电解质一定是共价化合物。
但电解质中含有共价化合物和离子化合物,因此共价化合物不 一定是非电解质。
概念辨析
2、SO 、CO 、NH 溶于水之后可以导电,属于电解质
SO 、CO 、NH 不属于电解质,SO 、CO 、NH 溶于水之后, 其导电的离子分别为H SO 、H CO 、NH ·H O, 而不是SO 、 CO 、NH , 因此它们不属于电解质。
电解质溶液能导电是由于电解质本身能电离出自由移动的离子 所有非金属氧化物均为非电解质
概念辨析
2、某物质属于电解质,其水溶液也属于电解质
错。一个物质属于电解质,意味着它是化合物,是纯净物。而 它的水溶液属于混合物,属于既不是电解质也不是非电解质。
概念辨析
2、电离程度=导电能力
错。完全电离指在水溶液或熔融状态下分子完全电离成离子。 部分电离指在水溶液或熔融状态下只有部分分子电离成离子 导电能力与溶液中离子浓度及离子所带电荷数多少有关,而与 电离程度以及溶解度无关。
如BaCO3 是难溶物,但溶解在水里的部分完全电离,因此属于 强电解质,但是溶解在水中的离子浓度很少,导电能力弱。
概念辨析
2、难溶物属于电解质还是属于非电解质
难溶物有弱碱,盐,金属氧化物,属于离子化合物
难溶物虽然难溶于水,但溶解在水中的分子能完全分开形成离 子,并且难溶物属于离子化合物,因此在水溶液和熔融状态下 均能导电,属于电解质
概念辨析
因为湿手表面为水,而水为电解质溶液,电解质溶液为第二类导体。所
以更容易导电。其实纯水的导电能力很弱,但是我们日常生活中的水含 有杂质离子,杂质离子溶于水中形成形成了电解质溶液,通过电解质溶 液那么电流就更容易进行传导,从而更容易产生触电的事故。
所以在日常的生活中我们如果手上有水的情况下不能直接去接触通电的 设备,这样才能避免触电事故的发生。
生活中的触电现象
生活中有许多危险警示,其中有一种是禁止湿手触摸电
器,同学们知道这是为什么吗
思考
PART
03
电离与
电离方程式
1、概念:电解质溶于水或受热熔化时,形成自由移
动的离子的过程。
盐酸中HCI完全电离而醋酸只是部分电离,试分
析两种溶液中分别存在哪些粒子
HCI 醋酸
电 离
(CH COOH)
思考
电离
存在粒子
HCl: H+
Cl-
CH COOH:
H+
CH CO0- CH COOH
这种电离过程可以用什么表达
思考
酸的电离方程式: HCl==H++Cl-
碱的电离方程式: NaOH==Na++OH-
盐的电离方程式:BaCO ==Ba++CO -
电离
1、概念:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
2、表示方法——电离方程式:表示电解质电离过程的式子。
难溶盐虽然溶解在
水里的部分很少, 但是是完全电离
电 离 H+
Cl-、NO 、SO4
电离 Na+、K+、Ba +
KOH
OH
电离 Na+ 、NH 、K*
NH Cl
Cl- 、SO
K SO
电离
阳离子全部 是H*
阴离子全部 是OH-
金属阳离子 (铵根离子)、 酸根离子
HCl
HNO
H SO
NaOH
3、从电离角度认识酸、碱、盐
Ba(OH)
NaCl
化合物
碱
酸
盐
(1)强电解质:完全电离,用“==”表示。
如 :H SO 、NaOH、(NH ) SO 的电离方程式分别为 H SO ==2H++SO -
NaOH==Na++OH-
(NH ) SO ==2NH ++SO -
电离方程式的书写
电离方程式的书写
(2)弱电解质,部分电离,用“一”表示。(可逆符号)
①多元弱酸分步电离,电离程度逐步减弱,以第一步电离为主 H S ≥ H++HS- (第一步电离)
HS- H++S - (第二步电离)
②多元弱碱分步电离但一步写出 Cu(OH)2=Cu ++2OH-
③两性氢氧化物双向电离
Al(OH) =Al ++3OH- (碱式电离)
Al(OH) =H++AIO +H O (酸式电离)
强电解质
弱电解质
概念 在水溶液中完全电离的电解质
在水溶液中只能部分电离的电解质
所含物质类型 强酸、强碱、大多数盐
弱酸、弱碱、少数盐、少数氧化物
电离方程式 用“=”表示
用“ ”表示
实例 H SO =2H++SO -
H CO —H++HCO -
电离方程式的书写
(3)酸式盐
①强酸酸式盐完全电离,一步写出。
为什么NaHSO 在两种条件下会有两种电离方式
因为Na+与其他粒子结合的方式是离子键,而H+与其他阴离子的 结合方式是共价键,根据共价键只在水溶液被破坏而熔融下不发 生断裂,离子键在熔融状态和在水溶液中均能被破坏可知,
NaHSO 在两种条件下会有两种电离方式。
同理知所有所有强酸式盐会有两种电离方式。
电离方程式的书写
书写电离方程式时应特别注意:
(1)要正确书写出电离的阳离子、阴离子的符号。注意区分离子符 号和化合价的书写。
(2)含有原子团的物质电离时,原子团应作为一个整体,不能分开
(3)表示离子数目的数字要写在离子符号的前面,不能像在化学式 里那样写在右下角。
(4)在电离方程式中,阴、阳离子所带正、负电荷的总数必须相等
电离方程式的书写
1、下列说法中正确的是( D )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡难溶于水因此硫酸钡属于非电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于电解质
D.硫酸钠在水中的电离方程式可表示为Na SO ==2Na++SO 2-
巩固新知
2、下列物质在水中的电离方程式错误的是( B )
B.NaHCO =Na++H++CO - c.Ca(OH)=Ca2++2OH
D.NaHSO =Na++H++SO-
巩固新知
3、下列各组都为两种化合物溶于水时电离出的离子:
①Na+ 、OH- 、SO -②H+ 、Cl- 、SO},③Na+ 、K+ 、OH-,④Na+ 、K+ 、NO 其中按照仅由酸、碱、盐依次电离的是( A )
A.②③④
B.②①④
C.②③①
D.②①③
巩固新知
巩固新知
4、在氢氧化钡溶液中滴入硫酸并测定溶液导电性,下列为随着硫酸
滴入量的增加溶液导电能力变化的图像,其图像表示正确的是( A
A B C D
n(H SO )
n(H SO )
n(H SO )
n(H SO )
导电性
导电性
导电性
导电性
)
选项 纯净物 混合物 电解质
非电解质
A 冰水混合物 CuSO4.5H O 液态AgCl
蔗糖
B CaO 海水 铜
酒精
C 液氯 铝合金 AgC1
CO
D 氢氧化钠 空气 Na SO
食醋
巩固新知
5、下列表格中各项分类都正确的一组是(C )
6、如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说
法正确的是( c )
A.曲线A表示NaOH 溶液中滴加稀盐酸
B.曲线B表示醋酸溶液中滴加KOH 溶液
C.曲线C表示氢氧化钡溶液中滴加硫酸
D.曲线D表示Cu(OH) 悬浊液中
滴加稀硝酸
巩固新知
PART
04
电解质的 应用
一、电解质饮品
电解质饮料是用水将一组化合物溶解制成的饮料,包括钠离子、钾离子、镁离 子、氯离子、硫酸根离子、磷酸根离子、柠檬酸盐、蔗糖、葡萄糖、维生素C 及维生素B6。电解质饮料可补充人体新陈代谢的消耗,迅速补充人体水分的消 耗,解除疲劳。电解质水是添加了体液中的无机盐、蛋白质等以离子形态存在 的物质的饮品,成分与汗水相似。
电解质的应用
一、电池中物质交换的载体
电解质是电解池的核心物质之一,能提高移动阳极和阴极之间的离子流动性, 起着媒质作用的物质。电解质作为原电池的重要组成部分,在正、负极之间起 着输送离子传导电流的作用,选择合适的电解质也是获得高能量密度和功率密 度、长循环寿命和安全性能良好的锂离子二次电池的关键。
电解质的应用
负极材
正极材料
十
一、在工业生产中
1、絮凝剂(聚沉作用)
高分子电解质具有絮凝作用,是有效的高分子絮凝剂,其带电部位能中和胶体 粒子电荷,破坏胶体粒子在水中稳定性,促使其碰撞,通过高分子长链架桥把 许多细小颗粒缠结在一起,聚集成大粒子,从而加速沉降。其絮凝和沉降速度 快、污泥脱水效率高,对某些废水的处理有特效。高分子电解质的絮凝能力, 比无机絮凝剂如明矾、氯化铁等大数倍至数十倍,而且具有许多无机絮凝剂所 没有的独特性能。
电解质的应用
一、在工业生产中
2、在造纸工业的应用
随着合成高分子工业的发展,高分子电解质作为造纸助剂在造纸工业中的应用 日益广泛,并发挥重要作用。例如,季镂化聚丙烯酰胺、阳离子淀粉、聚乙烯 亚胺等可用作干湿增强剂,以提高纸张的干湿强度;羧甲基纤维素、阳离子淀 粉是纸张表面的施胶剂,同时亦可增加填料及增白剂的留着率;阳离子聚丙烯 酰胺可絮凝沉降水中悬浮的微细纤维,具有絮凝捕集作用,以达到回收纸机排 放水中流失的纤维素和填料及澄清水的目的。
3、在石油工业的应用
用做黏土稳定剂、压裂添加剂的聚合物、缓蚀剂等等。
电解质的应用
归纳总结
既不是电解质
又不是非电解质
非电解质 共价化合物
弱电解质 离子化合物
共价化合物
全体物质
化合物
市解质
电解质概念
关系图
强电解质
归纳总结
书写电离方程式时应特别注意:
(1)要正确书写出电离的阳离子、阴离子的符号。注意区分离子符 号和化合价的书写。
(2)含有原子团的物质电离时,原子团应作为一个整体,不能分开
(3)表示离子数目的数字要写在离子符号的前面,不能像在化学式 里那样写在右下角。
(4)在电离方程式中,阴、阳离子所带正、负电荷的总数必须相等
THANK YOU
THIS POWERPOINT DESIGNED BY CREATIVITY
第一章第二节
离子反应
1.2.1电解质的电离
高一必修一
课堂目标
1、通过概念建立过程,并运用比较、分类、归纳、 概括等方法对信息进行加工从而理解电离、电解质、 非电解质的含义。
2、掌握书写电离方程式的一般方法及其正误判断。
3、学会举一反三,利用概念区分物质的归属问题。
目录
01 物质的导电性
02 电解质与非电解质
03 电离与电离方程式
04 电解质的应用
PART
01
物质的导电性
生活中的导电物质
生活经验告诉我们,充电线它是由几根导线和绝缘的外壳组成的。
这些导线是铜线,而绝缘的外壳是热塑性塑料,同学们知道为什 么导线能够导电而绝缘外壳不导电吗
除了金属可以导电以外,同学们还能知道哪些物质可以导电呢
让我们带着这个问题来学习接下来新的知识
电,而塑料等绝缘体无法导电。
思考
思考
Closed Circuit
样品 NaCI固体 KNO 固体 蒸馏水 NaCl溶液 KNO 溶液
熔融的 NaCI固体
现象 灯泡不亮 灯泡不亮 灯泡不亮 灯泡亮 灯泡亮
灯泡亮
结论 不导电 不导电 不导电 导电 导电
导电
物质的导电性
为什么溶液和熔融状态下的物质能够导电,而固态状态
下不能导电呢
实验现象与结论
思考
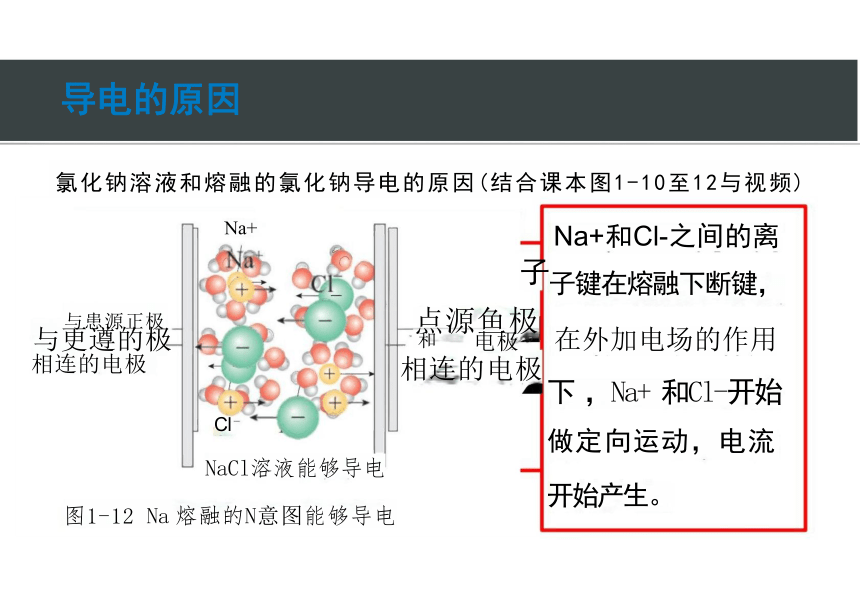
氯化钠溶液和熔融的氯化钠导电的原因(结合课本图1-10至12与视频)
Na+ Na+和Cl-之间的离
子子键在熔融下断键,
与患源正极 点源鱼极
下 ,Na+ 和Cl-开始
做定向运动,电流
NaCl溶液能够导电
图1-12 Na 熔融的N意图能够导电
导电的原因
与更遵的极 和 电极 在外加电场的作用
相连的电极 相连的电极
Cl
开始产生。
导电的原因
除了固体的化合物无法导电外,部分有机化合物如蔗糖、乙醇等
在任何状态下也无法导电,同学们可以用刚刚的知识来解释吗
同学们能否用之前学习分类的方法再将这些物质进行
导电性分类呢
些无法导电的物质我们称之为绝缘体。
思考
思考
物质的导电性分类
离子化合物由阳离子和阴
根据前面的内容我们将物质的导电性分类如下 离子组成的化合物,共价 化合物是原子间以共用电 子对所组成的化合物分子。
本身可以导电 金属单质、
碳、硅等
本身不导电,但在水溶液 酸碱盐 或熔融状态下导电 金属氧化物
只在水中
导电
在水溶液中 和熔融状态 下都能导电
本身不导电,任何状态下
都不导电
共价 化合物
离子 化合物
共价键 离 子 键
物质的导电性
蔗糖 乙醇
PART
02
电解质与 非电解质
电解质中含有共价化合物和离子化合物。
其中共价化合物只能在水溶液中才能导电, 离子化合物两种状态下均能导电,因此只 要满足一种情况即可
电解质与非电解质
非电解质 在水溶液里和熔融状态 下均不能导电的化合物
归属于既不是
电解质也不是
满悲房解愿兄
在水溶液或熔融
状态下能否导电
不导电
化合物分类如下
能导电
一般地,同一物质
共价键>离子键
化 合 物
电解质 非电解质 相同点 均为化合物 在水溶液里或熔融状态下能 在水溶液中和熔融状态下不 哪些物质属于电解质,哪些又属于非电解质呢
本质区别 在水溶液里或熔融状态下自 身能发生电离 在水溶液里和熔融状态下自 身不能发生电离 在水溶液里或熔 融状态下的存在 形式 离子(离子或分子) 分子
电 解 质 与 非 电 解 质
强电解质
在水溶液里或熔融状态
下完全电离的电解质
弱电解质
在水溶液里或熔融状态
下部分电离的电解质
电解质与非电解质
根据强弱电解质
的概念,同学们
能找出哪些物质
属于强电解质,
哪些又属于弱电
解质吗
在水溶液或熔融
状态的电离程度
部分电离
电解质分类如下
完全电离
电解质
强碱 NaOH、KOH 等四大强碱
绝大多数盐 NaCl、KNO 、Cad
弱酸 CH COOH等
弱碱 NH ·H O 、Fe(OH) 等
水
电解质与非电解质
氨水:混合物
—水合氨:纯净物
举例
CuSO 溶液混合物
CuSO ·5H O 是纯净物
强电解质 弱电解质
电解质
强酸 H SO 、HCI 、HNO 等六大强酸
强弱电解质分类如下
1、导电的物质一定是电解质 电解质一定能导电 不能导电的 物质一定是非电解质
导电的物质不一定是电解质,例如:金属单质和混合物属于既 不是电解质也不属于非电解质等等;电解质不一定能导电,例 如:固体氯化钠等等;不能导电的物质不一定是非电解质,
例如:单质,混合物不管在水溶液中或熔融状态下是否能够导 电 ,既不是电解质也不属于非电解质。
概念辨析
2、非电解质一定是共价化合物 共价化合物一定是非电解质
非电解质可分为共价价化合物中的非金属氧化物、非酸性气态 氢、部分有机化合物,因此非电解质一定是共价化合物。
但电解质中含有共价化合物和离子化合物,因此共价化合物不 一定是非电解质。
概念辨析
2、SO 、CO 、NH 溶于水之后可以导电,属于电解质
SO 、CO 、NH 不属于电解质,SO 、CO 、NH 溶于水之后, 其导电的离子分别为H SO 、H CO 、NH ·H O, 而不是SO 、 CO 、NH , 因此它们不属于电解质。
电解质溶液能导电是由于电解质本身能电离出自由移动的离子 所有非金属氧化物均为非电解质
概念辨析
2、某物质属于电解质,其水溶液也属于电解质
错。一个物质属于电解质,意味着它是化合物,是纯净物。而 它的水溶液属于混合物,属于既不是电解质也不是非电解质。
概念辨析
2、电离程度=导电能力
错。完全电离指在水溶液或熔融状态下分子完全电离成离子。 部分电离指在水溶液或熔融状态下只有部分分子电离成离子 导电能力与溶液中离子浓度及离子所带电荷数多少有关,而与 电离程度以及溶解度无关。
如BaCO3 是难溶物,但溶解在水里的部分完全电离,因此属于 强电解质,但是溶解在水中的离子浓度很少,导电能力弱。
概念辨析
2、难溶物属于电解质还是属于非电解质
难溶物有弱碱,盐,金属氧化物,属于离子化合物
难溶物虽然难溶于水,但溶解在水中的分子能完全分开形成离 子,并且难溶物属于离子化合物,因此在水溶液和熔融状态下 均能导电,属于电解质
概念辨析
因为湿手表面为水,而水为电解质溶液,电解质溶液为第二类导体。所
以更容易导电。其实纯水的导电能力很弱,但是我们日常生活中的水含 有杂质离子,杂质离子溶于水中形成形成了电解质溶液,通过电解质溶 液那么电流就更容易进行传导,从而更容易产生触电的事故。
所以在日常的生活中我们如果手上有水的情况下不能直接去接触通电的 设备,这样才能避免触电事故的发生。
生活中的触电现象
生活中有许多危险警示,其中有一种是禁止湿手触摸电
器,同学们知道这是为什么吗
思考
PART
03
电离与
电离方程式
1、概念:电解质溶于水或受热熔化时,形成自由移
动的离子的过程。
盐酸中HCI完全电离而醋酸只是部分电离,试分
析两种溶液中分别存在哪些粒子
HCI 醋酸
电 离
(CH COOH)
思考
电离
存在粒子
HCl: H+
Cl-
CH COOH:
H+
CH CO0- CH COOH
这种电离过程可以用什么表达
思考
酸的电离方程式: HCl==H++Cl-
碱的电离方程式: NaOH==Na++OH-
盐的电离方程式:BaCO ==Ba++CO -
电离
1、概念:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
2、表示方法——电离方程式:表示电解质电离过程的式子。
难溶盐虽然溶解在
水里的部分很少, 但是是完全电离
电 离 H+
Cl-、NO 、SO4
电离 Na+、K+、Ba +
KOH
OH
电离 Na+ 、NH 、K*
NH Cl
Cl- 、SO
K SO
电离
阳离子全部 是H*
阴离子全部 是OH-
金属阳离子 (铵根离子)、 酸根离子
HCl
HNO
H SO
NaOH
3、从电离角度认识酸、碱、盐
Ba(OH)
NaCl
化合物
碱
酸
盐
(1)强电解质:完全电离,用“==”表示。
如 :H SO 、NaOH、(NH ) SO 的电离方程式分别为 H SO ==2H++SO -
NaOH==Na++OH-
(NH ) SO ==2NH ++SO -
电离方程式的书写
电离方程式的书写
(2)弱电解质,部分电离,用“一”表示。(可逆符号)
①多元弱酸分步电离,电离程度逐步减弱,以第一步电离为主 H S ≥ H++HS- (第一步电离)
HS- H++S - (第二步电离)
②多元弱碱分步电离但一步写出 Cu(OH)2=Cu ++2OH-
③两性氢氧化物双向电离
Al(OH) =Al ++3OH- (碱式电离)
Al(OH) =H++AIO +H O (酸式电离)
强电解质
弱电解质
概念 在水溶液中完全电离的电解质
在水溶液中只能部分电离的电解质
所含物质类型 强酸、强碱、大多数盐
弱酸、弱碱、少数盐、少数氧化物
电离方程式 用“=”表示
用“ ”表示
实例 H SO =2H++SO -
H CO —H++HCO -
电离方程式的书写
(3)酸式盐
①强酸酸式盐完全电离,一步写出。
为什么NaHSO 在两种条件下会有两种电离方式
因为Na+与其他粒子结合的方式是离子键,而H+与其他阴离子的 结合方式是共价键,根据共价键只在水溶液被破坏而熔融下不发 生断裂,离子键在熔融状态和在水溶液中均能被破坏可知,
NaHSO 在两种条件下会有两种电离方式。
同理知所有所有强酸式盐会有两种电离方式。
电离方程式的书写
书写电离方程式时应特别注意:
(1)要正确书写出电离的阳离子、阴离子的符号。注意区分离子符 号和化合价的书写。
(2)含有原子团的物质电离时,原子团应作为一个整体,不能分开
(3)表示离子数目的数字要写在离子符号的前面,不能像在化学式 里那样写在右下角。
(4)在电离方程式中,阴、阳离子所带正、负电荷的总数必须相等
电离方程式的书写
1、下列说法中正确的是( D )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡难溶于水因此硫酸钡属于非电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于电解质
D.硫酸钠在水中的电离方程式可表示为Na SO ==2Na++SO 2-
巩固新知
2、下列物质在水中的电离方程式错误的是( B )
B.NaHCO =Na++H++CO - c.Ca(OH)=Ca2++2OH
D.NaHSO =Na++H++SO-
巩固新知
3、下列各组都为两种化合物溶于水时电离出的离子:
①Na+ 、OH- 、SO -②H+ 、Cl- 、SO},③Na+ 、K+ 、OH-,④Na+ 、K+ 、NO 其中按照仅由酸、碱、盐依次电离的是( A )
A.②③④
B.②①④
C.②③①
D.②①③
巩固新知
巩固新知
4、在氢氧化钡溶液中滴入硫酸并测定溶液导电性,下列为随着硫酸
滴入量的增加溶液导电能力变化的图像,其图像表示正确的是( A
A B C D
n(H SO )
n(H SO )
n(H SO )
n(H SO )
导电性
导电性
导电性
导电性
)
选项 纯净物 混合物 电解质
非电解质
A 冰水混合物 CuSO4.5H O 液态AgCl
蔗糖
B CaO 海水 铜
酒精
C 液氯 铝合金 AgC1
CO
D 氢氧化钠 空气 Na SO
食醋
巩固新知
5、下列表格中各项分类都正确的一组是(C )
6、如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说
法正确的是( c )
A.曲线A表示NaOH 溶液中滴加稀盐酸
B.曲线B表示醋酸溶液中滴加KOH 溶液
C.曲线C表示氢氧化钡溶液中滴加硫酸
D.曲线D表示Cu(OH) 悬浊液中
滴加稀硝酸
巩固新知
PART
04
电解质的 应用
一、电解质饮品
电解质饮料是用水将一组化合物溶解制成的饮料,包括钠离子、钾离子、镁离 子、氯离子、硫酸根离子、磷酸根离子、柠檬酸盐、蔗糖、葡萄糖、维生素C 及维生素B6。电解质饮料可补充人体新陈代谢的消耗,迅速补充人体水分的消 耗,解除疲劳。电解质水是添加了体液中的无机盐、蛋白质等以离子形态存在 的物质的饮品,成分与汗水相似。
电解质的应用
一、电池中物质交换的载体
电解质是电解池的核心物质之一,能提高移动阳极和阴极之间的离子流动性, 起着媒质作用的物质。电解质作为原电池的重要组成部分,在正、负极之间起 着输送离子传导电流的作用,选择合适的电解质也是获得高能量密度和功率密 度、长循环寿命和安全性能良好的锂离子二次电池的关键。
电解质的应用
负极材
正极材料
十
一、在工业生产中
1、絮凝剂(聚沉作用)
高分子电解质具有絮凝作用,是有效的高分子絮凝剂,其带电部位能中和胶体 粒子电荷,破坏胶体粒子在水中稳定性,促使其碰撞,通过高分子长链架桥把 许多细小颗粒缠结在一起,聚集成大粒子,从而加速沉降。其絮凝和沉降速度 快、污泥脱水效率高,对某些废水的处理有特效。高分子电解质的絮凝能力, 比无机絮凝剂如明矾、氯化铁等大数倍至数十倍,而且具有许多无机絮凝剂所 没有的独特性能。
电解质的应用
一、在工业生产中
2、在造纸工业的应用
随着合成高分子工业的发展,高分子电解质作为造纸助剂在造纸工业中的应用 日益广泛,并发挥重要作用。例如,季镂化聚丙烯酰胺、阳离子淀粉、聚乙烯 亚胺等可用作干湿增强剂,以提高纸张的干湿强度;羧甲基纤维素、阳离子淀 粉是纸张表面的施胶剂,同时亦可增加填料及增白剂的留着率;阳离子聚丙烯 酰胺可絮凝沉降水中悬浮的微细纤维,具有絮凝捕集作用,以达到回收纸机排 放水中流失的纤维素和填料及澄清水的目的。
3、在石油工业的应用
用做黏土稳定剂、压裂添加剂的聚合物、缓蚀剂等等。
电解质的应用
归纳总结
既不是电解质
又不是非电解质
非电解质 共价化合物
弱电解质 离子化合物
共价化合物
全体物质
化合物
市解质
电解质概念
关系图
强电解质
归纳总结
书写电离方程式时应特别注意:
(1)要正确书写出电离的阳离子、阴离子的符号。注意区分离子符 号和化合价的书写。
(2)含有原子团的物质电离时,原子团应作为一个整体,不能分开
(3)表示离子数目的数字要写在离子符号的前面,不能像在化学式 里那样写在右下角。
(4)在电离方程式中,阴、阳离子所带正、负电荷的总数必须相等
THANK YOU
THIS POWERPOINT DESIGNED BY CREATIVITY
