化学电源 高二上学期化学人教版(2019)选择性必修1(共32张PPT)
文档属性
| 名称 | 化学电源 高二上学期化学人教版(2019)选择性必修1(共32张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 11:52:14 | ||
图片预览









文档简介
(共32张PPT)
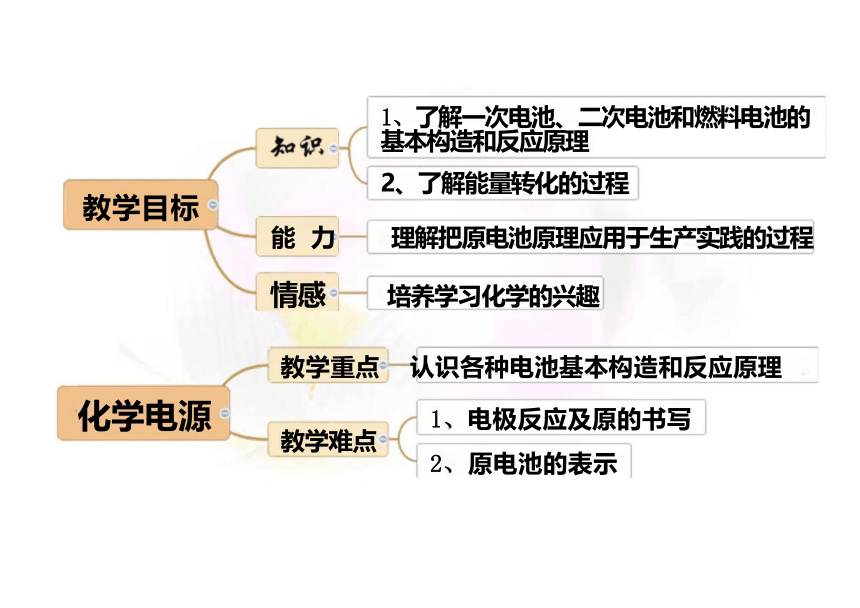
化 学 电 源
1、了解一次电池、二次电池和燃料电池的 基本构造和反应原理
2、了解能量转化的过程
能 力 理解把原电池原理应用于生产实践的过程
情感 培养学习化学的兴趣
教学重点 认识各种电池基本构造和反应原理
1、电极反应及原的书写
教学难点
2、原电池的表示
教学目标
化学电源
是哪一类呢 哪种更好
一、电源分类与判断
1、电源优劣判断
输出电能与电池质量或体积之比
输出功率与电池质量或体积之比
比电能
比功率
蓄电时间
判断电池优劣
不可充电电池如:干电池
充电电池(蓄电池)
举例
化学电池
太阳能电池
原子能电池
一次电池
二次电池
燃料电池
举例
2、电池分类
电池
举例
二、化学电池
( 一)干电池-- — 次电池
1、普通锌锰电池
总:2MnO +2NH Cl+Zn=ZnCl +2NH 个+H 个
负 :Zn—2e-=Zn2+
正:2MnO +2NH +2e==Mn O +2NH 个+H O
碳 棒
MnO 糊
NH Cl 糊
锌简
优点:制作简单、价格便宜
缺点:使用寿命短、易泄露
2、碱性锰电池 (KOH)
总:Zn+2MnO +2H O=2MnOOH+Zn(OH) 负 Zn+2OH--2e-=Zn(OH)
正 MnO +2H O+2e=2MnOOH+2OH-
优点:能量储存时间有所提高,不易泄露
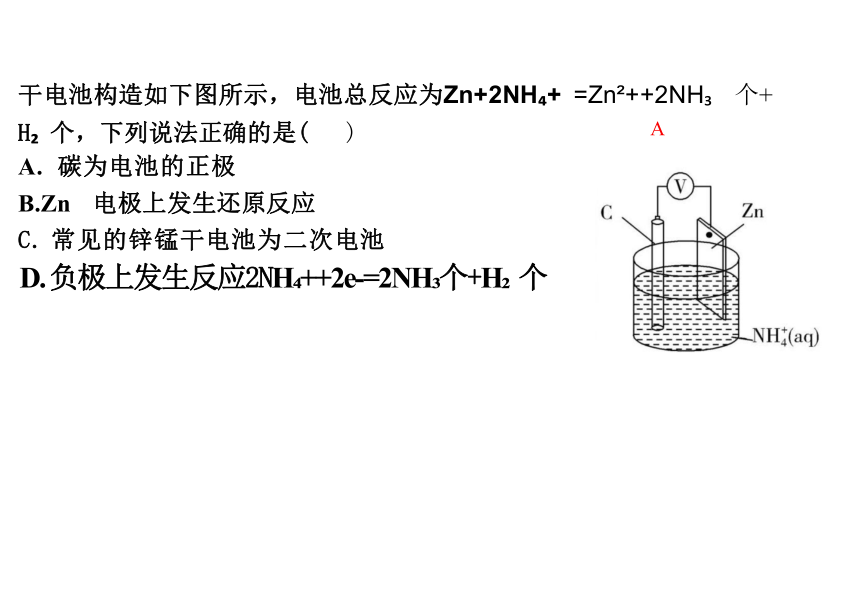
H 个,下列说法正确的是( )
A. 碳为电池的正极
B.Zn 电极上发生还原反应
C. 常见的锌锰干电池为二次电池
D. 负极上发生反应2NH ++2e-=2NH 个+H 个
干电池构造如下图所示,电池总反应为Zn+2NH + =Zn ++2NH 个+
A
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱
性电池以KOH溶液为电解液,电池总反应为
Zn+2MnO +2H O=Zn(OH) +2MnO(OH),
下列说法不正确的是( C )
A. 电池工作时,锌为负极
B. 电池的正极反应为2MnO +2H O+2e-=2MnO(OH)+2OH-
C. 电池工作时,电解液中的OH 一移向正极
D. 外电路中每通过0.2 mol 电子,锌的质量理论上减小6.5 g
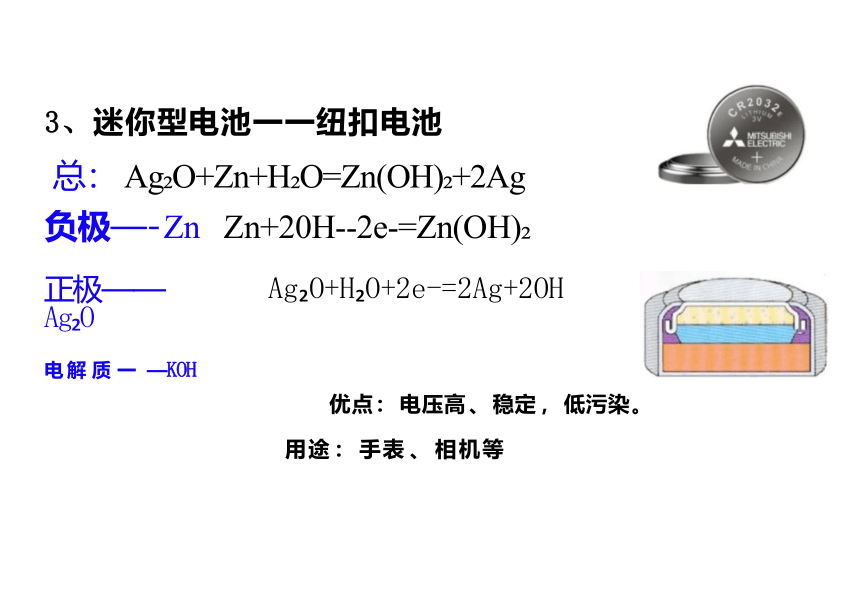
3、迷你型电池一一纽扣电池
总: Ag O+Zn+H O=Zn(OH) +2Ag 负极—- Zn Zn+20H--2e-=Zn(OH)
优点 : 电压高 、 稳定 , 低污染 。
用途 : 手表 、 相机等
正极——Ag O
电 解 质 一 —KOH
Ag O+H O+2e-=2Ag+2OH
原电池电极反应式的书写步骤:
判断电解液酸碱性→标出变价元素的化合价→根据化合价升降确定正负极
正极=总-负极一书写负极
注意:
(1) 负氧正还
(2 )要注意溶液的酸碱性,适当的在电极方程式两边添加
H+ 、OH一、H O , 以遵循电荷守恒和质量守恒。
(3)要注意电极反应产物是否与电解质溶液发生反应。
(二)二次电池
二次电池又叫充电电池(蓄电池),可逆、循环
化学能
→电能
放电
充电
电 能 →
化学能
负 极 —Pb Pb-2e-+SO 2-=PbSO J 氧化反应
正极—PbO PbO +4H++SO 2-+2e==PbSO J+2H O还原反应 阴极(接电源负极) PbSO (s)+2e-=Pb(s)+SO 2- 还原反应
阳极(接电源正极)PbSO (s)+2H O -2e =PbO (s)+4H++SO 2-氧化反应
1、铅 蓄 电 池
PbO +Pb+H SO 放电 2PbSO +2H O 电 解 质 —H SO 溶 液
放电 充电
放电 充电 负极:Zn-2e-+2OH-
=Zn(OH)
正 极 :Ag O+2e
+H O=2Ag+2OH-
阴极 Zn(OH) +2e==Zn+2OH-
阳极 2Ag-2e-+2OH-
=Ag O+H O
2、银锌蓄电池
正极一Ag O 和石墨,负极一锌汞合金,电解质KOH 溶液
广泛用作各种电子仪器
负 极 Cd-2e-+2OH-=Cd(OH)
正 极 2NiO(OH)+2e+2H O=2Ni(OH) +2OH-
阴 极 Cd(OH) +2e==Cd+2OH
阳极 2 Ni(OH) -2e-+2OH -=2NiO(OH)+2H O
3、镉镍电池 电解质:KOH 溶液
放电 充电
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni O +3H O=Fe(OH) +2Ni(OH)
下列有关该电池的说法不正确的是( C )
A.电池的电解液为碱性溶液,正极为Ni O 、负极为Fe B. 电池放电时,负极反应为Fe+2OH--2e==Fe(OH)
C.电池充电过程中,阴极附近溶液的pH 降低
D. 电池充电时,阳极反应为2Ni(OH) +2OH-2e==Ni O +3H O
Li-SOCl 电池可用于心脏起搏器。该电池的电极
材料分别为锂和碳,电解液是LiAICl -SOCl 。电池的总反应 可表示为:4Li+2SOCl =4LiCl+S+SO 。
请回答下列问题:
(1)电池的负极材料为 Li , 发生的电极反应为 Li-e-=Li+
(2)电池正极发生的电极反应为 2SOCl +4e=4Cl-+S+SO
(3)组装该电池必须在无水、无氧的条件下进行,原因是
Li 与水和氧气反应
(三)燃料电池
①原理:将燃料和氧化剂(如:O )反应所放出的化学能转化为电能。 ②反应物不储存在电池内部,外加提供燃料和氧化剂。
③两极材料:惰性材料,只具导电性。
④两极判断:负极:通入燃料气的一极
正极:通入O 或空气的一极
⑤导电介质:可以是电解质溶液,也可以是新型的导离子介质。
⑥高效、环境友好。
其应槽
1、氢氧燃料电池
(1)酸性氢氧燃料电池:
(-)Pt(H )|H SO IPt(O )(+)
燃料电池电极反应式的写法:总→正→负
总:2H +O =2H O
正:O +4e-+4H+=2H O
负 : 2H -4e-=4H+
溶液中不存在0 -,在酸性溶液中它与H+结合成H 0,在碱性或中性溶 液中它与水结合成OH-。
氢气
入口 H*-
*H →
氧气 入口
o
负 极 H SO
(Pt)
A 2e
正极 (Pt)
电解液H O
OH
-OH
H O
2e-
(2)碱性(中性)氢氧燃料电池
(-)Ni (多孔) |KOH(溶液) NiO (+)
总:2H +O =2H O
正 :O +2H O+4e-=40H-
负: 2 H +4OH--4e =4H O
O (空气)
正极
电解质
H O
H
负极
H O+
H
KOH
(12 · 四川)一种基于酸性燃料电池原理设计的酒精检测仪,
负极上的反应为CH CH OH 一4e-+H O=CH COOH+4H+ 。 下 列
有关说法正确的是( C )
A.检测时,电解质溶液中的H+ 向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:CH CH OH+O =CH COOH +H O
D.正极上发生的反应是:O +4e-+2H O=4OH-
(3)甲烷燃料电池:
①酸性介质:
总:CH +20 =CO +2H O
正:20 +8e-+8H+=4H O
负:CH -8e"+2H O=8H++CO
②碱性介质:
总:CH +2O +2OH-=CO -+3H O
正:20 +8e-+4H O=80H-
a b
H20
CH4
H SO 或 KOH 溶液
负:CH +100H--8e==CO -+7H O
+4价的C在酸性溶液中以CO 形式存在,在碱性溶液中以CO 2-形式存在
02
(4)熔融碳酸盐介质:
总 :O +H +CO=H O+CO
正:O +2CO +4e-=2CO 2-
负:H +CO+2CO 2-4e=H O+3CO
电极B
O
CO
用电器一
CO3-
K+
Na+
CO +H O
脱水=
催化重整
CH +H 0
CO+H 一
电 极A
A.反应CH +H O=H +CO每消耗1molCH
转移12mol电子
B.电极A上H 参与的电极反应为:H +2OH--2e =2H O
C.电池工作时,CO 2-向电极B移动
(15 ·江苏)一种熔融碳酸盐燃料电池原理示意如图。下列有关该
D.电极B上发生的电极反应为:O +2CO +4er=2CO 2-
电池的说法正确的是 (D)
CO3-
K+
Na+
)脱水=
0
CO
用电器
CO +H 0
CH +H 0
催化重整
电 极A
H H O
(5)能传导O -的固体介质:
总:2H +O =2H O
正:O +4er=2O -
负:2H -4e=4H+
1/2O (干燥)
2e-
O -
2e
多孔电极a
固体电解质 多孔电极b
2e
总反应离子方程式
O +4H++4e=
2H O
O +2H O+4e-=
4OH-
O +4e-=
O +2CO +4e-=
2CO 2-
正极(还原)+负极(氧化)=总反应
酸性电解质
碱性(中性)
固体电解质
熔融碳酸盐
小结:燃料电池电极反应的写法
燃料电池
正极反应
步骤
方法
202-
(17 ·全国3)全固态锂硫电池能量密度高、成本低,
其工作原理如图所示,其中电极a常用掺有石墨烯的Sg材料,
电池反应为:16Li+xSg=8Li Sx(2≤x≤8)。下 列说法错误的是( D )
A. 电池工作时,正极可发生反应:
2Li S +2Li++2e-=3Li S 电极a 用电器 电极b
B. 电池工作时,外电路中流过0.02mol电子,
负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li S 的量越多
Li+
Li+
电解质
金属锂
2、燃料电池结构特征及应用
正极一助燃剂(氧气)
负极一燃料 (H CO CH C H C H OH等)
电极材料 — —般不参加反应,传导电子 原料不断补充、 产物不断排出
优点:能量转化率高,可持续使用,对环境友好 用途:宇宙飞船,应用前景广阔
组成 负极 正极
电解质
电极材料 能 导 电 的 物 质
酸、碱、 盐溶液
或熔融
液
电极反应 还 原 性 较 强 的 物 质 ( 大 多 是 金 属 电 极 本 身 ) 氧 化 性 较 强 的物质 电子流向 流出电子 流入电子 反应类型 氧化反应 还原反应
化学电池的组成(小结)
迷你型纽扣电池
微型燃料电池
普通干电池
汽车铅蓄电池
种大太阳能电池
手机专用电池
笔记本专用电地 摄像机专用电池
三、电池运用与环境保护
1、电视运用
含汞、铅、镉
等重金属阳离子 污染水体和土壤
回收利用
节 约 资 源 保 护 环 境
治理电池污染
刻不容缓
2、环境保护
判断分类
运用环保
迷你型纽扣电池
锂电池
铅蓄电池
银锌电池
镉镍电池
一次电池
二次电池
燃料电池
普通锰电池
碱性锰电池
课 堂 回 顾
干电池
化 学 电 源
1、了解一次电池、二次电池和燃料电池的 基本构造和反应原理
2、了解能量转化的过程
能 力 理解把原电池原理应用于生产实践的过程
情感 培养学习化学的兴趣
教学重点 认识各种电池基本构造和反应原理
1、电极反应及原的书写
教学难点
2、原电池的表示
教学目标
化学电源
是哪一类呢 哪种更好
一、电源分类与判断
1、电源优劣判断
输出电能与电池质量或体积之比
输出功率与电池质量或体积之比
比电能
比功率
蓄电时间
判断电池优劣
不可充电电池如:干电池
充电电池(蓄电池)
举例
化学电池
太阳能电池
原子能电池
一次电池
二次电池
燃料电池
举例
2、电池分类
电池
举例
二、化学电池
( 一)干电池-- — 次电池
1、普通锌锰电池
总:2MnO +2NH Cl+Zn=ZnCl +2NH 个+H 个
负 :Zn—2e-=Zn2+
正:2MnO +2NH +2e==Mn O +2NH 个+H O
碳 棒
MnO 糊
NH Cl 糊
锌简
优点:制作简单、价格便宜
缺点:使用寿命短、易泄露
2、碱性锰电池 (KOH)
总:Zn+2MnO +2H O=2MnOOH+Zn(OH) 负 Zn+2OH--2e-=Zn(OH)
正 MnO +2H O+2e=2MnOOH+2OH-
优点:能量储存时间有所提高,不易泄露
H 个,下列说法正确的是( )
A. 碳为电池的正极
B.Zn 电极上发生还原反应
C. 常见的锌锰干电池为二次电池
D. 负极上发生反应2NH ++2e-=2NH 个+H 个
干电池构造如下图所示,电池总反应为Zn+2NH + =Zn ++2NH 个+
A
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱
性电池以KOH溶液为电解液,电池总反应为
Zn+2MnO +2H O=Zn(OH) +2MnO(OH),
下列说法不正确的是( C )
A. 电池工作时,锌为负极
B. 电池的正极反应为2MnO +2H O+2e-=2MnO(OH)+2OH-
C. 电池工作时,电解液中的OH 一移向正极
D. 外电路中每通过0.2 mol 电子,锌的质量理论上减小6.5 g
3、迷你型电池一一纽扣电池
总: Ag O+Zn+H O=Zn(OH) +2Ag 负极—- Zn Zn+20H--2e-=Zn(OH)
优点 : 电压高 、 稳定 , 低污染 。
用途 : 手表 、 相机等
正极——Ag O
电 解 质 一 —KOH
Ag O+H O+2e-=2Ag+2OH
原电池电极反应式的书写步骤:
判断电解液酸碱性→标出变价元素的化合价→根据化合价升降确定正负极
正极=总-负极一书写负极
注意:
(1) 负氧正还
(2 )要注意溶液的酸碱性,适当的在电极方程式两边添加
H+ 、OH一、H O , 以遵循电荷守恒和质量守恒。
(3)要注意电极反应产物是否与电解质溶液发生反应。
(二)二次电池
二次电池又叫充电电池(蓄电池),可逆、循环
化学能
→电能
放电
充电
电 能 →
化学能
负 极 —Pb Pb-2e-+SO 2-=PbSO J 氧化反应
正极—PbO PbO +4H++SO 2-+2e==PbSO J+2H O还原反应 阴极(接电源负极) PbSO (s)+2e-=Pb(s)+SO 2- 还原反应
阳极(接电源正极)PbSO (s)+2H O -2e =PbO (s)+4H++SO 2-氧化反应
1、铅 蓄 电 池
PbO +Pb+H SO 放电 2PbSO +2H O 电 解 质 —H SO 溶 液
放电 充电
放电 充电 负极:Zn-2e-+2OH-
=Zn(OH)
正 极 :Ag O+2e
+H O=2Ag+2OH-
阴极 Zn(OH) +2e==Zn+2OH-
阳极 2Ag-2e-+2OH-
=Ag O+H O
2、银锌蓄电池
正极一Ag O 和石墨,负极一锌汞合金,电解质KOH 溶液
广泛用作各种电子仪器
负 极 Cd-2e-+2OH-=Cd(OH)
正 极 2NiO(OH)+2e+2H O=2Ni(OH) +2OH-
阴 极 Cd(OH) +2e==Cd+2OH
阳极 2 Ni(OH) -2e-+2OH -=2NiO(OH)+2H O
3、镉镍电池 电解质:KOH 溶液
放电 充电
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni O +3H O=Fe(OH) +2Ni(OH)
下列有关该电池的说法不正确的是( C )
A.电池的电解液为碱性溶液,正极为Ni O 、负极为Fe B. 电池放电时,负极反应为Fe+2OH--2e==Fe(OH)
C.电池充电过程中,阴极附近溶液的pH 降低
D. 电池充电时,阳极反应为2Ni(OH) +2OH-2e==Ni O +3H O
Li-SOCl 电池可用于心脏起搏器。该电池的电极
材料分别为锂和碳,电解液是LiAICl -SOCl 。电池的总反应 可表示为:4Li+2SOCl =4LiCl+S+SO 。
请回答下列问题:
(1)电池的负极材料为 Li , 发生的电极反应为 Li-e-=Li+
(2)电池正极发生的电极反应为 2SOCl +4e=4Cl-+S+SO
(3)组装该电池必须在无水、无氧的条件下进行,原因是
Li 与水和氧气反应
(三)燃料电池
①原理:将燃料和氧化剂(如:O )反应所放出的化学能转化为电能。 ②反应物不储存在电池内部,外加提供燃料和氧化剂。
③两极材料:惰性材料,只具导电性。
④两极判断:负极:通入燃料气的一极
正极:通入O 或空气的一极
⑤导电介质:可以是电解质溶液,也可以是新型的导离子介质。
⑥高效、环境友好。
其应槽
1、氢氧燃料电池
(1)酸性氢氧燃料电池:
(-)Pt(H )|H SO IPt(O )(+)
燃料电池电极反应式的写法:总→正→负
总:2H +O =2H O
正:O +4e-+4H+=2H O
负 : 2H -4e-=4H+
溶液中不存在0 -,在酸性溶液中它与H+结合成H 0,在碱性或中性溶 液中它与水结合成OH-。
氢气
入口 H*-
*H →
氧气 入口
o
负 极 H SO
(Pt)
A 2e
正极 (Pt)
电解液H O
OH
-OH
H O
2e-
(2)碱性(中性)氢氧燃料电池
(-)Ni (多孔) |KOH(溶液) NiO (+)
总:2H +O =2H O
正 :O +2H O+4e-=40H-
负: 2 H +4OH--4e =4H O
O (空气)
正极
电解质
H O
H
负极
H O+
H
KOH
(12 · 四川)一种基于酸性燃料电池原理设计的酒精检测仪,
负极上的反应为CH CH OH 一4e-+H O=CH COOH+4H+ 。 下 列
有关说法正确的是( C )
A.检测时,电解质溶液中的H+ 向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:CH CH OH+O =CH COOH +H O
D.正极上发生的反应是:O +4e-+2H O=4OH-
(3)甲烷燃料电池:
①酸性介质:
总:CH +20 =CO +2H O
正:20 +8e-+8H+=4H O
负:CH -8e"+2H O=8H++CO
②碱性介质:
总:CH +2O +2OH-=CO -+3H O
正:20 +8e-+4H O=80H-
a b
H20
CH4
H SO 或 KOH 溶液
负:CH +100H--8e==CO -+7H O
+4价的C在酸性溶液中以CO 形式存在,在碱性溶液中以CO 2-形式存在
02
(4)熔融碳酸盐介质:
总 :O +H +CO=H O+CO
正:O +2CO +4e-=2CO 2-
负:H +CO+2CO 2-4e=H O+3CO
电极B
O
CO
用电器一
CO3-
K+
Na+
CO +H O
脱水=
催化重整
CH +H 0
CO+H 一
电 极A
A.反应CH +H O=H +CO每消耗1molCH
转移12mol电子
B.电极A上H 参与的电极反应为:H +2OH--2e =2H O
C.电池工作时,CO 2-向电极B移动
(15 ·江苏)一种熔融碳酸盐燃料电池原理示意如图。下列有关该
D.电极B上发生的电极反应为:O +2CO +4er=2CO 2-
电池的说法正确的是 (D)
CO3-
K+
Na+
)脱水=
0
CO
用电器
CO +H 0
CH +H 0
催化重整
电 极A
H H O
(5)能传导O -的固体介质:
总:2H +O =2H O
正:O +4er=2O -
负:2H -4e=4H+
1/2O (干燥)
2e-
O -
2e
多孔电极a
固体电解质 多孔电极b
2e
总反应离子方程式
O +4H++4e=
2H O
O +2H O+4e-=
4OH-
O +4e-=
O +2CO +4e-=
2CO 2-
正极(还原)+负极(氧化)=总反应
酸性电解质
碱性(中性)
固体电解质
熔融碳酸盐
小结:燃料电池电极反应的写法
燃料电池
正极反应
步骤
方法
202-
(17 ·全国3)全固态锂硫电池能量密度高、成本低,
其工作原理如图所示,其中电极a常用掺有石墨烯的Sg材料,
电池反应为:16Li+xSg=8Li Sx(2≤x≤8)。下 列说法错误的是( D )
A. 电池工作时,正极可发生反应:
2Li S +2Li++2e-=3Li S 电极a 用电器 电极b
B. 电池工作时,外电路中流过0.02mol电子,
负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li S 的量越多
Li+
Li+
电解质
金属锂
2、燃料电池结构特征及应用
正极一助燃剂(氧气)
负极一燃料 (H CO CH C H C H OH等)
电极材料 — —般不参加反应,传导电子 原料不断补充、 产物不断排出
优点:能量转化率高,可持续使用,对环境友好 用途:宇宙飞船,应用前景广阔
组成 负极 正极
电解质
电极材料 能 导 电 的 物 质
酸、碱、 盐溶液
或熔融
液
电极反应 还 原 性 较 强 的 物 质 ( 大 多 是 金 属 电 极 本 身 ) 氧 化 性 较 强 的物质 电子流向 流出电子 流入电子 反应类型 氧化反应 还原反应
化学电池的组成(小结)
迷你型纽扣电池
微型燃料电池
普通干电池
汽车铅蓄电池
种大太阳能电池
手机专用电池
笔记本专用电地 摄像机专用电池
三、电池运用与环境保护
1、电视运用
含汞、铅、镉
等重金属阳离子 污染水体和土壤
回收利用
节 约 资 源 保 护 环 境
治理电池污染
刻不容缓
2、环境保护
判断分类
运用环保
迷你型纽扣电池
锂电池
铅蓄电池
银锌电池
镉镍电池
一次电池
二次电池
燃料电池
普通锰电池
碱性锰电池
课 堂 回 顾
干电池
