化学电源高二上学期化学人教版(2019)选择性必修1(共23张PPT)
文档属性
| 名称 | 化学电源高二上学期化学人教版(2019)选择性必修1(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 733.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 11:53:09 | ||
图片预览







文档简介
(共23张PPT)
化学电源
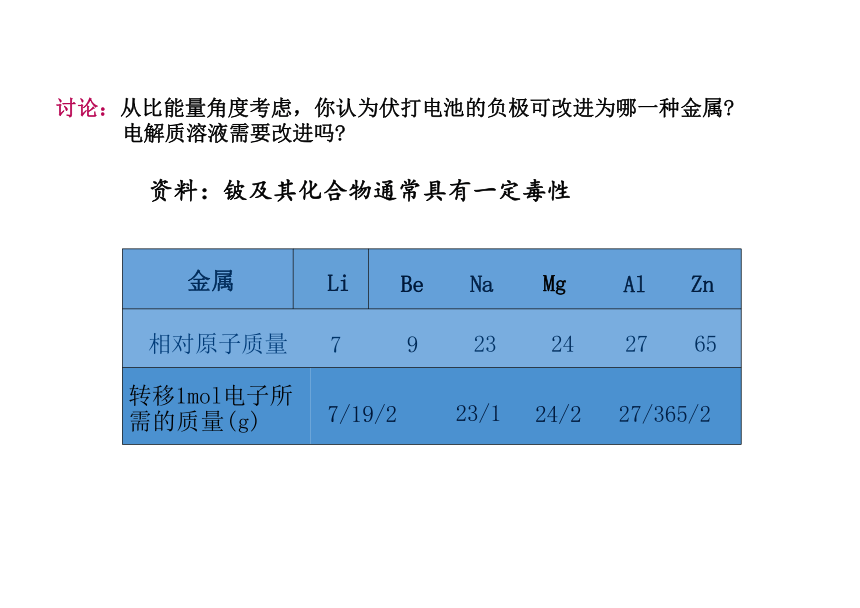
金属 Li
Be Na Mg Al Zn
相对原子质量 7 9 23 24 27 65 转移1mol电子所 需的质量(g) 7/19/2 23/1 24/2 27/365/2
讨论:从比能量角度考虑,你认为伏打电池的负极可改进为哪一种金属 电解质溶液需要改进吗
资料:铍及其化合物通常具有一定毒性
锂二氧化锰电池采用金属锂为负极,适当热处理的电解二氧化锰为正极以及由高氯酸锂(或三氟甲基磺酸锂)溶解于碳酸丙
烯酯乙二醇二甲醚等混合溶剂组成的电解质。其放电机理与一般电池的氧化还原机理有所不同,正极反应是一种典型的嵌入式反 应。电池的化学反应式如下:
总反应MnO +xLi =LizMnO
负极 xLi-xe-=xLi+
正极MnO +xLi++xe-=LizMnO
锂二氧化锰电池
进入词条
锂二氧化锰电池
④ 上传视频
编辑 ■ 讨 论
6 语 音
3、锂 电 池 特点:①“绿色”;②容量大;③电解液中不能有水
讨论1:Li—SOCI 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳, 电解液是LiAICI 一SOCl 。
电池的总反应可表示为8Li+3SOCl ===6LiCl+Li SO +2S。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为______;
(3)组装该电池必须在无水、无氧的条件下进行,原因是 o
资 料 :TiS 是一种微观上具有层状结构的固
体材料。放、充电时,Ti 元素的化合价发 生变化,层状结构所带电荷量发生改变,
锂离子会因此从其中嵌入或脱出。
放电总反应:xLi+TiS =Li.TiS
负极:x Li-x e-=x Li+
正极:TiS +x Li++x e~=Li TiS
Stanley Whittingham在1976年提出了第一个嵌入脱出型的正极材料TiS
伏打电堆—→一次锂金属电池 一 二次锂金属电池
固体TiS
含Li+的
电解质溶液
:: +-
e
Li
—— TiS
隔膜
Li
金属L抑制或阻碍锂枝晶的形成
1980年,John Goodenough发现了LiCoO 是高效的正极材料,可减少锂枝晶, 进而大幅提升锂电池的稳定性和安全性。
资料:与TiS 类 似 ,LiCoO 也是层状结构,锂离子 能在放电与充电的过程中嵌入或脱出,实现物质 循环转化。
资料:锂电池充电过程中,锂金属表面会逐渐析出 尖锐的锂 枝 晶,有可能穿透正负极之间的隔膜,
造成电池内部短路,引发电池自燃,造成爆炸。
增加隔膜的强度
伏打电堆—→一次锂金属电池 → 二次锂金属电池
钴酸锂LiCoO
放电
负极
锂离子
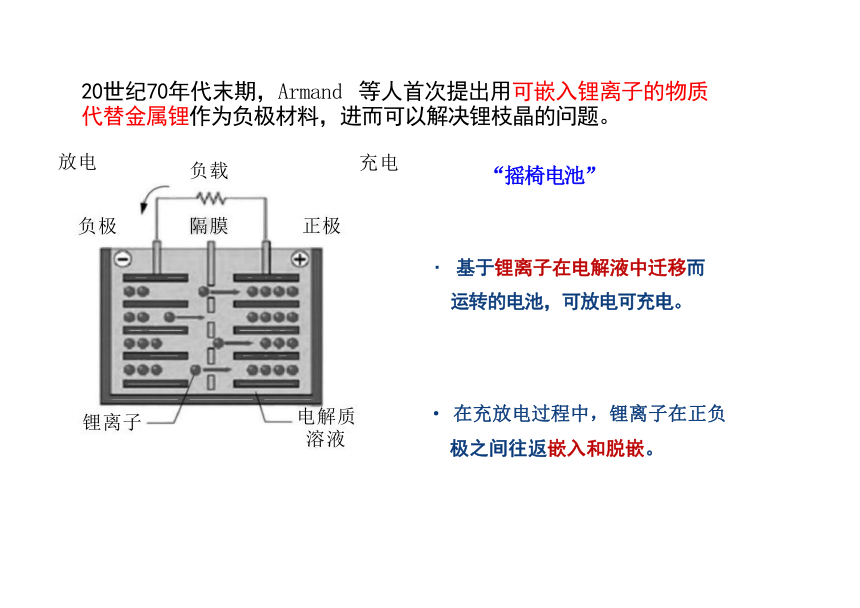
“摇椅电池”
· 基于锂离子在电解液中迁移而
运转的电池,可放电可充电。
· 在充放电过程中,锂离子在正负 极之间往返嵌入和脱嵌。
20世纪70年代末期,Armand 等人首次提出用可嵌入锂离子的物质 代替金属锂作为负极材料,进而可以解决锂枝晶的问题。
负载
隔膜
电解质 溶液
充电
正极
+ :Li+
e :e-
e
e
负极 隔膜
十
正 极 固 体LiCoO
电解质溶液
1983年,吉野彰将碳基材料用作负极,依旧用钴酸锂做正极, 确立了现代锂离子电池的基本框架。
2019年诺贝尔化学奖,表彰他们在锂电池开发方面 所做的贡献 该技术成功引领了一场储能革命!
Stanley Whittingham John Goodenough 吉野彰
放电时Li+由石墨中脱嵌移向正极,嵌入LiCoO 晶体
充阳极反应:LiCoO -xe-=xLi++Li _xCoO
电阴极反应:C,+xe-+xLi+=LiCy
充电时Li+从LiCoO 晶体中脱嵌,由正极回到负极,嵌入石墨中
负极反应:Li、Cy-xe-=xLi++Cy 正极材料 电 解 质 溶 液 负 极 材 料
正极反应:Li xCoO +xe-+xLi+=LiCoO
· 以钴酸锂—石墨锂电池为例:
锂离子电池
_
讨论2: 某电动汽车配载一种可充放电的锂离子电池。
放电时电池的总反应为:
Li _xCoO +Li、C =LiCoO +C (x<1)。下列关于该电池的说法不正确的是()
A. 放电时,Li+在电解质中由负极向正极迁移
B. 放电时,负极的电极反应式为LixC -xe*=xLi++C
C. 充电时,若转移1mole-,石 墨C 电极将增重7xg
D. 充电时,阳极的电极反应式为: LiCoO -xe~=Li _xCoO +Li+
(-):LiC =6C+xLi++xer(+):Li CoO +xLi++xe-=LiCoO
有关上述两种电池说法正确的是( )
A .锂离子电池放电时,Li+ 向负极迁移
B. 锂硫电池充电时,锂电极发生还原反应 C. 理论上两种电池的比能量相同
D. 下图表示用锂离子电池给锂硫电池充电
放电
Li_C+Li -xCoO
锂硫电池的总反应2Li+S
讨论3: (天津高考)已知:锂离子电池的总反应为
C+LiCoO
放电
充电 Li S
LiCoO Li S
电解质
充电
电 解 质
C
A. 电池工作时,正极可发生反应:2Li S +2Li++2er=3Li S
B. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li S 的量越多
讨论4: (全国卷)全固态锂硫电池能量密度高、成本低,其工作原理如图所示, 其中电极a常用掺有石墨烯的S 材料,电池反应为:16Li+xS =8Li S(2≤x≤8)。
下列说法错误的是( )
用电器
电极b
Li+
Li+
电解质
金属锂
电极a
e-沿导线传递,有电流产生
氧化反应← 负极
电解质溶液
解
溶
断
不
□原电池要素之一——电解质溶液 □海洋——人类最大的电解质库
正极 →还原反应
阳 离 子
移 向
1991年,我国首创以铝一空气一海水 为能源的新型电池,称之为海洋电池。 它是一种无污染、长效、稳定可靠的电 源。以铝合金为电池负极,金属(Pt、
Fe) 网为正极,用取之不尽的海水为电
解质溶液,它靠海水中的溶解氧与铝反 应产生电能的。
空气电极
空气
负载
电解液
口新型电池 · 铝-空气-海水电池
铝负极
e
讨论5:1991年我国首创以铝一空气一海水电池作为能源的新型海水标志灯,
以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中 数分钟,就会发出耀眼的白光.
则电源负极材料为:Al , 正极材料为:石墨或活泼性比铝弱的金属材料。 正、负极反应以及总反应方程式分别为:
30,+6H,O+12e-=12OH- 、 4Al- 12e*=4Al + ,
4Al+30 +6H O=4Al(OH)
以海水电池为能源 的国产航标灯
讨论6: (全国)Mg-AgCl 电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是()
A. 负极反应式为Mg-2e-=Mg +
B. 正极反应式为Ag++e =Ag
C. 电池放电时Cl-由正极向负极迁移
D. 负极会发生副反应Mg+2H O=Mg(OH) +H 个
Al 电极 AgO/Ag电极
S
NaOH/NaAlO
隔膜
讨论7: (江苏高考)
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源, 其原理如右下图所示。该电池反应的化学方程式为:
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散 至电极表面
B. 比较Mg 、Al 、Zn三种金属-空气电池,Al- 空气电池的理论比能量最高
C.M- 空气电池放电过程的正极反应式:
4Mn++nO +2nH O+4ne-=4M(OH)n
D. 在M- 空气电池中,为防止负极区沉积Mg(OH) , 宜采用中性电解质及阳离子交换膜
讨论8:(浙江)金属(M)- 空气电池(如图)具有原料易得、能量密度高等优点, 有望成为新能源汽车和移动设备的电源。
该类电池放电的总反应方程式为:4M+nO +2nH O=4M(OH)n。
已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
电解质电解
阴离子交换膜多孔电极
下列说法不正确的是() 负酸
金 属 (M
有关资料显示,一节一号电池烂在地里,
能使1方方米的土填永久失去和用价值;
一粒细口电池可使600吨水无法饮用,相当
于一个人一生的饮水量。
废电池污染治理刻不容缓
切一节废电池
等于埋上一颗炸弹
电
废旧电池处理
1、仅有一个电极材料参与反应的原电池:
负极:M-xe=Mx+
正极:析氢或吸氧或析出不活泼金属
2、两个电极均参与反应的原电池(如蓄电池,银锌电池)
①电极材料:金属为负极,金属化合物为正极.
②电子得失均由两电极本身发生.
③电极反应需考虑电解质溶液的参与.
3、电极材料本身均不参与反应的电池(燃料电池)
①两电极材料均为惰性电极.
②负极一可燃性气体失电子,正极一助燃性气体得电子.
③电极反应考虑电解质溶液.
小结
1、复习《第二节》知识
课后作业
化学电源
金属 Li
Be Na Mg Al Zn
相对原子质量 7 9 23 24 27 65 转移1mol电子所 需的质量(g) 7/19/2 23/1 24/2 27/365/2
讨论:从比能量角度考虑,你认为伏打电池的负极可改进为哪一种金属 电解质溶液需要改进吗
资料:铍及其化合物通常具有一定毒性
锂二氧化锰电池采用金属锂为负极,适当热处理的电解二氧化锰为正极以及由高氯酸锂(或三氟甲基磺酸锂)溶解于碳酸丙
烯酯乙二醇二甲醚等混合溶剂组成的电解质。其放电机理与一般电池的氧化还原机理有所不同,正极反应是一种典型的嵌入式反 应。电池的化学反应式如下:
总反应MnO +xLi =LizMnO
负极 xLi-xe-=xLi+
正极MnO +xLi++xe-=LizMnO
锂二氧化锰电池
进入词条
锂二氧化锰电池
④ 上传视频
编辑 ■ 讨 论
6 语 音
3、锂 电 池 特点:①“绿色”;②容量大;③电解液中不能有水
讨论1:Li—SOCI 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳, 电解液是LiAICI 一SOCl 。
电池的总反应可表示为8Li+3SOCl ===6LiCl+Li SO +2S。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为______;
(3)组装该电池必须在无水、无氧的条件下进行,原因是 o
资 料 :TiS 是一种微观上具有层状结构的固
体材料。放、充电时,Ti 元素的化合价发 生变化,层状结构所带电荷量发生改变,
锂离子会因此从其中嵌入或脱出。
放电总反应:xLi+TiS =Li.TiS
负极:x Li-x e-=x Li+
正极:TiS +x Li++x e~=Li TiS
Stanley Whittingham在1976年提出了第一个嵌入脱出型的正极材料TiS
伏打电堆—→一次锂金属电池 一 二次锂金属电池
固体TiS
含Li+的
电解质溶液
:: +-
e
Li
—— TiS
隔膜
Li
金属L抑制或阻碍锂枝晶的形成
1980年,John Goodenough发现了LiCoO 是高效的正极材料,可减少锂枝晶, 进而大幅提升锂电池的稳定性和安全性。
资料:与TiS 类 似 ,LiCoO 也是层状结构,锂离子 能在放电与充电的过程中嵌入或脱出,实现物质 循环转化。
资料:锂电池充电过程中,锂金属表面会逐渐析出 尖锐的锂 枝 晶,有可能穿透正负极之间的隔膜,
造成电池内部短路,引发电池自燃,造成爆炸。
增加隔膜的强度
伏打电堆—→一次锂金属电池 → 二次锂金属电池
钴酸锂LiCoO
放电
负极
锂离子
“摇椅电池”
· 基于锂离子在电解液中迁移而
运转的电池,可放电可充电。
· 在充放电过程中,锂离子在正负 极之间往返嵌入和脱嵌。
20世纪70年代末期,Armand 等人首次提出用可嵌入锂离子的物质 代替金属锂作为负极材料,进而可以解决锂枝晶的问题。
负载
隔膜
电解质 溶液
充电
正极
+ :Li+
e :e-
e
e
负极 隔膜
十
正 极 固 体LiCoO
电解质溶液
1983年,吉野彰将碳基材料用作负极,依旧用钴酸锂做正极, 确立了现代锂离子电池的基本框架。
2019年诺贝尔化学奖,表彰他们在锂电池开发方面 所做的贡献 该技术成功引领了一场储能革命!
Stanley Whittingham John Goodenough 吉野彰
放电时Li+由石墨中脱嵌移向正极,嵌入LiCoO 晶体
充阳极反应:LiCoO -xe-=xLi++Li _xCoO
电阴极反应:C,+xe-+xLi+=LiCy
充电时Li+从LiCoO 晶体中脱嵌,由正极回到负极,嵌入石墨中
负极反应:Li、Cy-xe-=xLi++Cy 正极材料 电 解 质 溶 液 负 极 材 料
正极反应:Li xCoO +xe-+xLi+=LiCoO
· 以钴酸锂—石墨锂电池为例:
锂离子电池
_
讨论2: 某电动汽车配载一种可充放电的锂离子电池。
放电时电池的总反应为:
Li _xCoO +Li、C =LiCoO +C (x<1)。下列关于该电池的说法不正确的是()
A. 放电时,Li+在电解质中由负极向正极迁移
B. 放电时,负极的电极反应式为LixC -xe*=xLi++C
C. 充电时,若转移1mole-,石 墨C 电极将增重7xg
D. 充电时,阳极的电极反应式为: LiCoO -xe~=Li _xCoO +Li+
(-):LiC =6C+xLi++xer(+):Li CoO +xLi++xe-=LiCoO
有关上述两种电池说法正确的是( )
A .锂离子电池放电时,Li+ 向负极迁移
B. 锂硫电池充电时,锂电极发生还原反应 C. 理论上两种电池的比能量相同
D. 下图表示用锂离子电池给锂硫电池充电
放电
Li_C+Li -xCoO
锂硫电池的总反应2Li+S
讨论3: (天津高考)已知:锂离子电池的总反应为
C+LiCoO
放电
充电 Li S
LiCoO Li S
电解质
充电
电 解 质
C
A. 电池工作时,正极可发生反应:2Li S +2Li++2er=3Li S
B. 电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li S 的量越多
讨论4: (全国卷)全固态锂硫电池能量密度高、成本低,其工作原理如图所示, 其中电极a常用掺有石墨烯的S 材料,电池反应为:16Li+xS =8Li S(2≤x≤8)。
下列说法错误的是( )
用电器
电极b
Li+
Li+
电解质
金属锂
电极a
e-沿导线传递,有电流产生
氧化反应← 负极
电解质溶液
解
溶
断
不
□原电池要素之一——电解质溶液 □海洋——人类最大的电解质库
正极 →还原反应
阳 离 子
移 向
1991年,我国首创以铝一空气一海水 为能源的新型电池,称之为海洋电池。 它是一种无污染、长效、稳定可靠的电 源。以铝合金为电池负极,金属(Pt、
Fe) 网为正极,用取之不尽的海水为电
解质溶液,它靠海水中的溶解氧与铝反 应产生电能的。
空气电极
空气
负载
电解液
口新型电池 · 铝-空气-海水电池
铝负极
e
讨论5:1991年我国首创以铝一空气一海水电池作为能源的新型海水标志灯,
以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中 数分钟,就会发出耀眼的白光.
则电源负极材料为:Al , 正极材料为:石墨或活泼性比铝弱的金属材料。 正、负极反应以及总反应方程式分别为:
30,+6H,O+12e-=12OH- 、 4Al- 12e*=4Al + ,
4Al+30 +6H O=4Al(OH)
以海水电池为能源 的国产航标灯
讨论6: (全国)Mg-AgCl 电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是()
A. 负极反应式为Mg-2e-=Mg +
B. 正极反应式为Ag++e =Ag
C. 电池放电时Cl-由正极向负极迁移
D. 负极会发生副反应Mg+2H O=Mg(OH) +H 个
Al 电极 AgO/Ag电极
S
NaOH/NaAlO
隔膜
讨论7: (江苏高考)
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源, 其原理如右下图所示。该电池反应的化学方程式为:
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散 至电极表面
B. 比较Mg 、Al 、Zn三种金属-空气电池,Al- 空气电池的理论比能量最高
C.M- 空气电池放电过程的正极反应式:
4Mn++nO +2nH O+4ne-=4M(OH)n
D. 在M- 空气电池中,为防止负极区沉积Mg(OH) , 宜采用中性电解质及阳离子交换膜
讨论8:(浙江)金属(M)- 空气电池(如图)具有原料易得、能量密度高等优点, 有望成为新能源汽车和移动设备的电源。
该类电池放电的总反应方程式为:4M+nO +2nH O=4M(OH)n。
已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
电解质电解
阴离子交换膜多孔电极
下列说法不正确的是() 负酸
金 属 (M
有关资料显示,一节一号电池烂在地里,
能使1方方米的土填永久失去和用价值;
一粒细口电池可使600吨水无法饮用,相当
于一个人一生的饮水量。
废电池污染治理刻不容缓
切一节废电池
等于埋上一颗炸弹
电
废旧电池处理
1、仅有一个电极材料参与反应的原电池:
负极:M-xe=Mx+
正极:析氢或吸氧或析出不活泼金属
2、两个电极均参与反应的原电池(如蓄电池,银锌电池)
①电极材料:金属为负极,金属化合物为正极.
②电子得失均由两电极本身发生.
③电极反应需考虑电解质溶液的参与.
3、电极材料本身均不参与反应的电池(燃料电池)
①两电极材料均为惰性电极.
②负极一可燃性气体失电子,正极一助燃性气体得电子.
③电极反应考虑电解质溶液.
小结
1、复习《第二节》知识
课后作业
