离子反应 高一上学期化学人教版(2019)必修1(共29张PPT)
文档属性
| 名称 | 离子反应 高一上学期化学人教版(2019)必修1(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 867.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 11:53:58 | ||
图片预览






文档简介
(共29张PPT)
第三章物质结构元素周期律
第三节化学键
4.3.1 离子键
学习目标
1、通过NaCl 的形成过程,理解离子键的形成过程与形成条件, 知道离子键、离子化合物的概念。
2.会识别判断离子化合物。
3. 理解化学键的概念及化学反应的本质,培养“宏观辨识与微观 探析”的核心素养。
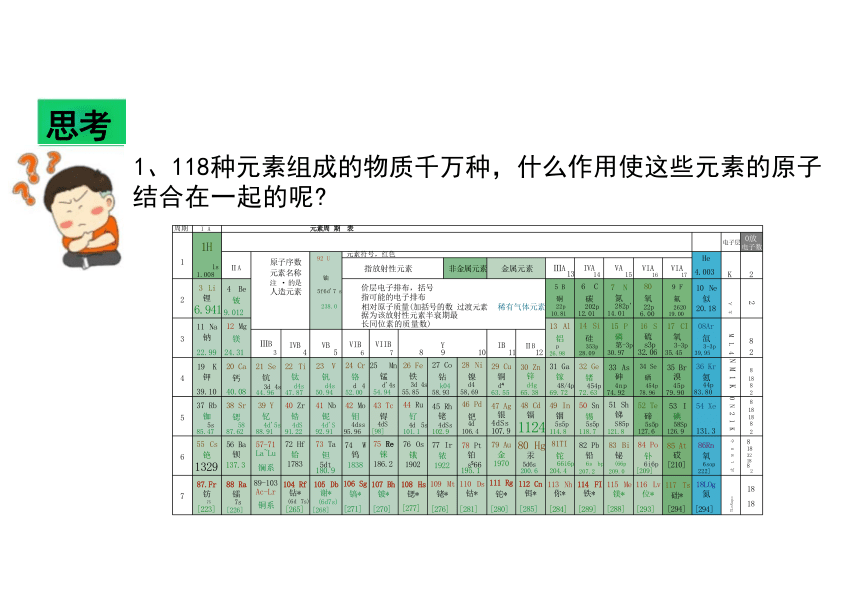
周期 I A 元素周 期 表
1 1H 1s 1.008 电子层
0放 电子数
ⅡA 原子序数 元素名称 注 · 的是 人造元素 92 U 铀 5f6d'7 s 238.0 元素符号,红色 He 4.003 K
2
指放射性元素 非金属元素 金属元素 ⅢA 13 IVA 14 VA 15 VIA 16 VIA 17 2 3 Li 锂 6.941 4 Be 铍 9.012 价层电子排布,括号 指可能的电子排布 相对原子质量(加括号的数 过渡元素 稀有气体元素 据为该放射性元素半衰期最 长同位素的质量数) 5 B 硐 22p 10.81 6 C 碳 202p 12.01 7 N 氮 282p' 14.01 80 氧 22p 6.00 9 F 氟 2620 19.00 10 Ne 似 20.18 太 人
2
3 11 Na 钠 22.99 12 Mg 镁 24.31 13 Al 铝 p 26.98 14 Si 硅 353p 28.09 15 P 磷 第-3p 30.97 16 S 硫 s3p 32.06 17 CI 氧 3-3p 35.45 08Ar 氙 3-3p 39,95 M L 4
8
2
ⅢB 3 IVB 4 VB 5 VIB 6 VIIB 7 Y 8 9 10 IB 11 ⅡB 12 4 19 K 钾 39.10 20 Ca 钙 40.08 21 Se 钪 3d 4s 44.96 22 Ti 钛 d4s 47.87 23 V 钒 d4s 50.94 24 Cr 铬 d 4 52.00 25 Mn 锰 d'4s 54.94 26 Fe 铁 3d 4s 55.85 27 Co 钻 k04 58.93 28 Ni 镍 d4 58,69 29 Cu 铜 d 63.55 30 Zn 锌 d4g 65.38 31 Ga 镓 48/4p 69.72 32 Ge 锗 454p 72.63 33 As 砷 4np 74.92 34 Se 硒 454p 78.96 35 Br 溴 45p 79.90 36 Kr 氪 44p 83.80 NM1K
8
18
8
2
5 37 Rb 铷 5s 85.47 38 Sr 锶 58 87.62 39 Y 钇 4d'5s 88.91 40 Zr 锆 4dS 91.22 41 Nb 铌 4d'S 92.91 42 Mo 钼 4dss 95.96 43 Tc 锝 4dS [98] 44 Ru 钌 4d 5s 101.1 45 Rh 铑 4dSs 102.9 46 Pd 钯 4d 106.4 47 Ag 银 4dSs 107.9 48 Cd 镉 1124 49 In 铟 5s5p 114.8 50 Sn 锡 5s5p 118.7 51 Sh 锑 S85p 121.8 52 Te 碲 5s5p 127.6 53 I 碘 58Sp 126.9 54 Xe 131.3 0N21K
8
18
18
8
2
6 55 Cs 铯 1329 56 Ba 钡 137.3 57-71 La~Lu 镧系 72 Hf 铪 1783 73 Ta 钽 5dt 180.9 74 W 钨 1838 75 Re 铼 186.2 76 Os 锇 1902 77 Ir 铱 1922 78 Pt 铂 s 66 195.1 79 Au 金 1970 80 Hg 汞 5d6s 200.6 81TI 铊 66i6p 204.4 82 Pb 铅 6s bp 207.2 83 Bi 铋 (66p 209.0 84 Po 钋 6i6p [209] 85 At 砹 [210] 86Rn 氧 6sop 222] 式 L M R 心
8
18
32
18
8
2
7 87.Fr 钫 75 [223] 88 Ra 镭 7s [226] 89-103 Ac-Lr 铜系 104 Rf 钻* (6d 7s) [265] 105 Db 谢* (6d7s) [268] 106 Sg 镐* [271] 107 Bh 铍* [270] 108 Hs 锶* [277] 109 Mt 铑* [276] 110 Ds 钴* [281] 111 Rg 铊* [280] 112 Cn 铒* [285] 113 Nh 你* [284] 114 FI 铁* [289] 115 Me 镁* [288] 116 Lv 位* [293] 117 Ts 础* [294] 18LOg 氮 [294] TLnNupo
18
18
1、118种元素组成的物质千万种,什么作用使这些元素的原子 结合在一起的呢
思考
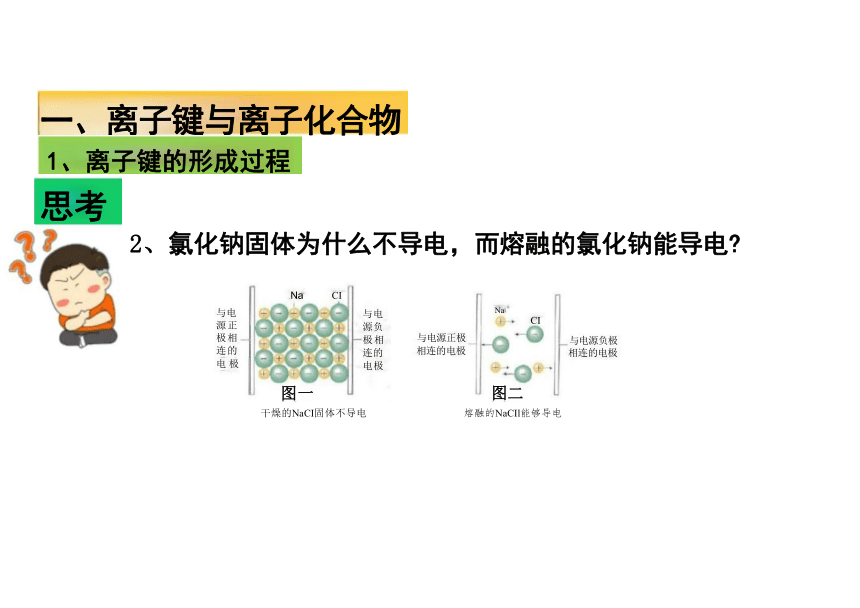
Na
CI
与电源正极
相连的电极
图二
Na CI
与电
源正
极相
连的
电 极
图一
一、离子键与离子化合物
2、氯化钠固体为什么不导电,而熔融的氯化钠能导电
1、离子键的形成过程
思考
干燥的NaCI固体不导电 熔融的NaCIl能够导电
与电 源负 极相 连的 电极
与电源负极 相连的电极
稳定
28 Na+
静电作用 Na CI
17 288 Cl-
钠和氯气反应时,钠原子的最外电子层上的1个电子转移到氯原 子的在外电子层上,形成带正电荷的钠离子和带负电的氯离子。 带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而 形成与单质钠和氯气性质完全不同的NaCl。
cl 7 287
Na 28
不稳定
e-
【注意】静电作用包括:阴阳离子的原子核和核外电子之间 的静电相互吸引作用和阴阳离子间电子与电子、原子核与原 子核间的相互排斥作用。
当阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡, 阴阳离子间形成稳定的化学键。
(1)定义
带相反电荷离子之间的相互作用叫做离子键
(2)成键微粒
阳离子和阴离子
(3)成键本质
阴离子和阳离子之间的静电作用。这种静电作用不只是静电引力,而 是指阴、阳离子之间的静电引力与电子之间、原子核之间斥力处于平 衡时的总效应
2、离子键
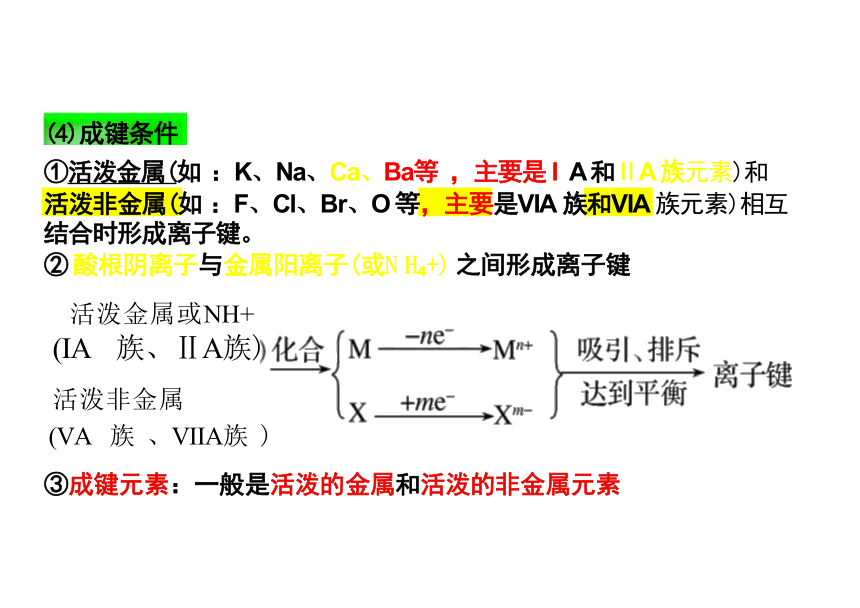
①活泼金属(如 :K、Na、Ca、Ba等 ,主要是 I A 和ⅡA 族元素)和
活泼非金属(如 :F、Cl、Br、O 等,主要是VIA 族和VIA 族元素)相互 结合时形成离子键。
② 酸根阴离子与金属阳离子(或N H +) 之间形成离子键
活泼金属或NH+
(IA 族、ⅡA族)
活泼非金属
(VA 族 、VIIA族 )
③成键元素:一般是活泼的金属和活泼的非金属元素
(4)成键条件
离子键的强弱决定于相互作用的阴、阳离子所带的电荷数的多少和 其离子核间的距离(即阴、阳离子半径之和)大小。阴、阳离子电荷 数越多,半径越小,形成的离子键就越强,形成的化合物的熔沸点 就越高,晶体的硬度则越大。如:CaO只存在离子化合物中,常见的离子化合物: 强碱(NaOH); 绝大多 数盐[NaCl 、Na SO , 但AICl 、BeCl 例外;金属氧化物(Na O、
Na O 、K O 、CaO 、MgO)
离子键成键的原因是原子间相互得失电子达到稳定结构;体系的总
能量降低
(7)离子键强弱的判断(了解)
(5)成键的原因
(6)存在范围
【注意】阴,阳离子既可以是由原子失去或得到电子形成的简单离 子又可以是由原子团得到或失去电子形成的离子团
【练一练】
1、以下叙述中,错误的是( C )
A. 钠原子和氯原子作用生成NaCl 后,其结构的稳定性增强
B. 在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子 与电子、原子核与原子核之间的排斥作用
C。任何离子键在形成的过程中必定有电子的得与失
D. 金属钠与氯气反应生成氯化钠后,体系能量降低
2、根据成键元素判断下列化合物中含有离子键的是( D )
A.HF B.H O C.H SO D.MgO
3、与NaCl 化学键类型相同的物质是( C )
A.H B.HCI C.KCl D.CO
2、是不是所有的金属和非金属元素之间都能形成离子键
不是所有的金属和非金属之间化合都能形成离子键;如AICl
3、是否只有金属与非金属之间才能形成离子键
非金属和非金属之间也能形成离子键;如NH Cl 等
4、哪些物质中含有离子键
强 碱 :NaOH、KOH、Ba(OH) 、Ca(OH) (Mg(OH) 也是离
子化合物)
b多(A数C盐)、: ,lC、l aCl 、BaSO 、NH Cl 等(除AICl 、PbCl 、
活泼金属氧化物、过氧化物:Na O、Na O 、CaO、MgO 等
g
C
H
Na
思考
离子键
(4)常见的离子化合物的类型
大多数盐类(NaCl 、Na SO ) 、强 碱(NaOH) 、金属氧化物(Na O、 Na O )
物概念
通过离子键形成的化合物即为离子化合物
(2)组成微粒
阳离子和阴离子
(3)微粒间的作用力
3、离子化合
(5)离子化合物的 特 点
较高的熔沸点,硬度,通常呈固态,熔融状态或水溶液中可导电
【注意】①离子化合物中一定含有离子键;含有离子键的物质一定是
离子化合物
②离子化合物中一定含有阴离子和阳离子,但不一定含有金属元素, 如: NH Cl、NH NO 等
③含有金属元素的化合物不一定是离子化 合 物 , 如 : A I C l
④离子化合物的化学式,不表示分子式,只表示阴、阳离子的最简单 整数比
⑤判断离子化合物的经验之谈:化学式中含有金属元素的化合物以及 铵盐都属于离子化合物,除AICl 、BeCl 、PbCl,、Pb(AC),
Hg Cl 等
【练一练】
4、判断正误
(1)离子化合物中一定含有金属元素( × )
(2)由金属元素和非金属元素形成的化合物一定是离子化合物( × )
(3)第I A、ⅡA族元素与第VIA、VIA 族元素之间都能形成离子键( × )
(4)含有离子键的化合物一定是离子化合物( √ )
(5)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导 电( × )
A.a 和c B.a和f C.d和g D.c和g
Y元素位于第VIA族且不是氧元素
6、Y 元素最高正价与最低负价的绝对值之差是4;Y 元素与M 元 素形成离子化合物,并在水中电离出电子层结构相同的离子,该 化合物是( D )
A.KCl B.Na SC.Na O D.K S
【练一练】
5、下列哪一组元素的原子间容易形成离子键( B )
元素 a b C d e f
g
M层电子数 1 2 3 4 5 6
7
5、化学反应中一般是原子的最外层电子发生变化,所以化学 反应中需要表示出最外层电子的变化,那么用什么来表示呢
电子式
思考
二、电子式
1、定 义
在元素符号周围用“ ·”或“×”来表示原子的最外层电子(价电子)的 式子叫做电子式。
【注意】元素符号周围标明元素原子的最外层电子,元素符号的上下 左右每个方向不能超过2个电子。当最外层电子数小于或等于4时以单 电子分布,多于4时多出部分以电子对分布
2、电子式的书写
(1)原子的电子式
书写主族元素原子的电子式,直 接 用“o” 或“×”把最外层电子一 一表示出来即可
氢原子 氯原子 氮原子 钠原子 氧原子
钙原子
H · Cl: N
氢离子 钠离子 锂离子 镁离子 铝离子
钙离子
电子式就是离子符号本身,不需标示最外层电子
(2)简单阳离子的电子式
在书写电子式时,不但要表达出最外层所有电子数(包括得到的
电子) ]”括起来 []”右上角标出
"n -"以表示其所带的电荷
Cl- O2- S2-
N3-
XCI:] [XO:]2- S:]2
XN:]2
(3)简单阴离子(单核)的电子式
NH + H O+ OH- 0,2-
2-
H H×N×H X H [H:0:H]+ H [:0:H]- :0:0:]2
[×C::C×]2-
作为离子的原子团,无论是阴离子,还是阳离子,不仅要画出
各原子最外层的电子,而且都应用“[ ]”括起来,并在“[
(4)原子团(复杂阴、阳离子)的电子式
”右上角标明电性和电量
意相同的离子不能合并,同性离子不接触。
AB型 Na+[×ci:]- A B型 Na+〔×0×〕2-Na+ k+& 对k*
AB 型 [:cix]-Mg +[xci:]- [Br]ng [Br
的电子式和阴离子的电子
离子化合物的电子式由阳离子 式组成的 ,
对于化合物是由多种离子组成的物质,相同离子间要隔开排
( 5 ) 离 子 化 合 物 的 电 子 式
列,注
CaO K S CaF NaOH
NaH
CaC FeS
NH
V0 Na N
【练一练】
7、写出下列化合物的电子式
:4′回唱米群墨,卡粤一 由间申‘ 士审明导乳去圆市气里 ‘ 去电阴士堂2华币气里奥‘F 当半手士申由 狎继 士 图
_[:1×]BN<:1D;+×BN
( 继 卵 导 孔 去 图 ) 继 去 图 ( 9 )
【几点强调】
(1)一个“ ·”或“×”代表一个电子,原子的电子式中“。”(或“×”) 的个数即原子的最外层电子数。
(2)同一原子的电子式不能既用“×”又用“。”表示。 [H:N:H]+
(3) “在所有的阴离子、复杂的阳离子中出现。 H
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的 , 即不能将两个阴离子或两个阳离子写在一起,如CaF 不能写成
Ca +[xF:], 要写成[:F×]-Ca +[xF:] 一。
(5)用电子式表示化合物形成过程时,由于不是化学方程式 ,不能出现
"="。“→”前是原子的电子式,“→”后是化合物的电子式。
【练一练】
8.下列电子式的书写正确的是(C)
A.氮 原 子 :N: B.O -离 子 : : 0 :
C.Na O :Na+[×O×]2-Na+D.CaCl :Ca +[:C1:]2
【练一练】
9、下列各数值表示有关元素的原子序数,能形成AB 型离子化 合物的是(D)
A.6与8 B.11与13 C.11 与16 D.12与17
10.下列用电子式表示化合物的形成过程错误的是(C )
A K.+.0.+·K→K*[:o:] -k+
B : .+·Ba+.c:→ [c:][Ba: tE:C:
1)原子、离子都要标出最外层电子,离子必须标明电荷
2)阴离子要用方括号括起来
3)相同的原子可以合并谢,相同的粒子要单个写(箭头 左边相同的微粒可以合并,箭头右边相同的微粒不可以 合并)
4)不能把“—>”写成“=“
带相反电荷的钠离子和氯离子,通过静电作用结合在一 起,从而形成与单质钠和氯气性质完全不同的氯化钠。 人们把这种带相反电荷粒子之间的相互作用叫离子键。 像氯化钠这样,由离子键构成的化合物叫做离子化合物
为方便起见,我们在元素符号周围用“。”或“×”表示原子的最外层 电子(价电子)。这种式子叫做电子式。
用电子式表示离子化 合物的形成过程注意 事项
离子键和离子化合物
课堂小结
化学键
电子式
第三章物质结构元素周期律
第三节化学键
4.3.1 离子键
学习目标
1、通过NaCl 的形成过程,理解离子键的形成过程与形成条件, 知道离子键、离子化合物的概念。
2.会识别判断离子化合物。
3. 理解化学键的概念及化学反应的本质,培养“宏观辨识与微观 探析”的核心素养。
周期 I A 元素周 期 表
1 1H 1s 1.008 电子层
0放 电子数
ⅡA 原子序数 元素名称 注 · 的是 人造元素 92 U 铀 5f6d'7 s 238.0 元素符号,红色 He 4.003 K
2
指放射性元素 非金属元素 金属元素 ⅢA 13 IVA 14 VA 15 VIA 16 VIA 17 2 3 Li 锂 6.941 4 Be 铍 9.012 价层电子排布,括号 指可能的电子排布 相对原子质量(加括号的数 过渡元素 稀有气体元素 据为该放射性元素半衰期最 长同位素的质量数) 5 B 硐 22p 10.81 6 C 碳 202p 12.01 7 N 氮 282p' 14.01 80 氧 22p 6.00 9 F 氟 2620 19.00 10 Ne 似 20.18 太 人
2
3 11 Na 钠 22.99 12 Mg 镁 24.31 13 Al 铝 p 26.98 14 Si 硅 353p 28.09 15 P 磷 第-3p 30.97 16 S 硫 s3p 32.06 17 CI 氧 3-3p 35.45 08Ar 氙 3-3p 39,95 M L 4
8
2
ⅢB 3 IVB 4 VB 5 VIB 6 VIIB 7 Y 8 9 10 IB 11 ⅡB 12 4 19 K 钾 39.10 20 Ca 钙 40.08 21 Se 钪 3d 4s 44.96 22 Ti 钛 d4s 47.87 23 V 钒 d4s 50.94 24 Cr 铬 d 4 52.00 25 Mn 锰 d'4s 54.94 26 Fe 铁 3d 4s 55.85 27 Co 钻 k04 58.93 28 Ni 镍 d4 58,69 29 Cu 铜 d 63.55 30 Zn 锌 d4g 65.38 31 Ga 镓 48/4p 69.72 32 Ge 锗 454p 72.63 33 As 砷 4np 74.92 34 Se 硒 454p 78.96 35 Br 溴 45p 79.90 36 Kr 氪 44p 83.80 NM1K
8
18
8
2
5 37 Rb 铷 5s 85.47 38 Sr 锶 58 87.62 39 Y 钇 4d'5s 88.91 40 Zr 锆 4dS 91.22 41 Nb 铌 4d'S 92.91 42 Mo 钼 4dss 95.96 43 Tc 锝 4dS [98] 44 Ru 钌 4d 5s 101.1 45 Rh 铑 4dSs 102.9 46 Pd 钯 4d 106.4 47 Ag 银 4dSs 107.9 48 Cd 镉 1124 49 In 铟 5s5p 114.8 50 Sn 锡 5s5p 118.7 51 Sh 锑 S85p 121.8 52 Te 碲 5s5p 127.6 53 I 碘 58Sp 126.9 54 Xe 131.3 0N21K
8
18
18
8
2
6 55 Cs 铯 1329 56 Ba 钡 137.3 57-71 La~Lu 镧系 72 Hf 铪 1783 73 Ta 钽 5dt 180.9 74 W 钨 1838 75 Re 铼 186.2 76 Os 锇 1902 77 Ir 铱 1922 78 Pt 铂 s 66 195.1 79 Au 金 1970 80 Hg 汞 5d6s 200.6 81TI 铊 66i6p 204.4 82 Pb 铅 6s bp 207.2 83 Bi 铋 (66p 209.0 84 Po 钋 6i6p [209] 85 At 砹 [210] 86Rn 氧 6sop 222] 式 L M R 心
8
18
32
18
8
2
7 87.Fr 钫 75 [223] 88 Ra 镭 7s [226] 89-103 Ac-Lr 铜系 104 Rf 钻* (6d 7s) [265] 105 Db 谢* (6d7s) [268] 106 Sg 镐* [271] 107 Bh 铍* [270] 108 Hs 锶* [277] 109 Mt 铑* [276] 110 Ds 钴* [281] 111 Rg 铊* [280] 112 Cn 铒* [285] 113 Nh 你* [284] 114 FI 铁* [289] 115 Me 镁* [288] 116 Lv 位* [293] 117 Ts 础* [294] 18LOg 氮 [294] TLnNupo
18
18
1、118种元素组成的物质千万种,什么作用使这些元素的原子 结合在一起的呢
思考
Na
CI
与电源正极
相连的电极
图二
Na CI
与电
源正
极相
连的
电 极
图一
一、离子键与离子化合物
2、氯化钠固体为什么不导电,而熔融的氯化钠能导电
1、离子键的形成过程
思考
干燥的NaCI固体不导电 熔融的NaCIl能够导电
与电 源负 极相 连的 电极
与电源负极 相连的电极
稳定
28 Na+
静电作用 Na CI
17 288 Cl-
钠和氯气反应时,钠原子的最外电子层上的1个电子转移到氯原 子的在外电子层上,形成带正电荷的钠离子和带负电的氯离子。 带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而 形成与单质钠和氯气性质完全不同的NaCl。
cl 7 287
Na 28
不稳定
e-
【注意】静电作用包括:阴阳离子的原子核和核外电子之间 的静电相互吸引作用和阴阳离子间电子与电子、原子核与原 子核间的相互排斥作用。
当阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡, 阴阳离子间形成稳定的化学键。
(1)定义
带相反电荷离子之间的相互作用叫做离子键
(2)成键微粒
阳离子和阴离子
(3)成键本质
阴离子和阳离子之间的静电作用。这种静电作用不只是静电引力,而 是指阴、阳离子之间的静电引力与电子之间、原子核之间斥力处于平 衡时的总效应
2、离子键
①活泼金属(如 :K、Na、Ca、Ba等 ,主要是 I A 和ⅡA 族元素)和
活泼非金属(如 :F、Cl、Br、O 等,主要是VIA 族和VIA 族元素)相互 结合时形成离子键。
② 酸根阴离子与金属阳离子(或N H +) 之间形成离子键
活泼金属或NH+
(IA 族、ⅡA族)
活泼非金属
(VA 族 、VIIA族 )
③成键元素:一般是活泼的金属和活泼的非金属元素
(4)成键条件
离子键的强弱决定于相互作用的阴、阳离子所带的电荷数的多少和 其离子核间的距离(即阴、阳离子半径之和)大小。阴、阳离子电荷 数越多,半径越小,形成的离子键就越强,形成的化合物的熔沸点 就越高,晶体的硬度则越大。如:CaO
Na O 、K O 、CaO 、MgO)
离子键成键的原因是原子间相互得失电子达到稳定结构;体系的总
能量降低
(7)离子键强弱的判断(了解)
(5)成键的原因
(6)存在范围
【注意】阴,阳离子既可以是由原子失去或得到电子形成的简单离 子又可以是由原子团得到或失去电子形成的离子团
【练一练】
1、以下叙述中,错误的是( C )
A. 钠原子和氯原子作用生成NaCl 后,其结构的稳定性增强
B. 在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子 与电子、原子核与原子核之间的排斥作用
C。任何离子键在形成的过程中必定有电子的得与失
D. 金属钠与氯气反应生成氯化钠后,体系能量降低
2、根据成键元素判断下列化合物中含有离子键的是( D )
A.HF B.H O C.H SO D.MgO
3、与NaCl 化学键类型相同的物质是( C )
A.H B.HCI C.KCl D.CO
2、是不是所有的金属和非金属元素之间都能形成离子键
不是所有的金属和非金属之间化合都能形成离子键;如AICl
3、是否只有金属与非金属之间才能形成离子键
非金属和非金属之间也能形成离子键;如NH Cl 等
4、哪些物质中含有离子键
强 碱 :NaOH、KOH、Ba(OH) 、Ca(OH) (Mg(OH) 也是离
子化合物)
b多(A数C盐)、: ,lC、l aCl 、BaSO 、NH Cl 等(除AICl 、PbCl 、
活泼金属氧化物、过氧化物:Na O、Na O 、CaO、MgO 等
g
C
H
Na
思考
离子键
(4)常见的离子化合物的类型
大多数盐类(NaCl 、Na SO ) 、强 碱(NaOH) 、金属氧化物(Na O、 Na O )
物概念
通过离子键形成的化合物即为离子化合物
(2)组成微粒
阳离子和阴离子
(3)微粒间的作用力
3、离子化合
(5)离子化合物的 特 点
较高的熔沸点,硬度,通常呈固态,熔融状态或水溶液中可导电
【注意】①离子化合物中一定含有离子键;含有离子键的物质一定是
离子化合物
②离子化合物中一定含有阴离子和阳离子,但不一定含有金属元素, 如: NH Cl、NH NO 等
③含有金属元素的化合物不一定是离子化 合 物 , 如 : A I C l
④离子化合物的化学式,不表示分子式,只表示阴、阳离子的最简单 整数比
⑤判断离子化合物的经验之谈:化学式中含有金属元素的化合物以及 铵盐都属于离子化合物,除AICl 、BeCl 、PbCl,、Pb(AC),
Hg Cl 等
【练一练】
4、判断正误
(1)离子化合物中一定含有金属元素( × )
(2)由金属元素和非金属元素形成的化合物一定是离子化合物( × )
(3)第I A、ⅡA族元素与第VIA、VIA 族元素之间都能形成离子键( × )
(4)含有离子键的化合物一定是离子化合物( √ )
(5)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导 电( × )
A.a 和c B.a和f C.d和g D.c和g
Y元素位于第VIA族且不是氧元素
6、Y 元素最高正价与最低负价的绝对值之差是4;Y 元素与M 元 素形成离子化合物,并在水中电离出电子层结构相同的离子,该 化合物是( D )
A.KCl B.Na SC.Na O D.K S
【练一练】
5、下列哪一组元素的原子间容易形成离子键( B )
元素 a b C d e f
g
M层电子数 1 2 3 4 5 6
7
5、化学反应中一般是原子的最外层电子发生变化,所以化学 反应中需要表示出最外层电子的变化,那么用什么来表示呢
电子式
思考
二、电子式
1、定 义
在元素符号周围用“ ·”或“×”来表示原子的最外层电子(价电子)的 式子叫做电子式。
【注意】元素符号周围标明元素原子的最外层电子,元素符号的上下 左右每个方向不能超过2个电子。当最外层电子数小于或等于4时以单 电子分布,多于4时多出部分以电子对分布
2、电子式的书写
(1)原子的电子式
书写主族元素原子的电子式,直 接 用“o” 或“×”把最外层电子一 一表示出来即可
氢原子 氯原子 氮原子 钠原子 氧原子
钙原子
H · Cl: N
氢离子 钠离子 锂离子 镁离子 铝离子
钙离子
电子式就是离子符号本身,不需标示最外层电子
(2)简单阳离子的电子式
在书写电子式时,不但要表达出最外层所有电子数(包括得到的
电子) ]”括起来 []”右上角标出
"n -"以表示其所带的电荷
Cl- O2- S2-
N3-
XCI:] [XO:]2- S:]2
XN:]2
(3)简单阴离子(单核)的电子式
NH + H O+ OH- 0,2-
2-
H H×N×H X H [H:0:H]+ H [:0:H]- :0:0:]2
[×C::C×]2-
作为离子的原子团,无论是阴离子,还是阳离子,不仅要画出
各原子最外层的电子,而且都应用“[ ]”括起来,并在“[
(4)原子团(复杂阴、阳离子)的电子式
”右上角标明电性和电量
意相同的离子不能合并,同性离子不接触。
AB型 Na+[×ci:]- A B型 Na+〔×0×〕2-Na+ k+& 对k*
AB 型 [:cix]-Mg +[xci:]- [Br]ng [Br
的电子式和阴离子的电子
离子化合物的电子式由阳离子 式组成的 ,
对于化合物是由多种离子组成的物质,相同离子间要隔开排
( 5 ) 离 子 化 合 物 的 电 子 式
列,注
CaO K S CaF NaOH
NaH
CaC FeS
NH
V0 Na N
【练一练】
7、写出下列化合物的电子式
:4′回唱米群墨,卡粤一 由间申‘ 士审明导乳去圆市气里 ‘ 去电阴士堂2华币气里奥‘F 当半手士申由 狎继 士 图
_[:1×]BN<:1D;+×BN
( 继 卵 导 孔 去 图 ) 继 去 图 ( 9 )
【几点强调】
(1)一个“ ·”或“×”代表一个电子,原子的电子式中“。”(或“×”) 的个数即原子的最外层电子数。
(2)同一原子的电子式不能既用“×”又用“。”表示。 [H:N:H]+
(3) “在所有的阴离子、复杂的阳离子中出现。 H
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的 , 即不能将两个阴离子或两个阳离子写在一起,如CaF 不能写成
Ca +[xF:], 要写成[:F×]-Ca +[xF:] 一。
(5)用电子式表示化合物形成过程时,由于不是化学方程式 ,不能出现
"="。“→”前是原子的电子式,“→”后是化合物的电子式。
【练一练】
8.下列电子式的书写正确的是(C)
A.氮 原 子 :N: B.O -离 子 : : 0 :
C.Na O :Na+[×O×]2-Na+D.CaCl :Ca +[:C1:]2
【练一练】
9、下列各数值表示有关元素的原子序数,能形成AB 型离子化 合物的是(D)
A.6与8 B.11与13 C.11 与16 D.12与17
10.下列用电子式表示化合物的形成过程错误的是(C )
A K.+.0.+·K→K*[:o:] -k+
B : .+·Ba+.c:→ [c:][Ba: tE:C:
1)原子、离子都要标出最外层电子,离子必须标明电荷
2)阴离子要用方括号括起来
3)相同的原子可以合并谢,相同的粒子要单个写(箭头 左边相同的微粒可以合并,箭头右边相同的微粒不可以 合并)
4)不能把“—>”写成“=“
带相反电荷的钠离子和氯离子,通过静电作用结合在一 起,从而形成与单质钠和氯气性质完全不同的氯化钠。 人们把这种带相反电荷粒子之间的相互作用叫离子键。 像氯化钠这样,由离子键构成的化合物叫做离子化合物
为方便起见,我们在元素符号周围用“。”或“×”表示原子的最外层 电子(价电子)。这种式子叫做电子式。
用电子式表示离子化 合物的形成过程注意 事项
离子键和离子化合物
课堂小结
化学键
电子式
