糖类 高二下化学人教版(2019)选择性必修3(共54张PPT)
文档属性
| 名称 | 糖类 高二下化学人教版(2019)选择性必修3(共54张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-10 11:57:03 | ||
图片预览








文档简介
(共54张PPT)
第四章生物大分子
第 一 节糖类
4.1.1-4.1.2原电池的工作原理及二次电池
学习目标
1、熟 知葡萄糖的结构和性质,学会葡萄糖的检验方法
2、知道常见的二糖(麦芽糖、蔗糖)、多糖(淀粉、纤维素)的性质, 学会淀粉的检验方法
1、减肥=运动+少吃碳水
碳水指的是哪一类物质 为什么把他们称为碳水化合物
思考
糖类化合物一般由碳、氢、氧三种元素组成,很多糖类分子 中氢原子和氧原子的数目比恰好为2:1,其组成可以用通式 Cm(H O)n来表示,如葡萄糖(C H O ) 、 蔗糖(C H O 1) 、 淀粉[(C H oO )n] 等,所以糖类化合物也被称为碳水化合物 2、定义
从分子结构上看,糖类是多羟基醛或多羟基酮和它们的脱水缩合物
一、糖类的组成和分类
1、组成
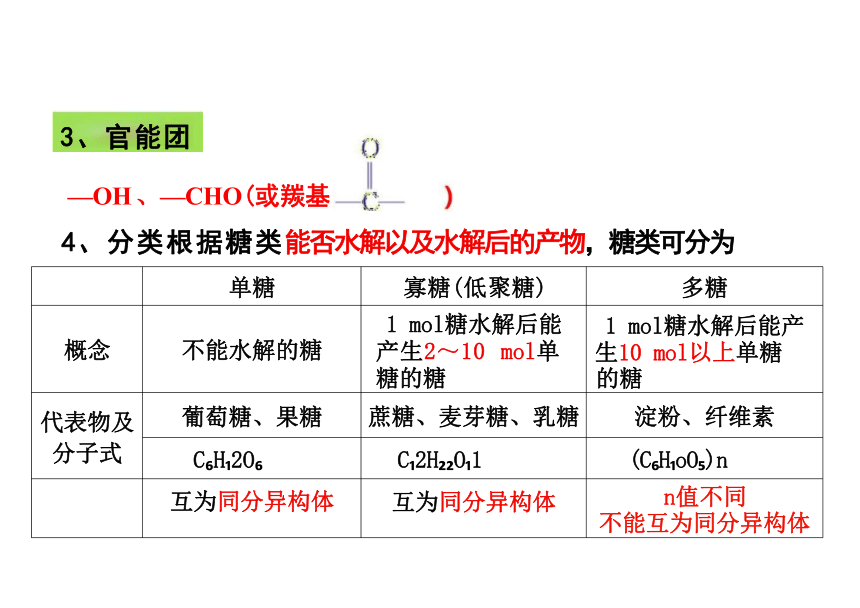
单糖 寡糖(低聚糖)
多糖
概念 不能水解的糖 1 mol糖水解后能 产生2~10 mol单 糖的糖
1 mol糖水解后能产 生10 mol以上单糖
的糖
代表物及 分子式 葡萄糖、果糖 蔗糖、麦芽糖、乳糖
淀粉、纤维素
C H 2O C 2H O 1
(C H oO )n
互为同分异构体 互为同分异构体
n值不同
不能互为同分异构体
—OH 、—CHO(或羰基
4、分类根据糖类能否水解以及水解后的产物,糖类可分为
3、官能团
①大多数糖类化合物的分子式可用通式一般为C(H O),m 与n 是可以 相同、也可以不同的正整数②糖类不一定均符合C (H O);组成,如: 脱氧核糖的分子式为C H O ③ 符合C. ( H O); 组成的物质不一定是糖 类,如:乙酸的分子式为C H O [或C (H O) ], 故碳水化合物表示糖 类并不准确④有甜味的不一定是糖,如:甘油、木糖醇等;没有甜味的 也可能是糖,如:淀粉、纤维素等。因此,糖类物质不完全属于碳水化 合物,也不等于甜味物质
⑤缩合 一般指两个或更多反应物生成一个主要产物,并伴随着失去H O 等小分子的反应。
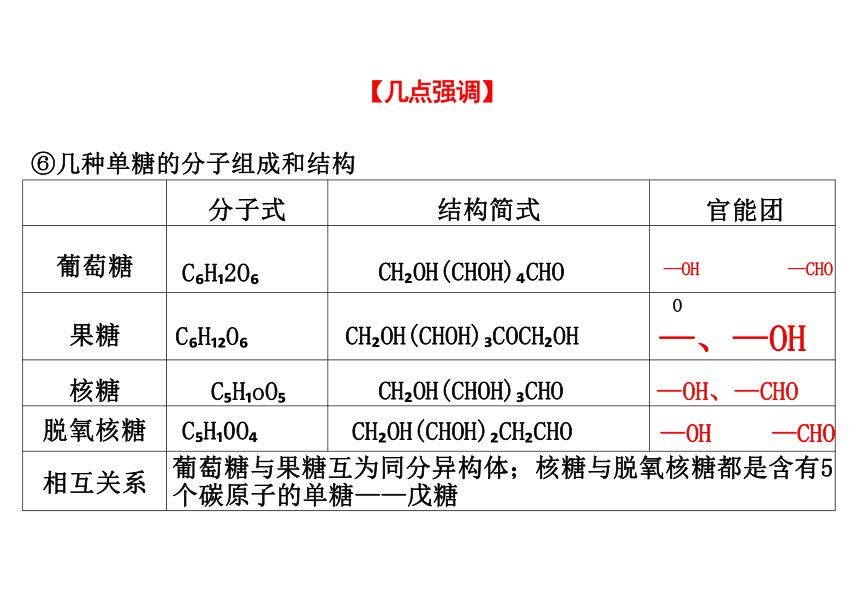
【几点强调】
分子式 结构简式
官能团
葡萄糖 C H 2O CH OH(CHOH) CHO
—OH —CHO
果糖 C H O CH OH(CHOH) COCH OH
O
—、—OH
核糖 C H oO CH OH(CHOH) CHO
—OH、—CHO
脱氧核糖 C H 0O CH OH(CHOH) CH CHO
—OH —CHO
相互关系 葡萄糖与果糖互为同分异构体;核糖与脱氧核糖都是含有5 个碳原子的单糖——戊糖
【几点强调】
⑥几种单糖的分子组成和结构
【练一练】
1、下列说法中正确的是( D )
A. 糖类物质的分子通式都可用Cm(H O)n来表示
B. 凡能溶于水且具有甜味的物质都属于糖类
C. 糖类都能发生水解反应
D. 糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物
2、现有下列物质:①纤维素②甲酸甲酯③淀粉④甲醛⑤丙 酸⑥乳酸⑦乙二醇⑧乙酸。其中符合Cm(H O)n的组成,但不 属于糖类的是( B )
A.②③④⑥ B.②④⑥⑧ C.①③④⑦ D.②③⑤⑧
①存在:葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花 中;动物的血液和淋巴液中也含有葡萄糖②物理性质:葡萄糖是易
溶于水的无色晶体,熔点为146℃,有甜味,但甜度不如蔗糖
二、常见的单糖
(1)存在与物理性质
1、葡萄糖
还原性糖
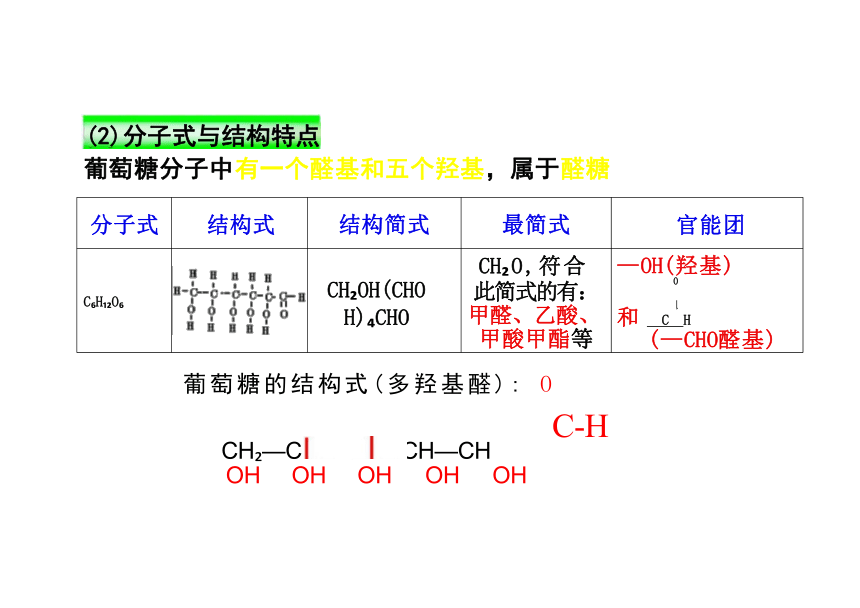
分子式 结构式 结构简式 最简式
官能团
C H O CH OH(CHO H) CHO CH O,符合 此简式的有: 甲醛、乙酸、 甲酸甲酯等
—OH(羟基)
0
和 C H
(—CHO醛基)
葡萄糖分子中有一个醛基和五个羟基,属于醛糖
CH —CH CH CH—CH
OH OH OH OH OH
葡萄糖的结构式(多羟基醛): O
(2)分子式与结构特点
C-H
一
葡萄糖分子中含有醛基和醇羟基,可发生加成、氧化、酯化等反应
①氧化反应——体现葡萄糖具有还原性
a.生理氧化或燃烧:
C H O +6O 酶 6CO +6H O
b. 被弱氧化剂银氨溶液或新制的Cu(OH)z氧化
(3)化学性质
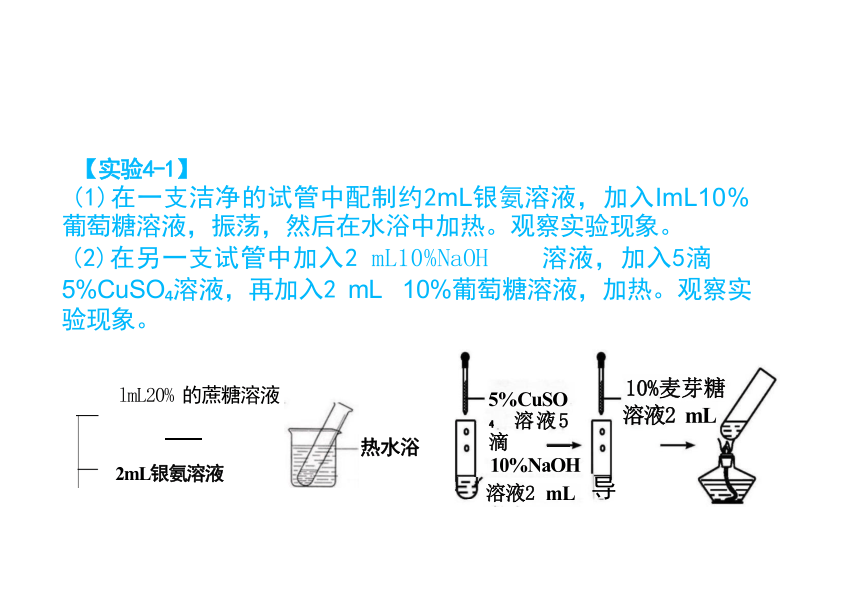
【实验4-1】
(1)在一支洁净的试管中配制约2mL银氨溶液,加入ImL10% 葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
(2)在另一支试管中加入2 mL10%NaOH 溶液,加入5滴
5%CuSO 溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实 验现象。
10%麦芽糖 溶液2 mL
导
10%NaOH
溶液2 mL
5%CuSO 溶液5滴
lmL20% 的蔗糖溶液
2mL银氨溶液
热水浴
光亮的银镜
砖红色沉淀
实验操作 I mL 10% 葡萄糖溶液 2 mL振荡 银氨溶液 70℃ 热水 5滴5% CuSO 溶液 2 mL 10%→ N a O H 溶 液
2 mL 10%
葡萄糖
溶液
实验现象 试 管 内 壁 出 现 光 亮 的 银 镜 生 成 砖 红 色 沉 淀 实验结论 葡萄糖(C H12O )分子中含有醛基,属于醛糖,有还 原性,属于还原糖
CH OH(CHOH) CHO+2Ag(NH ) OH 今
CH OH(CHOH) COONH +2Agl+3NH +H O
与新制Cu(OH) 反应
CH OH(CHOH) CHO+2Cu(OH) +NaOH 今
CH OH(CHOH) COONa+Cu Ol+3H O
c.使溴水和酸性高锰酸钾溶液褪色
银镜反应
④发酵成酒精 C H O 酒 化 酶 2C H OH+2CO
⑤动物体内无氧呼吸
②加成反应与H 加成生成醇
CH OH(CHOH) CHO+H →CH OH(CHOH) CH OH
I mol葡萄糖可以与5 mol 乙酸发生酯化反应
5CH COOH+CH OH (CHOH ) CHO
CH COOCH (CH COOCH) CHO+5H O
③酯化反应
浓硫酸
△
官能团 化学性质
实例
醛基 可以发生加成 反应
和H 反应生成直链正己六醇
可以发生氧 化反应
和银氨溶液,新制氢氧化铜反应反应,催化 氧化,使溴水褪色
羟基 与活泼金属反应 发生置换反应
将葡萄糖加热至熔化,可以和一些活泼金属反应 产 生 H
氧化反应
可发生催化氧化,使酸性高锰酸钾溶液褪色
取代反应
与HX反应
酯化反应和乙酸在一定条件下生成五乙酸葡萄糖酯
消去反应
分子内脱水
【几点强调】
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状
结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平 衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖 中的单糖单元多以环状结构的形式存在。
α-D- 吡喃葡萄糖 链状葡萄糖 β-D-吡喃葡萄糖
(4)葡萄糖的环状结构
葡糖糖用于制镜业、糖果制造业,还用于医药工业,葡糖糖可直 接被人体吸收。因此,体弱和血糖过低的患者可利用静脉注射葡 萄糖溶液的方式来迅速补充营养
(5)用途
制酒工业
镀银工业
2、葡萄糖溶液能否使酸性KMnO 溶液褪色
葡萄糖溶液能使酸性KMnO 溶液褪色,因为酸性
KMnO 溶液的氧化性比新制Cu(OH)2 和银氨溶液都强, 为强氧化剂。
3、丧失体内自我调节血糖水平的人会得糖尿病,病人的 尿液中含有葡萄糖,怎样通过实验检验一个病人是否患有 糖尿病
把NaOH 和CuSO 溶液加入某病人的尿液中微热,若观 察到有砖红色沉淀生成,说明该人患有糖尿病。
思考
①存在:果糖在水果和蜂蜜中含量较高,它比蔗糖的甜度高,广泛 应用于食品和医药的生产中
②物理性质:纯净的果糖为无色晶体,易溶于水,吸湿性强
(1)存在与物理性质
2、果糖
非还原性糖
分子式 结构简式 官能 团 类别
关系
葡萄 糖 C H 2 O CH OH(CHOH) C HO 羟 基 、 醛基 单糖
互为同分异 构体
果糖 C H 2 O O CH OH(CHOHD —C—CH OH 羟 基 、 酮基 单糖
果糖分子中有一个羰基和五个羟基,可发生加成、酯化反应
果糖分子中有一个羰基和五个羟基,属于酮糖
(3)果糖与葡萄糖的比较
(2)分子式与结构特点
(4)化学性质
溴水、高锰酸钾溶液,新制氢氧化铜溶液,新制银氨溶液等
4、怎么鉴别葡萄糖和果糖
思考
葡萄糖
果糖
还原性糖是指糖类能发生银镜反应或与新制的Cu(OH) 反 应生成 红色沉淀。反之;则为非还原性糖,如:葡萄糖是还原性糖,果 糖是非还原性糖
(5)还原性糖与非还原性糖
CH OH(CHOH) CHO 和CH OH(CHOH) CH CH O
核糖: H 、 0 脱氧核糖:C H O H 0
C C
H— C 一 OH H— C H
H— C- -OH H C— OH
0H
OH
H—C— OH H— C— OH
OH … OH 0
舌 o H C —OH OH H C OH
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RN A) 与 脱氧核糖 核酸(DNA)的重要组成部分。它们都是含有5个碳原子的单糖— — 戊 糖。均为醛糖,具有还原性,属于还原性糖。二者的结构简式分别为
3、核糖与脱氧核糖
C H oO
含有手性碳原子存在不能重叠、互为镜像的对映异构体的分子称手性 分子
头
CH —CH—CHO
OH OH
最简单的醛糖——丙醛糖,又称甘油醛,分 子 式 :C H O
在分子中连有4个不同的原子或原子团的碳原子叫做不对称碳原子, 也叫手性碳原子
4、糖类分子与手性
(1)手性碳原子
(2)手性分子
木糖醇 阿斯巴甜 糖精钠
不属于,有甜味的不一定是糖。
5、分析以上几种甜味剂的分子结构,判断其是否属于糖 类物质。
思考
6、连有4个不同的原子或原子团的碳原子叫做不对称 碳原子,也叫手性碳原子。试分析上述单糖分子分别有 几个手性碳原子
葡萄糖分子有4个,果糖分子有3个,核糖分子有3个,脱氧核糖分 子有2个。
思考
【练一练】
3、下列关于葡萄糖的叙述中,正确的是(A)
A. 葡萄糖具有多羟基醛结构,是最简单的一种糖类化合物
B. 葡萄糖具有多羟基酮结构,能发生加成反应
C. 因为葡萄糖具有甜味,所以属于糖类化合物
D. 葡萄糖分子中含有醛基,所以属于醛类化合物
4、有关葡萄糖与果糖的下列说法中,不正确的是(B)
①二者都易溶于水 ②二者都能发生银镜反应、都能与新制的
Cu(OH) 反应生成砖红色沉淀③二者互为同分异构体④葡萄糖 能发生酯化反应,而果糖不能⑤都能与H2 发生加成反应生成六元 醇 ⑥果糖是最甜的糖,而葡萄糖并不甜
A.①②③ B.④⑤ C.④⑥ D.⑥
(1)分子式:C H 2O
(2)物理性质:白色晶体,易溶于水,较难溶于乙醇,甜味仅次 于果糖
(3)存在:大多数植物体内(甜菜、甘蔗中含量最高)
(4)用途 甜 品
(5)化学性质:无醛基,无还原性,但水解产物有还原性
三、常见的二糖
1、蔗糖
①水解反应的条件:稀硫酸作催化剂,蔗糖水解实验需要用水浴加热 ②盛蔗糖溶液的试管要预先洗净,可先用NaOH 溶液洗涤,再用清水
洗净③水解产物中葡萄糖的检验:检验水解产物为葡萄糖时,一定要
先加NaOH 溶液中和作催化剂的稀硫酸,至溶液呈碱性后再加银氨溶 液或新制的Cu(OH)2悬浊液进行检验,否则实验会失败
蔗糖水解反应方程式:
中和液 液(O ) 产生砖红色沉淀↓
悬浊
新 制Cu
7、如何检验蔗糖水解后产生葡萄糖
蔗糖 稀硫酸
稀NaOH
呈弱碱性
思考
水解液
(1)分子式:C H O (与蔗糖同分异构)
(2)物理性质:白色晶体,易溶于水,有甜味,但甜味不如蔗糖
(3)存在:发芽的谷粒和麦芽中
(4)用途:甜味食品
(5 )化学性质:有醛基,有还原性,水解产物也有还原性
①有还原性:能发生银镜反应(分子中含有醛基),是还原性糖 ②水解反应(产物为葡萄糖一种)
C 2H 2O11+H O-
麦芽糖
2C H12O
葡萄糖
2、麦芽糖
酸或酶
实验内容 预期现象 实验现象
结论
【讨论】
(1)根据实验结果判断蔗糖和麦芽糖是否属于还原糖。
(2)操作过程中有哪些需要注意的地方
【实验探究】葡萄糖属于还原糖,蔗糖和麦芽糖是否属于还原糖
实验 内容 1mL20%的蔗糖溶液 2mL银氨溶液 热水浴
1mL20%的麦芽糖溶液
热水浴
2mL银氨溶液
实验 现象 无明显现象
试管内壁出现一层光亮银镜
实验 结论 蔗糖不属于还原糖,麦芽糖_属于还原糖
①用银氨溶液检验蔗糖和麦芽糖是否有还原性
实验 内容 5%CuSO 溶液5滴 10%NaOH 溶液2 mL 10%蔗糖 溶液2 mL 5%CuSO 溶液5滴 10%NaOH 溶液2 mL
10%麦芽糖
溶液2 mL
实验 现象 无明显现象 出现砖红色沉淀 实验 结论 蔗糖丕属于还原糖,麦芽糖_属于_还原糖
②用新制Cu(OH) 检验蔗糖和麦芽糖是否有还原性
8、根据实验结果判断蔗糖和麦芽糖是否属于还原糖。
蔗糖不属于还原糖,麦芽糖属于还原糖
9、操作过程中有哪些需要注意的地方
加入银氨溶液或者新制氢氧化铜溶液前,需要将溶液调节 至碱性,否则看不到准确的现象
讨论
蔗糖
麦芽糖
分子式 C12H22O11
C12H22O11
分子结构 分子中无醛基
分子中有醛基
互为同分异构体,都是二糖 化学性质 水解生成葡萄糖和果糖
水解生成葡萄糖
非还原性糖,与银氨溶液或新 制Cu(OH)2悬浊液不反应
还原性糖,与银氨溶液或新 制Cu(OH)2悬浊液反应
鉴别方法 向其溶液中分别加入银氨溶液,水浴加热,能发生银镜反 应的是麦芽糖,不能发生银镜反应的是蔗糖(也可用新制的 氢氧化铜悬浊液鉴别)
3、蔗糖和麦芽糖的结构与性质
【知识拓展】
为什么有人饮用牛奶后容易出现腹泻
乳糖是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿 食品、糖果、药物等的生产。
乳糖经发酵产生乳酸。部分人群由于肠道内缺乏乳糖酶导致乳糖消化 吸收障碍,饮用牛奶后容易出现腹胀、腹泻等乳糖不耐受的症状。
【练一练】
5、下列关于二糖的说法中不正确的是( C )
A. 蔗糖与麦芽糖互为同分异构体 B. 蔗糖与麦芽糖的分子
式都是C12H 2O11
C. 蔗糖与麦芽糖的水解产物完全相同 D. 麦芽糖能发生银镜反
应,蔗糖不能发生银镜反应
6、有关麦芽糖的下列叙述中,错误的是( C )
A. 麦芽糖易溶于水,有甜味 B. 麦芽糖能发生银镜
反应,是一种还原性糖
C. 1 mol麦芽糖水解得到1 mol 葡萄糖和1 mol 果糖 D. 麦芽糖和 蔗糖互为同分异构体
淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连 接组成,属于天然有机高分子;淀粉的相对分子质量可达到几十万, 纤维素可达到几百万;淀粉和纤维素的分子式可以表示为
(C H oO )n, 其中葡萄糖单元中一般仍有三个羟基,所以也可以表 示为[C H O (OH) ]n, 淀粉和纤维素分子中所包含的葡萄糖单元数
目 ,即n 值不同,二者的结构和组成不同,不是同分异构体
1、淀粉和纤维素的组成与结构
直链淀粉结构示意图 支链淀粉结构示意图 纤维素结构示意图
四、常见的多糖
①存在 :在种子、块根和块茎中含量丰富,谷类和薯类含淀粉较 多。天然淀粉由直链淀粉和支链淀粉组成。支链淀粉含量很高的 一些谷物,如糯米、糯玉米等有比较黏的口感②物理性质:淀粉 是自色粉末状物质,没有甜味,不溶于冷水。在热水中淀粉会部 分溶解,形成胶状的淀粉糊,淀粉胶体微粒不带电荷
(1)存在与物理性质
2、淀粉
(2)化学性质 淀粉属于非还原糖
①淀粉遇1,变蓝,可以用碘水检验淀粉。
②淀粉不能 被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
③酯化反应:分子中葡萄糖单元中有醇羟基,与羧酸发生酯化反应。
④ 在酸或酶的作用下水解,其水解反应方程式为:
酸或酶
(C H 0O )n +nH O nC H12O
淀粉 葡萄糖
10、如何判断的淀粉的水解程度呢
讨论
①实验原理
判断淀粉水解的程度时,要注意检验产物中是否生成葡萄糖,同 时还要确认淀粉是否水解完全。用银氨溶液或新制的Cu(OH) 和 碘水来检验淀粉是否发生了水解及水解是否完全
②实验步骤
现象B
碘水
水解液 中和液
(3)淀粉水解程度的判断
淀粉稀硫酸 溶液 微热
银氨溶液 水浴加热
NaOH溶液
→现象A
现象A 现象B
结论
① 未出现银镜 溶液变成蓝色
淀粉尚未水解
② 出现银镜 溶液变成蓝色
淀粉部分水解
③ 出现银镜 溶液不变蓝色
淀粉完全水解
现象B
碘水
水解液 → 中和液
淀粉稀硫酸 溶液 微热
银氨溶液 水浴加热
③ 实验现象和结论
NaOH溶液
现象A
11、上述实验,能否在加碘水之前,也加入氢氧化钠溶液
用I 检验淀粉时,应直接取水解后的混合液加碘水。若取 中和液加碘水,因I 与NaOH 溶液反应,影响淀粉的检验。
重要营养物质、食品工业原料,如:制备葡萄糖、酿制食醋、酿酒; 淀粉经酯化后可用于生产食品添加剂、表面活性剂和可降解塑料等。
讨 论
(4)用途
①存在:纤维素参与构成了植物的细胞壁,起着保护和支持作用。 如自然界中的棉、麻、木材、秸秆中存在大量纤维素
② 物理性质:纤维素是白色纤维状物 质 ,没有甜味,不溶于水, 也不溶于一般的有机溶剂
(1)存在与物理性质
3、纤维素
性糖
①酯化反应:可以与醋酸、硝酸发生酯化反应制备醋酸纤维、硝 酸纤维。
不与银氨溶液和新制的氢氧化铜反应,不显还原性,为非还原
亚麻布 人造丝
(2)化学性质
②纤维素的水解反应
【实验4-2】将一团脱脂棉放入干净试管中,加 馏水和 几滴浓硫酸,用玻璃棒将混合物搅成糊状。加入过量NaOH 溶 液夜调节至碱性,再滴入3滴5%新制氢氧化铜悬浊液,加热,观察
实验现象
现象:有砖红色沉淀生成
结 论 :纤维素在浓硫酸作用下发生了水解反应,生成了具有还原 性的物质。
纤维素的水解方程式:
(C H oO )n+nH O 酸或酶nC H 2O
纤维素 葡萄糖
淀粉
纤维素
物理 性质 白色粉末,没有甜味,不溶于冷水,在 热水中部分溶解,形成胶状的淀粉糊
白色纤维状结构,没有甜味,不溶 于水,也不溶于一般的有机溶剂
化学 性质 ①无还原性;②能水解生成葡萄糖; ③能发生酯化反应;④遇碘单质变蓝
①无还原性;②能水解生成葡萄糖
③能发生酯化反应
存在 光合作用的产物
构成植物细胞壁的物质
应用 经发酵可生产燃料乙醇、白酒、食醋、 味精、氨基酸、抗生素等,经酯化后 可用于生产食品添加剂、表面活性剂、 可降解塑料等
纺织、造纸工业的原料,制造纤维 素硝酸酯、纤维素乙酸酯和黏胶纤 维等
(3)淀粉和纤维素的对比
(4)应用①纤维素硝酸酯又称硝酸纤维,极易燃烧,可用于生产火 药、塑料和涂料等②纤维素乙酸酯又称醋酸纤维,不易燃烧,是一 种纺织工业原料,可用于生产塑料、过滤膜、胶片等。③黏胶纤维 是经化学处理后的纤维素,黏胶纤维中的长纤维一般称为人造丝, 短纤维称为人造棉,都可用于纺织工业
【注意】人体中不含消化纤维素的酶,故纤维素不能作为人类的营 养物质
(1)甲壳质是由乙酰氨基葡萄糖相互结合形成的一种多糖,是节 肢动物外壳的重要成分(2)壳聚糖是甲壳质在碱溶液中脱去乙酰 基,生成以氨基葡萄糖为单体的高聚物。可溶于酸溶液,具有 良好的生物相溶性和一定的抑菌作用
4、甲壳质与壳聚糖的形成
【练一练】
7.进行淀粉水解实验,同时检验水解是否完全和水解产物,除加入 淀粉和水之外,还需加入的试剂及加入顺序最好是( B )
A.碘水→NaOH溶液→新制Ca(OH) 悬浊液
B.H SO 溶液→碘水→NaOH溶液→新制Ca(OH) 悬浊液 C.H SO 溶液→NaOH溶液→碘水→新制Ca(OH) 悬浊液 D.H SO 溶液→碘水→新制Ca(OH)2 悬浊液
第四章生物大分子
第 一 节糖类
4.1.1-4.1.2原电池的工作原理及二次电池
学习目标
1、熟 知葡萄糖的结构和性质,学会葡萄糖的检验方法
2、知道常见的二糖(麦芽糖、蔗糖)、多糖(淀粉、纤维素)的性质, 学会淀粉的检验方法
1、减肥=运动+少吃碳水
碳水指的是哪一类物质 为什么把他们称为碳水化合物
思考
糖类化合物一般由碳、氢、氧三种元素组成,很多糖类分子 中氢原子和氧原子的数目比恰好为2:1,其组成可以用通式 Cm(H O)n来表示,如葡萄糖(C H O ) 、 蔗糖(C H O 1) 、 淀粉[(C H oO )n] 等,所以糖类化合物也被称为碳水化合物 2、定义
从分子结构上看,糖类是多羟基醛或多羟基酮和它们的脱水缩合物
一、糖类的组成和分类
1、组成
单糖 寡糖(低聚糖)
多糖
概念 不能水解的糖 1 mol糖水解后能 产生2~10 mol单 糖的糖
1 mol糖水解后能产 生10 mol以上单糖
的糖
代表物及 分子式 葡萄糖、果糖 蔗糖、麦芽糖、乳糖
淀粉、纤维素
C H 2O C 2H O 1
(C H oO )n
互为同分异构体 互为同分异构体
n值不同
不能互为同分异构体
—OH 、—CHO(或羰基
4、分类根据糖类能否水解以及水解后的产物,糖类可分为
3、官能团
①大多数糖类化合物的分子式可用通式一般为C(H O),m 与n 是可以 相同、也可以不同的正整数②糖类不一定均符合C (H O);组成,如: 脱氧核糖的分子式为C H O ③ 符合C. ( H O); 组成的物质不一定是糖 类,如:乙酸的分子式为C H O [或C (H O) ], 故碳水化合物表示糖 类并不准确④有甜味的不一定是糖,如:甘油、木糖醇等;没有甜味的 也可能是糖,如:淀粉、纤维素等。因此,糖类物质不完全属于碳水化 合物,也不等于甜味物质
⑤缩合 一般指两个或更多反应物生成一个主要产物,并伴随着失去H O 等小分子的反应。
【几点强调】
分子式 结构简式
官能团
葡萄糖 C H 2O CH OH(CHOH) CHO
—OH —CHO
果糖 C H O CH OH(CHOH) COCH OH
O
—、—OH
核糖 C H oO CH OH(CHOH) CHO
—OH、—CHO
脱氧核糖 C H 0O CH OH(CHOH) CH CHO
—OH —CHO
相互关系 葡萄糖与果糖互为同分异构体;核糖与脱氧核糖都是含有5 个碳原子的单糖——戊糖
【几点强调】
⑥几种单糖的分子组成和结构
【练一练】
1、下列说法中正确的是( D )
A. 糖类物质的分子通式都可用Cm(H O)n来表示
B. 凡能溶于水且具有甜味的物质都属于糖类
C. 糖类都能发生水解反应
D. 糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物
2、现有下列物质:①纤维素②甲酸甲酯③淀粉④甲醛⑤丙 酸⑥乳酸⑦乙二醇⑧乙酸。其中符合Cm(H O)n的组成,但不 属于糖类的是( B )
A.②③④⑥ B.②④⑥⑧ C.①③④⑦ D.②③⑤⑧
①存在:葡萄糖存在于水果、蜂蜜,以及植物的种子、叶、根、花 中;动物的血液和淋巴液中也含有葡萄糖②物理性质:葡萄糖是易
溶于水的无色晶体,熔点为146℃,有甜味,但甜度不如蔗糖
二、常见的单糖
(1)存在与物理性质
1、葡萄糖
还原性糖
分子式 结构式 结构简式 最简式
官能团
C H O CH OH(CHO H) CHO CH O,符合 此简式的有: 甲醛、乙酸、 甲酸甲酯等
—OH(羟基)
0
和 C H
(—CHO醛基)
葡萄糖分子中有一个醛基和五个羟基,属于醛糖
CH —CH CH CH—CH
OH OH OH OH OH
葡萄糖的结构式(多羟基醛): O
(2)分子式与结构特点
C-H
一
葡萄糖分子中含有醛基和醇羟基,可发生加成、氧化、酯化等反应
①氧化反应——体现葡萄糖具有还原性
a.生理氧化或燃烧:
C H O +6O 酶 6CO +6H O
b. 被弱氧化剂银氨溶液或新制的Cu(OH)z氧化
(3)化学性质
【实验4-1】
(1)在一支洁净的试管中配制约2mL银氨溶液,加入ImL10% 葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
(2)在另一支试管中加入2 mL10%NaOH 溶液,加入5滴
5%CuSO 溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实 验现象。
10%麦芽糖 溶液2 mL
导
10%NaOH
溶液2 mL
5%CuSO 溶液5滴
lmL20% 的蔗糖溶液
2mL银氨溶液
热水浴
光亮的银镜
砖红色沉淀
实验操作 I mL 10% 葡萄糖溶液 2 mL振荡 银氨溶液 70℃ 热水 5滴5% CuSO 溶液 2 mL 10%→ N a O H 溶 液
2 mL 10%
葡萄糖
溶液
实验现象 试 管 内 壁 出 现 光 亮 的 银 镜 生 成 砖 红 色 沉 淀 实验结论 葡萄糖(C H12O )分子中含有醛基,属于醛糖,有还 原性,属于还原糖
CH OH(CHOH) CHO+2Ag(NH ) OH 今
CH OH(CHOH) COONH +2Agl+3NH +H O
与新制Cu(OH) 反应
CH OH(CHOH) CHO+2Cu(OH) +NaOH 今
CH OH(CHOH) COONa+Cu Ol+3H O
c.使溴水和酸性高锰酸钾溶液褪色
银镜反应
④发酵成酒精 C H O 酒 化 酶 2C H OH+2CO
⑤动物体内无氧呼吸
②加成反应与H 加成生成醇
CH OH(CHOH) CHO+H →CH OH(CHOH) CH OH
I mol葡萄糖可以与5 mol 乙酸发生酯化反应
5CH COOH+CH OH (CHOH ) CHO
CH COOCH (CH COOCH) CHO+5H O
③酯化反应
浓硫酸
△
官能团 化学性质
实例
醛基 可以发生加成 反应
和H 反应生成直链正己六醇
可以发生氧 化反应
和银氨溶液,新制氢氧化铜反应反应,催化 氧化,使溴水褪色
羟基 与活泼金属反应 发生置换反应
将葡萄糖加热至熔化,可以和一些活泼金属反应 产 生 H
氧化反应
可发生催化氧化,使酸性高锰酸钾溶液褪色
取代反应
与HX反应
酯化反应和乙酸在一定条件下生成五乙酸葡萄糖酯
消去反应
分子内脱水
【几点强调】
葡萄糖分子中的醛基可以与分子内的羟基作用,形成两种六元环状
结构。在葡萄糖水溶液中,存在着链状和环状结构葡萄糖之间的平 衡,其中绝大部分葡萄糖为环状结构。很多单糖,以及寡糖和多糖 中的单糖单元多以环状结构的形式存在。
α-D- 吡喃葡萄糖 链状葡萄糖 β-D-吡喃葡萄糖
(4)葡萄糖的环状结构
葡糖糖用于制镜业、糖果制造业,还用于医药工业,葡糖糖可直 接被人体吸收。因此,体弱和血糖过低的患者可利用静脉注射葡 萄糖溶液的方式来迅速补充营养
(5)用途
制酒工业
镀银工业
2、葡萄糖溶液能否使酸性KMnO 溶液褪色
葡萄糖溶液能使酸性KMnO 溶液褪色,因为酸性
KMnO 溶液的氧化性比新制Cu(OH)2 和银氨溶液都强, 为强氧化剂。
3、丧失体内自我调节血糖水平的人会得糖尿病,病人的 尿液中含有葡萄糖,怎样通过实验检验一个病人是否患有 糖尿病
把NaOH 和CuSO 溶液加入某病人的尿液中微热,若观 察到有砖红色沉淀生成,说明该人患有糖尿病。
思考
①存在:果糖在水果和蜂蜜中含量较高,它比蔗糖的甜度高,广泛 应用于食品和医药的生产中
②物理性质:纯净的果糖为无色晶体,易溶于水,吸湿性强
(1)存在与物理性质
2、果糖
非还原性糖
分子式 结构简式 官能 团 类别
关系
葡萄 糖 C H 2 O CH OH(CHOH) C HO 羟 基 、 醛基 单糖
互为同分异 构体
果糖 C H 2 O O CH OH(CHOHD —C—CH OH 羟 基 、 酮基 单糖
果糖分子中有一个羰基和五个羟基,可发生加成、酯化反应
果糖分子中有一个羰基和五个羟基,属于酮糖
(3)果糖与葡萄糖的比较
(2)分子式与结构特点
(4)化学性质
溴水、高锰酸钾溶液,新制氢氧化铜溶液,新制银氨溶液等
4、怎么鉴别葡萄糖和果糖
思考
葡萄糖
果糖
还原性糖是指糖类能发生银镜反应或与新制的Cu(OH) 反 应生成 红色沉淀。反之;则为非还原性糖,如:葡萄糖是还原性糖,果 糖是非还原性糖
(5)还原性糖与非还原性糖
CH OH(CHOH) CHO 和CH OH(CHOH) CH CH O
核糖: H 、 0 脱氧核糖:C H O H 0
C C
H— C 一 OH H— C H
H— C- -OH H C— OH
0H
OH
H—C— OH H— C— OH
OH … OH 0
舌 o H C —OH OH H C OH
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RN A) 与 脱氧核糖 核酸(DNA)的重要组成部分。它们都是含有5个碳原子的单糖— — 戊 糖。均为醛糖,具有还原性,属于还原性糖。二者的结构简式分别为
3、核糖与脱氧核糖
C H oO
含有手性碳原子存在不能重叠、互为镜像的对映异构体的分子称手性 分子
头
CH —CH—CHO
OH OH
最简单的醛糖——丙醛糖,又称甘油醛,分 子 式 :C H O
在分子中连有4个不同的原子或原子团的碳原子叫做不对称碳原子, 也叫手性碳原子
4、糖类分子与手性
(1)手性碳原子
(2)手性分子
木糖醇 阿斯巴甜 糖精钠
不属于,有甜味的不一定是糖。
5、分析以上几种甜味剂的分子结构,判断其是否属于糖 类物质。
思考
6、连有4个不同的原子或原子团的碳原子叫做不对称 碳原子,也叫手性碳原子。试分析上述单糖分子分别有 几个手性碳原子
葡萄糖分子有4个,果糖分子有3个,核糖分子有3个,脱氧核糖分 子有2个。
思考
【练一练】
3、下列关于葡萄糖的叙述中,正确的是(A)
A. 葡萄糖具有多羟基醛结构,是最简单的一种糖类化合物
B. 葡萄糖具有多羟基酮结构,能发生加成反应
C. 因为葡萄糖具有甜味,所以属于糖类化合物
D. 葡萄糖分子中含有醛基,所以属于醛类化合物
4、有关葡萄糖与果糖的下列说法中,不正确的是(B)
①二者都易溶于水 ②二者都能发生银镜反应、都能与新制的
Cu(OH) 反应生成砖红色沉淀③二者互为同分异构体④葡萄糖 能发生酯化反应,而果糖不能⑤都能与H2 发生加成反应生成六元 醇 ⑥果糖是最甜的糖,而葡萄糖并不甜
A.①②③ B.④⑤ C.④⑥ D.⑥
(1)分子式:C H 2O
(2)物理性质:白色晶体,易溶于水,较难溶于乙醇,甜味仅次 于果糖
(3)存在:大多数植物体内(甜菜、甘蔗中含量最高)
(4)用途 甜 品
(5)化学性质:无醛基,无还原性,但水解产物有还原性
三、常见的二糖
1、蔗糖
①水解反应的条件:稀硫酸作催化剂,蔗糖水解实验需要用水浴加热 ②盛蔗糖溶液的试管要预先洗净,可先用NaOH 溶液洗涤,再用清水
洗净③水解产物中葡萄糖的检验:检验水解产物为葡萄糖时,一定要
先加NaOH 溶液中和作催化剂的稀硫酸,至溶液呈碱性后再加银氨溶 液或新制的Cu(OH)2悬浊液进行检验,否则实验会失败
蔗糖水解反应方程式:
中和液 液(O ) 产生砖红色沉淀↓
悬浊
新 制Cu
7、如何检验蔗糖水解后产生葡萄糖
蔗糖 稀硫酸
稀NaOH
呈弱碱性
思考
水解液
(1)分子式:C H O (与蔗糖同分异构)
(2)物理性质:白色晶体,易溶于水,有甜味,但甜味不如蔗糖
(3)存在:发芽的谷粒和麦芽中
(4)用途:甜味食品
(5 )化学性质:有醛基,有还原性,水解产物也有还原性
①有还原性:能发生银镜反应(分子中含有醛基),是还原性糖 ②水解反应(产物为葡萄糖一种)
C 2H 2O11+H O-
麦芽糖
2C H12O
葡萄糖
2、麦芽糖
酸或酶
实验内容 预期现象 实验现象
结论
【讨论】
(1)根据实验结果判断蔗糖和麦芽糖是否属于还原糖。
(2)操作过程中有哪些需要注意的地方
【实验探究】葡萄糖属于还原糖,蔗糖和麦芽糖是否属于还原糖
实验 内容 1mL20%的蔗糖溶液 2mL银氨溶液 热水浴
1mL20%的麦芽糖溶液
热水浴
2mL银氨溶液
实验 现象 无明显现象
试管内壁出现一层光亮银镜
实验 结论 蔗糖不属于还原糖,麦芽糖_属于还原糖
①用银氨溶液检验蔗糖和麦芽糖是否有还原性
实验 内容 5%CuSO 溶液5滴 10%NaOH 溶液2 mL 10%蔗糖 溶液2 mL 5%CuSO 溶液5滴 10%NaOH 溶液2 mL
10%麦芽糖
溶液2 mL
实验 现象 无明显现象 出现砖红色沉淀 实验 结论 蔗糖丕属于还原糖,麦芽糖_属于_还原糖
②用新制Cu(OH) 检验蔗糖和麦芽糖是否有还原性
8、根据实验结果判断蔗糖和麦芽糖是否属于还原糖。
蔗糖不属于还原糖,麦芽糖属于还原糖
9、操作过程中有哪些需要注意的地方
加入银氨溶液或者新制氢氧化铜溶液前,需要将溶液调节 至碱性,否则看不到准确的现象
讨论
蔗糖
麦芽糖
分子式 C12H22O11
C12H22O11
分子结构 分子中无醛基
分子中有醛基
互为同分异构体,都是二糖 化学性质 水解生成葡萄糖和果糖
水解生成葡萄糖
非还原性糖,与银氨溶液或新 制Cu(OH)2悬浊液不反应
还原性糖,与银氨溶液或新 制Cu(OH)2悬浊液反应
鉴别方法 向其溶液中分别加入银氨溶液,水浴加热,能发生银镜反 应的是麦芽糖,不能发生银镜反应的是蔗糖(也可用新制的 氢氧化铜悬浊液鉴别)
3、蔗糖和麦芽糖的结构与性质
【知识拓展】
为什么有人饮用牛奶后容易出现腹泻
乳糖是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿 食品、糖果、药物等的生产。
乳糖经发酵产生乳酸。部分人群由于肠道内缺乏乳糖酶导致乳糖消化 吸收障碍,饮用牛奶后容易出现腹胀、腹泻等乳糖不耐受的症状。
【练一练】
5、下列关于二糖的说法中不正确的是( C )
A. 蔗糖与麦芽糖互为同分异构体 B. 蔗糖与麦芽糖的分子
式都是C12H 2O11
C. 蔗糖与麦芽糖的水解产物完全相同 D. 麦芽糖能发生银镜反
应,蔗糖不能发生银镜反应
6、有关麦芽糖的下列叙述中,错误的是( C )
A. 麦芽糖易溶于水,有甜味 B. 麦芽糖能发生银镜
反应,是一种还原性糖
C. 1 mol麦芽糖水解得到1 mol 葡萄糖和1 mol 果糖 D. 麦芽糖和 蔗糖互为同分异构体
淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连 接组成,属于天然有机高分子;淀粉的相对分子质量可达到几十万, 纤维素可达到几百万;淀粉和纤维素的分子式可以表示为
(C H oO )n, 其中葡萄糖单元中一般仍有三个羟基,所以也可以表 示为[C H O (OH) ]n, 淀粉和纤维素分子中所包含的葡萄糖单元数
目 ,即n 值不同,二者的结构和组成不同,不是同分异构体
1、淀粉和纤维素的组成与结构
直链淀粉结构示意图 支链淀粉结构示意图 纤维素结构示意图
四、常见的多糖
①存在 :在种子、块根和块茎中含量丰富,谷类和薯类含淀粉较 多。天然淀粉由直链淀粉和支链淀粉组成。支链淀粉含量很高的 一些谷物,如糯米、糯玉米等有比较黏的口感②物理性质:淀粉 是自色粉末状物质,没有甜味,不溶于冷水。在热水中淀粉会部 分溶解,形成胶状的淀粉糊,淀粉胶体微粒不带电荷
(1)存在与物理性质
2、淀粉
(2)化学性质 淀粉属于非还原糖
①淀粉遇1,变蓝,可以用碘水检验淀粉。
②淀粉不能 被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖。
③酯化反应:分子中葡萄糖单元中有醇羟基,与羧酸发生酯化反应。
④ 在酸或酶的作用下水解,其水解反应方程式为:
酸或酶
(C H 0O )n +nH O nC H12O
淀粉 葡萄糖
10、如何判断的淀粉的水解程度呢
讨论
①实验原理
判断淀粉水解的程度时,要注意检验产物中是否生成葡萄糖,同 时还要确认淀粉是否水解完全。用银氨溶液或新制的Cu(OH) 和 碘水来检验淀粉是否发生了水解及水解是否完全
②实验步骤
现象B
碘水
水解液 中和液
(3)淀粉水解程度的判断
淀粉稀硫酸 溶液 微热
银氨溶液 水浴加热
NaOH溶液
→现象A
现象A 现象B
结论
① 未出现银镜 溶液变成蓝色
淀粉尚未水解
② 出现银镜 溶液变成蓝色
淀粉部分水解
③ 出现银镜 溶液不变蓝色
淀粉完全水解
现象B
碘水
水解液 → 中和液
淀粉稀硫酸 溶液 微热
银氨溶液 水浴加热
③ 实验现象和结论
NaOH溶液
现象A
11、上述实验,能否在加碘水之前,也加入氢氧化钠溶液
用I 检验淀粉时,应直接取水解后的混合液加碘水。若取 中和液加碘水,因I 与NaOH 溶液反应,影响淀粉的检验。
重要营养物质、食品工业原料,如:制备葡萄糖、酿制食醋、酿酒; 淀粉经酯化后可用于生产食品添加剂、表面活性剂和可降解塑料等。
讨 论
(4)用途
①存在:纤维素参与构成了植物的细胞壁,起着保护和支持作用。 如自然界中的棉、麻、木材、秸秆中存在大量纤维素
② 物理性质:纤维素是白色纤维状物 质 ,没有甜味,不溶于水, 也不溶于一般的有机溶剂
(1)存在与物理性质
3、纤维素
性糖
①酯化反应:可以与醋酸、硝酸发生酯化反应制备醋酸纤维、硝 酸纤维。
不与银氨溶液和新制的氢氧化铜反应,不显还原性,为非还原
亚麻布 人造丝
(2)化学性质
②纤维素的水解反应
【实验4-2】将一团脱脂棉放入干净试管中,加 馏水和 几滴浓硫酸,用玻璃棒将混合物搅成糊状。加入过量NaOH 溶 液夜调节至碱性,再滴入3滴5%新制氢氧化铜悬浊液,加热,观察
实验现象
现象:有砖红色沉淀生成
结 论 :纤维素在浓硫酸作用下发生了水解反应,生成了具有还原 性的物质。
纤维素的水解方程式:
(C H oO )n+nH O 酸或酶nC H 2O
纤维素 葡萄糖
淀粉
纤维素
物理 性质 白色粉末,没有甜味,不溶于冷水,在 热水中部分溶解,形成胶状的淀粉糊
白色纤维状结构,没有甜味,不溶 于水,也不溶于一般的有机溶剂
化学 性质 ①无还原性;②能水解生成葡萄糖; ③能发生酯化反应;④遇碘单质变蓝
①无还原性;②能水解生成葡萄糖
③能发生酯化反应
存在 光合作用的产物
构成植物细胞壁的物质
应用 经发酵可生产燃料乙醇、白酒、食醋、 味精、氨基酸、抗生素等,经酯化后 可用于生产食品添加剂、表面活性剂、 可降解塑料等
纺织、造纸工业的原料,制造纤维 素硝酸酯、纤维素乙酸酯和黏胶纤 维等
(3)淀粉和纤维素的对比
(4)应用①纤维素硝酸酯又称硝酸纤维,极易燃烧,可用于生产火 药、塑料和涂料等②纤维素乙酸酯又称醋酸纤维,不易燃烧,是一 种纺织工业原料,可用于生产塑料、过滤膜、胶片等。③黏胶纤维 是经化学处理后的纤维素,黏胶纤维中的长纤维一般称为人造丝, 短纤维称为人造棉,都可用于纺织工业
【注意】人体中不含消化纤维素的酶,故纤维素不能作为人类的营 养物质
(1)甲壳质是由乙酰氨基葡萄糖相互结合形成的一种多糖,是节 肢动物外壳的重要成分(2)壳聚糖是甲壳质在碱溶液中脱去乙酰 基,生成以氨基葡萄糖为单体的高聚物。可溶于酸溶液,具有 良好的生物相溶性和一定的抑菌作用
4、甲壳质与壳聚糖的形成
【练一练】
7.进行淀粉水解实验,同时检验水解是否完全和水解产物,除加入 淀粉和水之外,还需加入的试剂及加入顺序最好是( B )
A.碘水→NaOH溶液→新制Ca(OH) 悬浊液
B.H SO 溶液→碘水→NaOH溶液→新制Ca(OH) 悬浊液 C.H SO 溶液→NaOH溶液→碘水→新制Ca(OH) 悬浊液 D.H SO 溶液→碘水→新制Ca(OH)2 悬浊液
