1.3 课时2 氧化剂与还原剂 课件(共28张PPT) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 1.3 课时2 氧化剂与还原剂 课件(共28张PPT) 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 15:28:42 | ||
图片预览





文档简介
(共28张PPT)
氧化剂与还原剂
第一章 物质及其变化
1.能够根据化学反应中元素化合价的变化判断氧化剂和还原剂,能根据物质的化学式快速判断物质中元素的化合价,并根据物质中某些元素的化合价预测物质的氧化性或还原性
2.通过提炼氧化还原反应的模型,发展学生对氧化还原反应的认识进阶和思路的结构化。
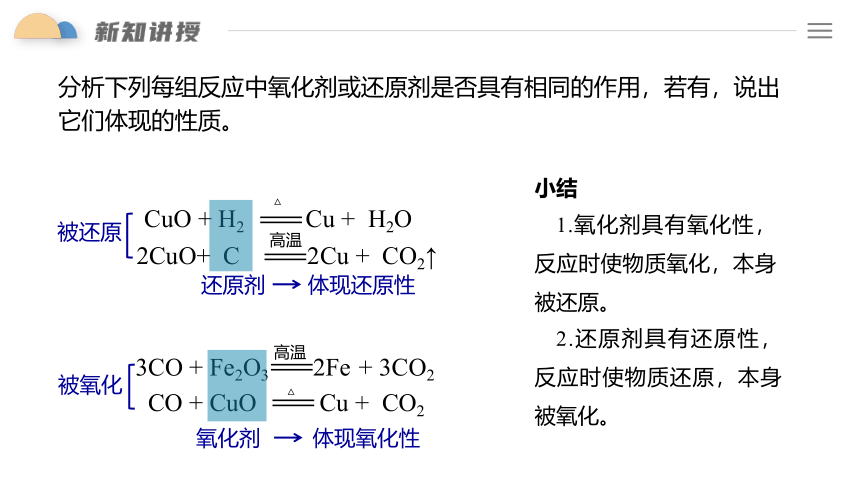
CuO + H2 Cu + H2O
△
高温
2CuO+ C 2Cu + CO2↑
还原剂
被还原
体现还原性
分析下列每组反应中氧化剂或还原剂是否具有相同的作用,若有,说出它们体现的性质。
3CO + Fe2O3 2Fe + 3CO2
高温
CO + CuO Cu + CO2
△
氧化剂
被氧化
体现氧化性
小结
1.氧化剂具有氧化性,反应时使物质氧化,本身被还原。
2.还原剂具有还原性,反应时使物质还原,本身被氧化。
猜一猜:镁能在CO2中燃烧吗?
2Mg + CO2 2MgO + C
点燃
白色
黑色
回忆上节课所学,判断镁与CO2的反应是氧化还原反应,画出双线桥,并指出谁是氧化剂,谁是还原剂
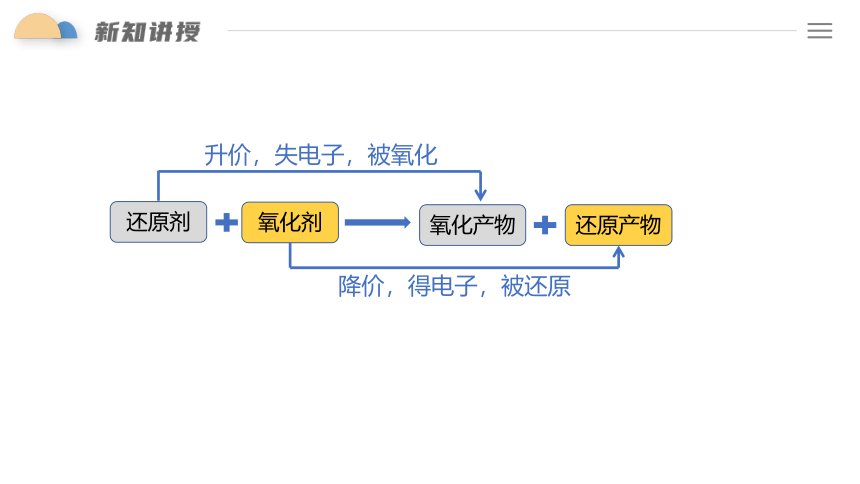
氧化剂
还原剂
还原产物
氧化产物
升价,失电子,被氧化
降价,得电子,被还原
1.下列物质之间的转化,需要加入还原剂才能实现的是( )
A.Fe2O3→Fe
B.Cu→Cu(NO3)2
C.SO2→H2SO4
D.CO→CO2
A
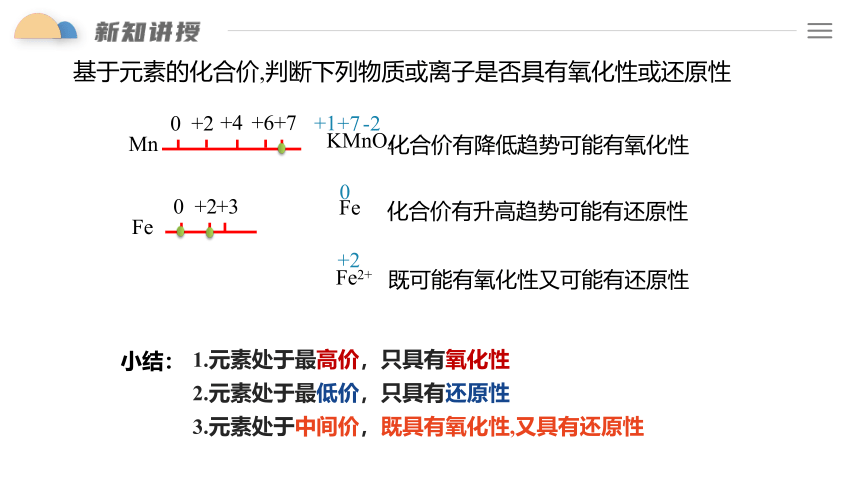
KMnO4
+7
化合价有降低趋势可能有氧化性
0
+2
+6
Mn
+4
+7
+1
-2
基于元素的化合价,判断下列物质或离子是否具有氧化性或还原性
Fe
0
Fe2+
+2
化合价有升高趋势可能有还原性
既可能有氧化性又可能有还原性
0
+2
Fe
+3
1.元素处于最高价,只具有氧化性
2.元素处于最低价,只具有还原性
3.元素处于中间价,既具有氧化性,又具有还原性
小结:
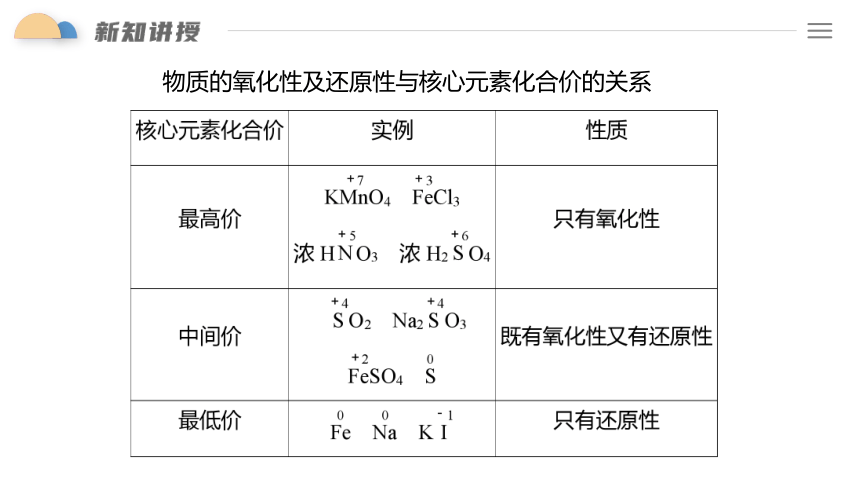
物质的氧化性及还原性与核心元素化合价的关系
常见氧化剂和还原剂
氧化剂 还原剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
O2、Cl2、Br2
Na、Fe、H2、C
MnO2、CO2
CO、SO2
FeCl3、KMnO4
FeSO4、Na2SO3
HNO3、浓硫酸
H2SO3
HCl
H2S、HCl
两类特殊的氧化还原反应
1、归中反应
不同价态的同一元素化合价可升高或降低至某一中间价态。
规律:高价+低价→相同中间价
(注“只靠拢、不相交”)
分析下列氧化还原反应中电子转移的方向和数目,并判断氧化产物和还原产物。
(1)H2S+H2SO4(浓)====S +SO2 +2H2O
(2)KClO3+6HCl====KCl+3Cl2 +3H2O
(1) H2S+H2SO4(浓)====S + SO2 + 2H2O (A)
-2
+6
0
+4
得6 ×e-
失6 × e-
H2S+H2SO4(浓)====S +SO2 +2H2O (B)
-2
+6
0
+4
得2e-
失2 × e-
(2) KClO3+6HCl====KCl+3Cl2 +3H2O (A)
+5
0
-1
-1
得6 ×e-
KClO3+6HCl====KCl+3Cl2 +3H2O (B)
+5
0
-1
-1
失5 ×e-
得5 ×e-
失6 ×e-
两类特殊的氧化还原反应
2、歧化反应
同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应
例1、 Cl2+2NaOH==NaCl+NaClO+H2O
例2、2H2O2 === 2H2O + O2
MnO2
应用1:维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将从食物中获取的、不易被吸收的Fe3+转变为易被吸收的Fe2+,这说明维生素C具有
(填“氧化性”或“还原性”)
还原性
应用2:分析下列反应,你对盐酸的化学性质有了哪些新的认识?
体现还原性和酸性
体现氧化性
既体现氧化性又体现还原性
①MnO2 + 4HCl(浓) MnCl2 + Cl2 + 2H2O
②Zn + 2HCl ZnCl2 + H2
③2HCl Cl2 + H2
△
电解
在一定条件下,盐酸与不同性质的物质发生反应时,盐酸体现的性质可能不同。
判断物质氧化性和还原性强弱
1.根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物还原性:还原剂>还原产物
判断物质氧化性和还原性强弱
2.根据元素的活动性顺序比较
5.由元素的价态比较:
具有变价的元素,一般价态越高,氧化性越强;价态越低,还原性越强
氧化性:Fe3+>Fe2+,S(+6)>S(+4)>S(0).特例:HClO>HClO2>HClO3>HClO4(氧化性)
还原性:I->I2 ,H2S>SO2
2.已知常温下,在溶液中发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O、②2A2++B2=2A3++2B-、③2B-+Z2=B2+2Z-,由此推断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行
B.Z元素在反应③中被氧化,在反应①中被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
B
氧化还原配平步骤
标变价
列得失
等升降
标出变价元素的化合价
列出化合价的变化值
最小公倍数法配平使化合价升降总数相等
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
正向配平
___KI+___ KIO3 +___H2SO4 — ___l2+ ___K2SO4+___H2O
___KMnO4+___HCl — ___MnCl2+ ___KCl+___Cl2↑+___H2O
__Cu2S+__HNO3(稀)— __Cu(NO3)2+__NO↑ +__H2SO4+__H2O
逆向配平
__S +__KOH — __K2S +__K2SO3 +__H2O
__P4 +__KOH +__H2O— __K3PO4 +__PH3
缺项配平
__H2O2 + __MnO4- + ____= __ Mn2+ + __ O2 ↑ + __ H2O
__ClO- + __Fe(OH)3 + ____= __ Cl- + __ FeO42- + __ H2O
反应物
氧化剂
还原剂
发生还原反应(被还原)
还原产物
生成物
(具有氧化性)
得电子(化合价降低)
(具有还原性)
发生氧化反应(被氧化)
失电子(化合价升高)
氧化产物
(具有还原性)
(具有氧化性)
1、氧化剂、还原剂均是反应物;还原产物、氧化产物均是生成物。
2、氧化剂、氧化产物具有氧化性;还原剂、还原产物具有还原性。
3.把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离子方程式的说法正确的是( )
A.配平后的化学计量数依次为3、1、2、6、3
B.若有1个S原子被氧化,则生成2个S2-
C.氧化剂与还原剂的原子数目之比为1∶2
D.3个S原子参加反应有8个电子发生转移
B
4.Ⅰ.近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:
(1)完成并配平上述反应的化学方程式。
此反应的氧化剂是_______,被氧化的元素是________。
Ⅱ.把通入浓氨水中,发生如下反应:
发生化学反应的与的分子数之比为:_____________ ,反应中发生电子转移的与的分子数之比为: _______________。
写出在溶液中的电离方程式 ___________________,在其溶液中分散质粒子的直径范围为_________。
若反应中有克氨发生氧化反应,则反应中有生成氮气的质量为 _________。
3:8
3:2
小于1nm
氧化剂与还原剂
第一章 物质及其变化
1.能够根据化学反应中元素化合价的变化判断氧化剂和还原剂,能根据物质的化学式快速判断物质中元素的化合价,并根据物质中某些元素的化合价预测物质的氧化性或还原性
2.通过提炼氧化还原反应的模型,发展学生对氧化还原反应的认识进阶和思路的结构化。
CuO + H2 Cu + H2O
△
高温
2CuO+ C 2Cu + CO2↑
还原剂
被还原
体现还原性
分析下列每组反应中氧化剂或还原剂是否具有相同的作用,若有,说出它们体现的性质。
3CO + Fe2O3 2Fe + 3CO2
高温
CO + CuO Cu + CO2
△
氧化剂
被氧化
体现氧化性
小结
1.氧化剂具有氧化性,反应时使物质氧化,本身被还原。
2.还原剂具有还原性,反应时使物质还原,本身被氧化。
猜一猜:镁能在CO2中燃烧吗?
2Mg + CO2 2MgO + C
点燃
白色
黑色
回忆上节课所学,判断镁与CO2的反应是氧化还原反应,画出双线桥,并指出谁是氧化剂,谁是还原剂
氧化剂
还原剂
还原产物
氧化产物
升价,失电子,被氧化
降价,得电子,被还原
1.下列物质之间的转化,需要加入还原剂才能实现的是( )
A.Fe2O3→Fe
B.Cu→Cu(NO3)2
C.SO2→H2SO4
D.CO→CO2
A
KMnO4
+7
化合价有降低趋势可能有氧化性
0
+2
+6
Mn
+4
+7
+1
-2
基于元素的化合价,判断下列物质或离子是否具有氧化性或还原性
Fe
0
Fe2+
+2
化合价有升高趋势可能有还原性
既可能有氧化性又可能有还原性
0
+2
Fe
+3
1.元素处于最高价,只具有氧化性
2.元素处于最低价,只具有还原性
3.元素处于中间价,既具有氧化性,又具有还原性
小结:
物质的氧化性及还原性与核心元素化合价的关系
常见氧化剂和还原剂
氧化剂 还原剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
O2、Cl2、Br2
Na、Fe、H2、C
MnO2、CO2
CO、SO2
FeCl3、KMnO4
FeSO4、Na2SO3
HNO3、浓硫酸
H2SO3
HCl
H2S、HCl
两类特殊的氧化还原反应
1、归中反应
不同价态的同一元素化合价可升高或降低至某一中间价态。
规律:高价+低价→相同中间价
(注“只靠拢、不相交”)
分析下列氧化还原反应中电子转移的方向和数目,并判断氧化产物和还原产物。
(1)H2S+H2SO4(浓)====S +SO2 +2H2O
(2)KClO3+6HCl====KCl+3Cl2 +3H2O
(1) H2S+H2SO4(浓)====S + SO2 + 2H2O (A)
-2
+6
0
+4
得6 ×e-
失6 × e-
H2S+H2SO4(浓)====S +SO2 +2H2O (B)
-2
+6
0
+4
得2e-
失2 × e-
(2) KClO3+6HCl====KCl+3Cl2 +3H2O (A)
+5
0
-1
-1
得6 ×e-
KClO3+6HCl====KCl+3Cl2 +3H2O (B)
+5
0
-1
-1
失5 ×e-
得5 ×e-
失6 ×e-
两类特殊的氧化还原反应
2、歧化反应
同种物质中同种价态的同种元素一部分被氧化、一部分被还原的反应称为歧化反应
例1、 Cl2+2NaOH==NaCl+NaClO+H2O
例2、2H2O2 === 2H2O + O2
MnO2
应用1:维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将从食物中获取的、不易被吸收的Fe3+转变为易被吸收的Fe2+,这说明维生素C具有
(填“氧化性”或“还原性”)
还原性
应用2:分析下列反应,你对盐酸的化学性质有了哪些新的认识?
体现还原性和酸性
体现氧化性
既体现氧化性又体现还原性
①MnO2 + 4HCl(浓) MnCl2 + Cl2 + 2H2O
②Zn + 2HCl ZnCl2 + H2
③2HCl Cl2 + H2
△
电解
在一定条件下,盐酸与不同性质的物质发生反应时,盐酸体现的性质可能不同。
判断物质氧化性和还原性强弱
1.根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物还原性:还原剂>还原产物
判断物质氧化性和还原性强弱
2.根据元素的活动性顺序比较
5.由元素的价态比较:
具有变价的元素,一般价态越高,氧化性越强;价态越低,还原性越强
氧化性:Fe3+>Fe2+,S(+6)>S(+4)>S(0).特例:HClO>HClO2>HClO3>HClO4(氧化性)
还原性:I->I2 ,H2S>SO2
2.已知常温下,在溶液中发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O、②2A2++B2=2A3++2B-、③2B-+Z2=B2+2Z-,由此推断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行
B.Z元素在反应③中被氧化,在反应①中被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
B
氧化还原配平步骤
标变价
列得失
等升降
标出变价元素的化合价
列出化合价的变化值
最小公倍数法配平使化合价升降总数相等
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
正向配平
___KI+___ KIO3 +___H2SO4 — ___l2+ ___K2SO4+___H2O
___KMnO4+___HCl — ___MnCl2+ ___KCl+___Cl2↑+___H2O
__Cu2S+__HNO3(稀)— __Cu(NO3)2+__NO↑ +__H2SO4+__H2O
逆向配平
__S +__KOH — __K2S +__K2SO3 +__H2O
__P4 +__KOH +__H2O— __K3PO4 +__PH3
缺项配平
__H2O2 + __MnO4- + ____= __ Mn2+ + __ O2 ↑ + __ H2O
__ClO- + __Fe(OH)3 + ____= __ Cl- + __ FeO42- + __ H2O
反应物
氧化剂
还原剂
发生还原反应(被还原)
还原产物
生成物
(具有氧化性)
得电子(化合价降低)
(具有还原性)
发生氧化反应(被氧化)
失电子(化合价升高)
氧化产物
(具有还原性)
(具有氧化性)
1、氧化剂、还原剂均是反应物;还原产物、氧化产物均是生成物。
2、氧化剂、氧化产物具有氧化性;还原剂、还原产物具有还原性。
3.把图b的碎纸片补充到图a中,可得到一个完整的离子方程式。下列有关该离子方程式的说法正确的是( )
A.配平后的化学计量数依次为3、1、2、6、3
B.若有1个S原子被氧化,则生成2个S2-
C.氧化剂与还原剂的原子数目之比为1∶2
D.3个S原子参加反应有8个电子发生转移
B
4.Ⅰ.近年来我国对碳纳米管的研究也有了较大突破,即用电弧合成法来制碳纳米管,但往往有大量的碳纳米颗粒,需用氧化法来提纯这些颗粒,化学方程式为:
(1)完成并配平上述反应的化学方程式。
此反应的氧化剂是_______,被氧化的元素是________。
Ⅱ.把通入浓氨水中,发生如下反应:
发生化学反应的与的分子数之比为:_____________ ,反应中发生电子转移的与的分子数之比为: _______________。
写出在溶液中的电离方程式 ___________________,在其溶液中分散质粒子的直径范围为_________。
若反应中有克氨发生氧化反应,则反应中有生成氮气的质量为 _________。
3:8
3:2
小于1nm
