2.1 课时3 碳酸钠与碳酸氢钠 课件(共21张PPT) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.1 课时3 碳酸钠与碳酸氢钠 课件(共21张PPT) 2024-2025学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 15:28:56 | ||
图片预览








文档简介
(共21张PPT)
碳酸钠与碳酸氢钠
第二章 海水中的重要元素——钠和氯
能够掌握碳酸钠和碳酸氢钠的共性和差异性
在面粉发酵或油条制作过程中,经常会用到发酵粉和食用碱,它们的
主要成分是什么,俗称什么?
碳酸氢钠
小苏打
厨房中也经常会出现碳酸钠的身影,它的用途是什么? 俗称什么?
洗涤剂,去油污
纯碱、苏打
碳酸钠 Na2CO3
碳酸氢钠 NaHCO3
白色粉末
白色晶体
小苏打
苏打
二者的用途有相同点,也有不同点。
根据性质决定用途的思想,试对二者的性质进行预测。
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
溶解放热
溶解吸热
1. 溶解度:Na2CO3 > NaHCO3
参考资料:
20℃时,Na2CO3的溶解度为21.5g,NaHCO3的溶解度为9.6g
2. 碱性
实验步骤:向等浓度碳酸钠和碳酸氢钠溶液中分别加入酚酞溶液,观察现象。
Na2CO3 >NaHCO3
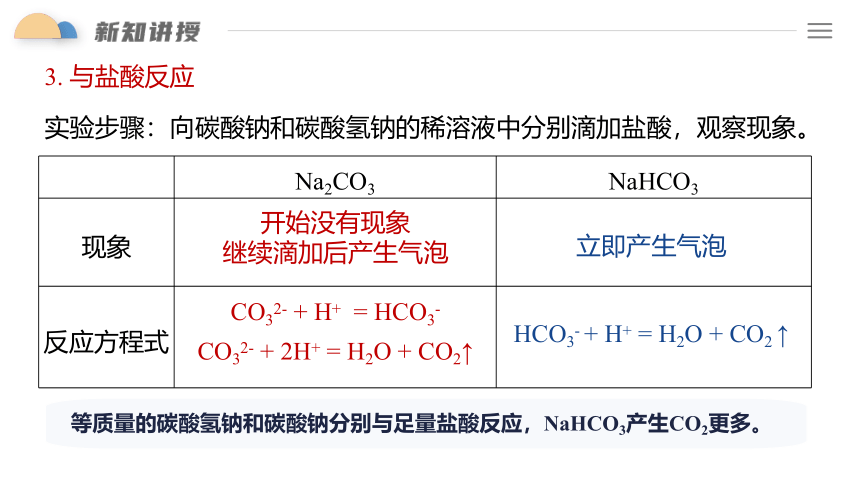
3. 与盐酸反应
Na2CO3 NaHCO3
现象
反应方程式
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
开始没有现象
继续滴加后产生气泡
立即产生气泡
实验步骤:向碳酸钠和碳酸氢钠的稀溶液中分别滴加盐酸,观察现象。
等质量的碳酸氢钠和碳酸钠分别与足量盐酸反应,NaHCO3产生CO2更多。
4. 热稳定性
碳酸钠较稳定,受热不易分解。碳酸氢钠不稳定,受热易分解
2NaHCO3 Na2CO3 + H2O + CO2↑
△
Na2CO3
稳定
> NaHCO3
不稳定
受热易分解
①与NaOH溶液反应
Na2CO3 :
NaHCO3 :
5.与碱反应
反应
不反应
OH- + HCO3- = CO32- +H2O
NaOH + NaHCO3 = Na2CO3 +H2O
②Ca(OH)2溶液反应
Na2CO3 :
NaHCO3 :
反应
反应
Ca2+ + CO32- = CaCO3↓
NaHCO3过量:Ca2+ + 2OH- + 2HCO3- = CaCO3↓ + CO32- +2H2O
NaHCO3少量:Ca2+ + OH- + HCO3- = CaCO3↓ +H2O
5.与碱反应
1. 厨房去油污,为什么建议使用碳酸钠而不是碳酸氢钠?
碳酸钠碱性更强
2. 为什么治疗胃酸过多的药物选用碳酸氢钠而不是碳酸钠?
碳酸氢钠碱性弱,对人体伤害小,而且与盐酸反应快,见效迅速。但胃溃疡患者慎用。
应用实践
性质 Na2CO3 NaHCO3
外观 白色粉末 细小的白色晶体
溶解性 均易溶于水,且溶解度 Na2CO3 > NaHCO3
饱和溶液的pH 均呈碱性,且pH(Na2CO3) > pH(NaHCO3)
热稳定性 热稳定性良好,受热不易分解 热稳定性差,受热易分解
2NaHCO3 Na2CO3+CO2↑+H2O
与酸溶液反应 均能与过量的酸溶液反应生成 CO2 和 H2O ,且NaHCO3与酸溶液反应速率更快
△
性质 Na2CO3 NaHCO3
与碱反应 NaOH溶液 不反应 反应。离子方程式为:
HCO3- + OH- = CO32- + H2O
Ca(OH) 2溶液 均生成CaCO3沉淀
与盐溶液(如CaCl2溶液)反应 反应。离子方程式为:Ca2++CO32- =CaCO3↓ 不反应
相互转化 ①.加入少量H+ ②.通入过量CO2 Na2CO3 NaHCO3 ⅰ.加入OH- ⅱ.加热
鉴别碳酸钠与碳酸氢钠的方法
除杂
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热
通入足量CO2气体
加入适量NaOH溶液
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
1.CO2 +H2O + NH3 + NaCl (饱和) NH4Cl + NaHCO3↓
2.2NaHCO3 Na2CO3 + H2O + CO2
上述原理中应用了NaHCO3的哪些性质?
侯德榜
碳酸氢钠的溶解性
△
和对热具有不稳定性
1.向含有HCO3-、CO32-、NO3-、Na+的溶液中加入一定量Na2O2后,离子浓度减少的是( ),离子浓度增大的是( )
A. HCO3- B. CO32- C. NO3- D. Na+
A
BD
2.现有两瓶无标签的无色溶液,分别装有Na2CO3溶液和NaHCO3溶液,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A.①③ B.①④ C.②③ D.②⑤
C
碳酸钠与碳酸氢钠
第二章 海水中的重要元素——钠和氯
能够掌握碳酸钠和碳酸氢钠的共性和差异性
在面粉发酵或油条制作过程中,经常会用到发酵粉和食用碱,它们的
主要成分是什么,俗称什么?
碳酸氢钠
小苏打
厨房中也经常会出现碳酸钠的身影,它的用途是什么? 俗称什么?
洗涤剂,去油污
纯碱、苏打
碳酸钠 Na2CO3
碳酸氢钠 NaHCO3
白色粉末
白色晶体
小苏打
苏打
二者的用途有相同点,也有不同点。
根据性质决定用途的思想,试对二者的性质进行预测。
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠
溶解放热
溶解吸热
1. 溶解度:Na2CO3 > NaHCO3
参考资料:
20℃时,Na2CO3的溶解度为21.5g,NaHCO3的溶解度为9.6g
2. 碱性
实验步骤:向等浓度碳酸钠和碳酸氢钠溶液中分别加入酚酞溶液,观察现象。
Na2CO3 >NaHCO3
3. 与盐酸反应
Na2CO3 NaHCO3
现象
反应方程式
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
开始没有现象
继续滴加后产生气泡
立即产生气泡
实验步骤:向碳酸钠和碳酸氢钠的稀溶液中分别滴加盐酸,观察现象。
等质量的碳酸氢钠和碳酸钠分别与足量盐酸反应,NaHCO3产生CO2更多。
4. 热稳定性
碳酸钠较稳定,受热不易分解。碳酸氢钠不稳定,受热易分解
2NaHCO3 Na2CO3 + H2O + CO2↑
△
Na2CO3
稳定
> NaHCO3
不稳定
受热易分解
①与NaOH溶液反应
Na2CO3 :
NaHCO3 :
5.与碱反应
反应
不反应
OH- + HCO3- = CO32- +H2O
NaOH + NaHCO3 = Na2CO3 +H2O
②Ca(OH)2溶液反应
Na2CO3 :
NaHCO3 :
反应
反应
Ca2+ + CO32- = CaCO3↓
NaHCO3过量:Ca2+ + 2OH- + 2HCO3- = CaCO3↓ + CO32- +2H2O
NaHCO3少量:Ca2+ + OH- + HCO3- = CaCO3↓ +H2O
5.与碱反应
1. 厨房去油污,为什么建议使用碳酸钠而不是碳酸氢钠?
碳酸钠碱性更强
2. 为什么治疗胃酸过多的药物选用碳酸氢钠而不是碳酸钠?
碳酸氢钠碱性弱,对人体伤害小,而且与盐酸反应快,见效迅速。但胃溃疡患者慎用。
应用实践
性质 Na2CO3 NaHCO3
外观 白色粉末 细小的白色晶体
溶解性 均易溶于水,且溶解度 Na2CO3 > NaHCO3
饱和溶液的pH 均呈碱性,且pH(Na2CO3) > pH(NaHCO3)
热稳定性 热稳定性良好,受热不易分解 热稳定性差,受热易分解
2NaHCO3 Na2CO3+CO2↑+H2O
与酸溶液反应 均能与过量的酸溶液反应生成 CO2 和 H2O ,且NaHCO3与酸溶液反应速率更快
△
性质 Na2CO3 NaHCO3
与碱反应 NaOH溶液 不反应 反应。离子方程式为:
HCO3- + OH- = CO32- + H2O
Ca(OH) 2溶液 均生成CaCO3沉淀
与盐溶液(如CaCl2溶液)反应 反应。离子方程式为:Ca2++CO32- =CaCO3↓ 不反应
相互转化 ①.加入少量H+ ②.通入过量CO2 Na2CO3 NaHCO3 ⅰ.加入OH- ⅱ.加热
鉴别碳酸钠与碳酸氢钠的方法
除杂
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热
通入足量CO2气体
加入适量NaOH溶液
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生产纯碱的重要方法。其主要化学原理是:
1.CO2 +H2O + NH3 + NaCl (饱和) NH4Cl + NaHCO3↓
2.2NaHCO3 Na2CO3 + H2O + CO2
上述原理中应用了NaHCO3的哪些性质?
侯德榜
碳酸氢钠的溶解性
△
和对热具有不稳定性
1.向含有HCO3-、CO32-、NO3-、Na+的溶液中加入一定量Na2O2后,离子浓度减少的是( ),离子浓度增大的是( )
A. HCO3- B. CO32- C. NO3- D. Na+
A
BD
2.现有两瓶无标签的无色溶液,分别装有Na2CO3溶液和NaHCO3溶液,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A.①③ B.①④ C.②③ D.②⑤
C
