2.1 课时1 钠的单质 课件 (共28张PPT) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.1 课时1 钠的单质 课件 (共28张PPT) 2024-2025学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:25:04 | ||
图片预览








文档简介
(共28张PPT)
钠的单质
第二章 海水中的重要元素——钠和氯
1.认识钠是一种很活泼的金属,了解钠的物理性质和保存方法
2.掌握钠的化学性质,能描述钠与氧气、水反应的实验现象并写出相关的化学反应方程式,能解释钠与水反应的实验现象
一、钠的存在
在动物体中钠离子是细胞外液中带正电荷的主要离子,参与水的代谢,保证体内水的平衡;维持体内的酸碱平衡;是胰汁、胆汁、汉和泪水的组成成分;参与心肌肉和神经功能的调节。
钠元素在自然界中都是以化合物的形式存在,如 、Na2CO3、Na2SO4等。钠的单质可以通过化学反应制得。
NaCl
二、钠的物理性质
钠常常保存在石蜡油或煤油中
钠单质的保存
钠的取用及切割
钠的取用:用______取出一小块钠,用_____ 吸干表面的煤油,放在________上,用______切去表面被氧化的钠,多余的钠及碎屑要_________
镊子
滤纸
玻璃片
小刀
放回原瓶
请同学们根据上述实验试着说出钠的物理性质:主要通过颜色、状态、密度、硬度、熔沸点、导电导热性等
二、钠的物理性质
硬度:
质软
色态:
具有银白色金属光泽的固体
密度:
<ρ水
ρ=0.971g/cm3 ,ρ煤油<ρ钠
熔沸点:
较低 (熔点97.8℃ ,沸点883℃)
导电、热:
电和热的良导体
物理性质小结:白、小、软、低、导
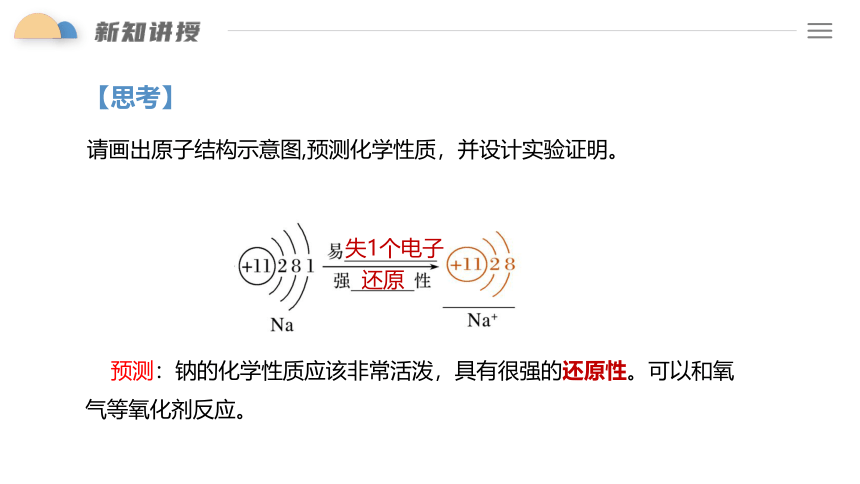
【思考】
请画出原子结构示意图,预测化学性质,并设计实验证明。
预测:钠的化学性质应该非常活泼,具有很强的还原性。可以和氧气等氧化剂反应。
失1个电子
还原
三、钠的化学性质
新切开的钠,光亮的表面很快的变暗,这是因为钠和氧气发生了反应,生成了一薄层氧化物。
4Na+O2 = 2Na2O(白色)
实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气。
(1)Na与O2反应(常温)
——钠是一种活泼的金属
1、坩埚加热时应与泥三角配套使用。
【实验2-2 注意事项】
2、实验结束时,要用坩埚钳将坩埚和泥三角取下,并放在陶土网上。绝对不可以直接用手去拿或直接将它们放在桌子上。
三脚架、泥三角、坩埚、坩埚钳、酒精灯
请写出【实验2-2】加热钠时,所用的主要仪器。
【思考】如果加热,钠又会发生什么变化呢?
(1)Na与O2反应(加热)
三、钠的化学性质
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
熔点低
2Na + O2
△
钠与氧气反应小结:
①常温下,空气中氧化
②钠在空气中燃烧
注意:反应物相同,反应条件不同,产物不同!
产物的稳定性:Na2O < Na2O2
2Na2O + O2 = 2Na2O2
△
4Na+O2 =2Na2O (白色)
2Na+O2=Na2O2(淡黄色)
△
三、钠的化学性质
(2)钠与氯气反应:
钠的化学性质结论:钠是一种很活泼的金属,有很强的还原性,能与非金属如氧气、氯气和硫等反应。
反应:
2Na + S = Na2S(易爆炸)
研磨
(3)钠与硫反应:(钠和硫粉混合研磨)
反应:2Na+Cl2 =2NaCl (白烟)
△
若不能,从物质组成及氧化还原反应的角度,推测钠与水反应的生成物?
讨论:钠着火时,能否用水扑灭?
央视新闻:
2015年5月29日中午12时56分,辽宁省沈阳市沈北新区百龙生物有限公司厂房起火,8个消防中队及20台消防车随机赶赴火灾现场。据悉,起火厂房已停产十个月,起火原因初步判定为厂房内存放的200公斤金属钠遇雨水后爆炸燃烧。目前,火势已被控制,无人员伤亡。
向一只盛有水的大烧杯中滴加几滴酚酞试液,然后将一小块金属钠(约绿豆般大小)投入烧杯中,观察实验现象。
【实验】
观察和描述实验现象,分析实验现象,你能得出哪些结论?
实验现象 分析及结论
浮在水面
熔化成液态小球
在水面无规则游动
经过处水溶液变红
密度比水的小
反应放热,钠的熔点低
产生气体
生成可溶性碱
发出嘶嘶的响声
产生气体
收集的气体可以点燃
生成可燃性气体
三、钠的化学性质
(4)钠与水反应:
阅读课本P35回答:钠着火时,应如何灭火?
干燥的沙土盖灭
浮、游、熔、响、红
宏观现象:
微观实质:
2Na+2H2O===2NaOH+H2↑
1.某同学将金属钠露置于空气中,观察到下列现象:银白色 变灰暗 变白色 出现液滴 白色晶体 白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( )
A.①发生了氧化还原反应
B.①钠表面变灰暗是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④⑤只发生物理变化
A
Na长期露置于空气中最终会完全转变为Na2CO3粉末。变化过程中涉及到的化学方程式:
①
②
④
⑤
钠与酸溶液反应:
钠与盐酸的反应。
酸过量:2Na + 2HCl 2NaCl + H2↑
酸不足:钠先与酸反应,后与水反应。
2Na + 2HCl 2NaCl + H2↑
2Na + 2H2O 2NaOH + H2↑
实验探究:钠与盐溶液的反应
预测:钠与CuSO4溶液的反应。
四、钠的用途
除水剂
2
制备不活泼金属
3
制备钠-硫新型电池、制备染料、制药的中间体
4
核反应堆冷却剂
5
制备过氧化钠
1
钠的
用途
高压钠灯
6
强
还
原
性
导热性
2Na+O2=Na2O2
△
2Na+2H2O=2NaOH+H2↑
4Na+TiCl4(熔融)=4NaCl+Ti
性质
决定
用途
Na
物理性质
化学性质
小
软
低
导
强还原性
与氧气等非金属单质反应(化合)
……
与水反应(置换)
与酸反应(置换)
代表物
研究
内容
金属单质
物质
类别
白
用途
2.将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
A.盐酸
B.饱和氢氧化钠溶液
C.FeCl3溶液
D.CuSO4溶液
A
3.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰
D.金属钠着火可以用水灭火
C
4.下列反应的离子方程式不正确的是 ( )
A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.钠与盐酸反应:2Na+2H+=2Na++H2↑
D.钠与氯化钾溶液反应:2Na+2H2O=2Na++2OH-+H2↑
B
5.钛和钛的合金大量用于航空工业,有“空间金属”之称;钛还可以用来制造潜艇——钛潜艇,由于钛非常结实,能承受很高的压力,这种潜艇可以在深达4500米的深海中航行。金属钛可由反应TiCl4+4Na=4NaCl+Ti制得。对于反应下列说法正确的是 ( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C. Ti是氧化剂
D. TiCl4是还原剂
A
6.关于钠的描述正确的是( )
①钠与水反应熔化成小球,说明钠的熔点高
②“皇帝的新衣”中用“金丝银线”织布说明金属具有很好的延展性
③钠的密度比煤油大,少量钠可以保存在煤油中
④钠在空气中燃烧,主要产物是Na2O2
⑤钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜
A.①③④ B.③④⑤ C.①③⑤ D.②③④
D
钠的单质
第二章 海水中的重要元素——钠和氯
1.认识钠是一种很活泼的金属,了解钠的物理性质和保存方法
2.掌握钠的化学性质,能描述钠与氧气、水反应的实验现象并写出相关的化学反应方程式,能解释钠与水反应的实验现象
一、钠的存在
在动物体中钠离子是细胞外液中带正电荷的主要离子,参与水的代谢,保证体内水的平衡;维持体内的酸碱平衡;是胰汁、胆汁、汉和泪水的组成成分;参与心肌肉和神经功能的调节。
钠元素在自然界中都是以化合物的形式存在,如 、Na2CO3、Na2SO4等。钠的单质可以通过化学反应制得。
NaCl
二、钠的物理性质
钠常常保存在石蜡油或煤油中
钠单质的保存
钠的取用及切割
钠的取用:用______取出一小块钠,用_____ 吸干表面的煤油,放在________上,用______切去表面被氧化的钠,多余的钠及碎屑要_________
镊子
滤纸
玻璃片
小刀
放回原瓶
请同学们根据上述实验试着说出钠的物理性质:主要通过颜色、状态、密度、硬度、熔沸点、导电导热性等
二、钠的物理性质
硬度:
质软
色态:
具有银白色金属光泽的固体
密度:
<ρ水
ρ=0.971g/cm3 ,ρ煤油<ρ钠
熔沸点:
较低 (熔点97.8℃ ,沸点883℃)
导电、热:
电和热的良导体
物理性质小结:白、小、软、低、导
【思考】
请画出原子结构示意图,预测化学性质,并设计实验证明。
预测:钠的化学性质应该非常活泼,具有很强的还原性。可以和氧气等氧化剂反应。
失1个电子
还原
三、钠的化学性质
新切开的钠,光亮的表面很快的变暗,这是因为钠和氧气发生了反应,生成了一薄层氧化物。
4Na+O2 = 2Na2O(白色)
实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气。
(1)Na与O2反应(常温)
——钠是一种活泼的金属
1、坩埚加热时应与泥三角配套使用。
【实验2-2 注意事项】
2、实验结束时,要用坩埚钳将坩埚和泥三角取下,并放在陶土网上。绝对不可以直接用手去拿或直接将它们放在桌子上。
三脚架、泥三角、坩埚、坩埚钳、酒精灯
请写出【实验2-2】加热钠时,所用的主要仪器。
【思考】如果加热,钠又会发生什么变化呢?
(1)Na与O2反应(加热)
三、钠的化学性质
【实验2-2】将一个干燥的坩埚加热,同时切取一块绿豆大的钠,迅速投到热坩埚中,继续加热坩埚片刻,待钠熔化后立即撤掉酒精灯,观察现象。
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
熔点低
2Na + O2
△
钠与氧气反应小结:
①常温下,空气中氧化
②钠在空气中燃烧
注意:反应物相同,反应条件不同,产物不同!
产物的稳定性:Na2O < Na2O2
2Na2O + O2 = 2Na2O2
△
4Na+O2 =2Na2O (白色)
2Na+O2=Na2O2(淡黄色)
△
三、钠的化学性质
(2)钠与氯气反应:
钠的化学性质结论:钠是一种很活泼的金属,有很强的还原性,能与非金属如氧气、氯气和硫等反应。
反应:
2Na + S = Na2S(易爆炸)
研磨
(3)钠与硫反应:(钠和硫粉混合研磨)
反应:2Na+Cl2 =2NaCl (白烟)
△
若不能,从物质组成及氧化还原反应的角度,推测钠与水反应的生成物?
讨论:钠着火时,能否用水扑灭?
央视新闻:
2015年5月29日中午12时56分,辽宁省沈阳市沈北新区百龙生物有限公司厂房起火,8个消防中队及20台消防车随机赶赴火灾现场。据悉,起火厂房已停产十个月,起火原因初步判定为厂房内存放的200公斤金属钠遇雨水后爆炸燃烧。目前,火势已被控制,无人员伤亡。
向一只盛有水的大烧杯中滴加几滴酚酞试液,然后将一小块金属钠(约绿豆般大小)投入烧杯中,观察实验现象。
【实验】
观察和描述实验现象,分析实验现象,你能得出哪些结论?
实验现象 分析及结论
浮在水面
熔化成液态小球
在水面无规则游动
经过处水溶液变红
密度比水的小
反应放热,钠的熔点低
产生气体
生成可溶性碱
发出嘶嘶的响声
产生气体
收集的气体可以点燃
生成可燃性气体
三、钠的化学性质
(4)钠与水反应:
阅读课本P35回答:钠着火时,应如何灭火?
干燥的沙土盖灭
浮、游、熔、响、红
宏观现象:
微观实质:
2Na+2H2O===2NaOH+H2↑
1.某同学将金属钠露置于空气中,观察到下列现象:银白色 变灰暗 变白色 出现液滴 白色晶体 白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( )
A.①发生了氧化还原反应
B.①钠表面变灰暗是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④⑤只发生物理变化
A
Na长期露置于空气中最终会完全转变为Na2CO3粉末。变化过程中涉及到的化学方程式:
①
②
④
⑤
钠与酸溶液反应:
钠与盐酸的反应。
酸过量:2Na + 2HCl 2NaCl + H2↑
酸不足:钠先与酸反应,后与水反应。
2Na + 2HCl 2NaCl + H2↑
2Na + 2H2O 2NaOH + H2↑
实验探究:钠与盐溶液的反应
预测:钠与CuSO4溶液的反应。
四、钠的用途
除水剂
2
制备不活泼金属
3
制备钠-硫新型电池、制备染料、制药的中间体
4
核反应堆冷却剂
5
制备过氧化钠
1
钠的
用途
高压钠灯
6
强
还
原
性
导热性
2Na+O2=Na2O2
△
2Na+2H2O=2NaOH+H2↑
4Na+TiCl4(熔融)=4NaCl+Ti
性质
决定
用途
Na
物理性质
化学性质
小
软
低
导
强还原性
与氧气等非金属单质反应(化合)
……
与水反应(置换)
与酸反应(置换)
代表物
研究
内容
金属单质
物质
类别
白
用途
2.将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是( )
A.盐酸
B.饱和氢氧化钠溶液
C.FeCl3溶液
D.CuSO4溶液
A
3.金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。下列关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠
C.在氧气中加热时,金属钠剧烈燃烧,发出黄色火焰
D.金属钠着火可以用水灭火
C
4.下列反应的离子方程式不正确的是 ( )
A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.钠与盐酸反应:2Na+2H+=2Na++H2↑
D.钠与氯化钾溶液反应:2Na+2H2O=2Na++2OH-+H2↑
B
5.钛和钛的合金大量用于航空工业,有“空间金属”之称;钛还可以用来制造潜艇——钛潜艇,由于钛非常结实,能承受很高的压力,这种潜艇可以在深达4500米的深海中航行。金属钛可由反应TiCl4+4Na=4NaCl+Ti制得。对于反应下列说法正确的是 ( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C. Ti是氧化剂
D. TiCl4是还原剂
A
6.关于钠的描述正确的是( )
①钠与水反应熔化成小球,说明钠的熔点高
②“皇帝的新衣”中用“金丝银线”织布说明金属具有很好的延展性
③钠的密度比煤油大,少量钠可以保存在煤油中
④钠在空气中燃烧,主要产物是Na2O2
⑤钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜
A.①③④ B.③④⑤ C.①③⑤ D.②③④
D
