2.3.1 物质的量单位——摩尔 课件(共26张ppt) 2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.3.1 物质的量单位——摩尔 课件(共26张ppt) 2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:24:35 | ||
图片预览





文档简介
(共26张PPT)
物质的量单位
——摩尔
第二章 海水中的重要元素——钠和氯
1.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用
2.能基于物质的量认识物质组成及其化学变化,知道从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学的化学方法之一
如何计量碳粉和O2的多少?
一堆碳粉
一瓶O2
固体:称质量
气体:量体积
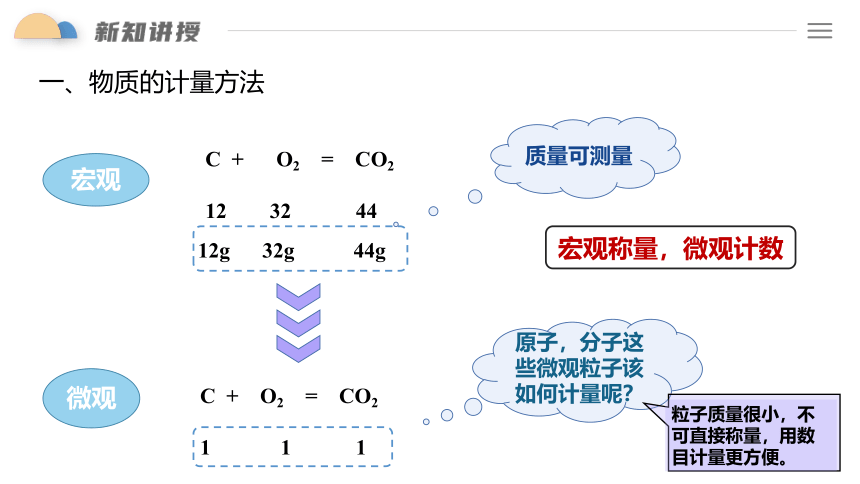
一、物质的计量方法
C + O2 = CO2
12 32 44
12g 32g 44g
C + O2 = CO2
1 1 1
质量可测量
宏观
微观
原子,分子这些微观粒子该如何计量呢?
粒子质量很小,不可直接称量,用数目计量更方便。
宏观称量,微观计数
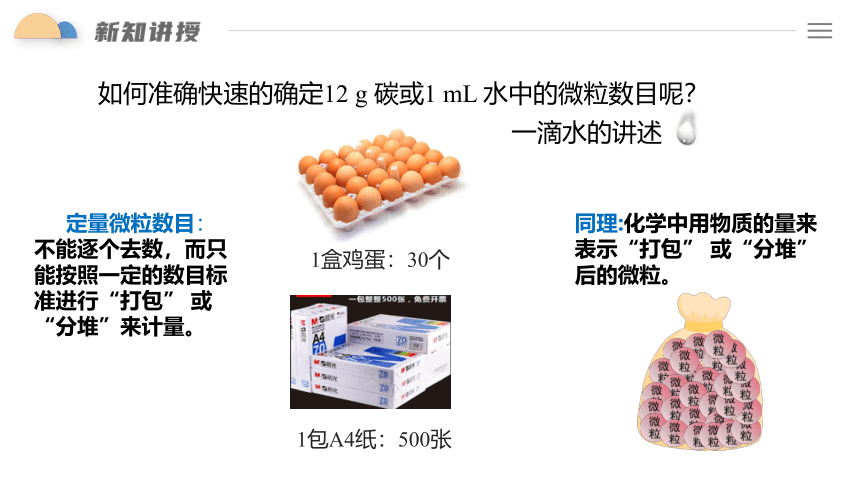
如何准确快速的确定12 g 碳或1 mL 水中的微粒数目呢?
一滴水的讲述
定量微粒数目:
不能逐个去数,而只能按照一定的数目标准进行“打包” 或“分堆”来计量。
1盒鸡蛋:30个
1包A4纸:500张
同理:化学中用物质的量来表示“打包” 或“分堆” 后的微粒。
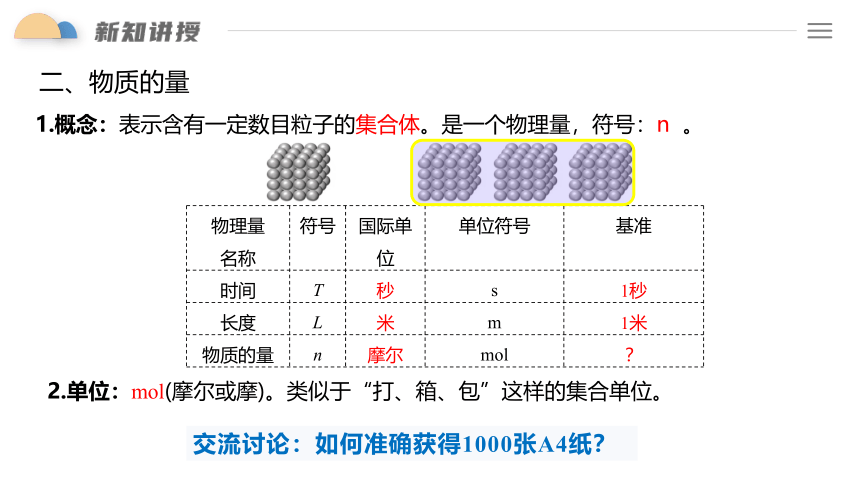
二、物质的量
1.概念:表示含有一定数目粒子的集合体。是一个物理量,符号:n 。
物理量 名称 符号 国际单位 单位符号 基准
时间 T 秒 s 1秒
长度 L 米 m 1米
物质的量 n 摩尔 mol ?
2.单位:mol(摩尔或摩)。类似于“打、箱、包”这样的集合单位。
交流讨论:如何准确获得1000张A4纸?
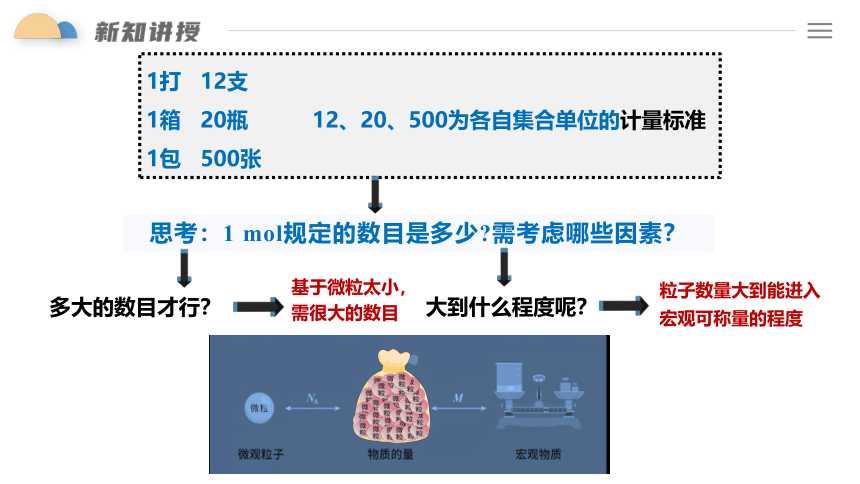
1打 12支
1箱 20瓶 12、20、500为各自集合单位的计量标准
1包 500张
思考:1 mol规定的数目是多少 需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
粒子数量大到能进入宏观可称量的程度
基于微粒太小,需很大的数目
3.物质的量的基准:阿伏加德罗常数
符号: NA 单位: mol-1,数值:约为6.02×1023
科学上规定为: 0.012 kg 12C 中所含的碳原子数
规定解释:如果某物质含有与 0.012 kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
阿伏加德罗常数: 1 mol 任何粒子的粒子数。
注意:不能认为 6.02×1023就是阿伏加德罗常数
感受阿伏加德罗常数
辨析:
1 mol 大米(鸡蛋)
2 mol O2
1 mol 氧原子
1 mol 氢气
1 mol H
1 mol 氢
微粒:
分子
原子
离子
质子
中子
电子
注意:n 只能用来描述
微观粒子且必须具体指
明粒子的种类。
4.计量对象:分子、原子、离子、电子、中子、质子等所有的微观粒子及它们的特定组合。
√
√
√
√
下面叙述是否正确
(1)摩尔是七个物理量之一。
(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。
(4)1mol氢
错误。物质的量 是七个基本物理量之一
错误。摩尔是物质的量的单位
错误。物质的量只适用于微观粒子,不能用来说明宏观物质
错误。没有指出是分子、原子或离子
1、说出下列符号的意义:
①2H 、②2mol H 、 ③2mol H+ 、
④2mol H2 、⑤4mol Fe3+ 、⑥a mol SO3 、
2、用符号表示:
2摩尔水分子 、5摩尔硫酸根离子 、
n 摩尔氧原子 、1摩尔碳酸氢根离子 、
10摩尔亚铁离子 、3摩尔氯化氢分子 、
三、以n 为中心的转换关系
物质的量(n) 粒子数目(N)
①2 mol Al中含有多少个铝原子?
N(Al) = 2 mol × 6.02 × 1023 mol-1 = 1.204 × 1024
②3.01×1023个H2O的物质的量是多少?
6.02 × 1023 mol-1
3.01 × 1023
n(H2O) =
=
0.5 mol
N=n×NA
训练
3
4. 1.204×1024个NO 相当于 mol NO 。
3
1. 1 mol H2O中约含有 个水分子;
2. 0.5 mol NaOH中约含有 个Na+;
6.02×1023
3.01×1023
3. 6.02×1023个H2相当于 mol H2 ;
1
2
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
粒子数之比 = 物质的量之比
=
N2
N1
n2
n1
知识迁移
微粒个数
1个
1个
1个
物质的量
1mol
1mol
1mol
C + O2 === CO2
△
结论:化学反应方程式中,系数之比即反应过中各物质的物质的量之比
1 mol不同物质中所含的粒子数是相同的,但由于不同微粒的质量不同,所以 1 mol不同物质的质量也不同。
阅读教材P50后计算填表:
计算1 mol H2O、1 mol 铝的质量 ,并回忆H2O、Al的相对分子(原子)质量。请思考二者之间的关系?
物质微粒 1个微粒的实际质量(g) 6.02×1023个微粒的质量(g) 相对分子(或原子)质量
H2O 2.990×10-23
Al 4.485×10-23
18
27
17.9998
26.9997
三、以n 为中心的转换关系
规律:1 mol任何粒子或物质的质量以克为单位时,
其数值都与其相对分子(原子)质量相等。
18g H2O
约6.02 ×1023个水分子
1 mol H2O
27g Al
约6.02 ×1023个铝原子
1 mol Al
摩尔质量
概念:单位物质的量的物质所具有的质量。
符号:M; 单位:g/mol;
数值:等于相对原子(分子)质量
例如:Na的摩尔质量是23 g/mol
CO2的摩尔质量是44 g/mol
三、以n 为中心的转换关系
物质的量(n) 物质质量(m)
①计算2 mol CO2的质量是多少?
②12 g 镁的物质的量是多少?
三、以n 为中心的转换关系
训练
m、M、n 转换
①3.01 × 1023 个CO2的质量是多少?
m = n×M 或 n=
m
M
解:CO2的相对分子质量为44,摩尔质量为44 g/mol
N(CO2)
NA
3.01 × 1023
6.02 × 1023 mol-1
n(CO2) =
=
= 0.5 mol
m(CO2) = n(CO2) M(CO2) = 0.5 mol × 44 g/mol = 22 g
训练
②含48 g氧元素的葡萄糖(C6H12O6),其分子数目是多少?
解:O的相对原子质量为16,摩尔质量为16 g/mol
m(O)
M(O)
48 g
16g mol-1
n(O) =
=
= 3 mol
N(C6H12O6) = n(C6H12O6) NA = 0.5 mol × 6.02 × 1023 mol-1
= 3.01 × 1023
C6H12O6 ~ 6 O
1 6
3 mol
0.5 mol
物质的量
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。
单位:摩尔,简称:摩,符号:mol
物质的量
阿伏加德罗常数
概念:1mol任何粒子的粒子数,符号NA。
通常用6.02×1023 mol-1表示。
重要公式
摩尔质量
概念:单位物质的量的物质所具有的质量,通常用字母“M”表示。
单位:g/mol
1.2018年11月13日至16日,第26届国际计量大会在巴黎召开。这次,对物质的量的单位——摩尔的定义进行了修改。下列对“摩尔”的理解正确的是( )
A.我们把含有6.02×1023个粒子的任何粒子集合体计量为1摩尔
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与所含微观粒子的数量联系起来
D.摩尔是用来描述物质所含微粒数目多少的基本物理量
B
2.下列对阿伏加德罗常数的理解,正确的是( )
A.阿伏加德罗常数是化学上常用的一个单位
B.8 mol NH3含有8NA个NH3分子
C.通常情况下,6.02×1023就是我们所说的阿伏加德罗常数
D.粒子的数目越多,所含该粒子的物质的量不一定越大
B
3.下列关于2 mol二氧化碳的叙述中,正确的是( )
A.质量为44 g B.有4 mol原子
C.分子数为6.02×1023 D.摩尔质量为44 g·mol-1
4.下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g·mol-1
C.1 g H2和1 g N2所含分子数相等
D.等质量的N2、CH4、CO、H2O中,CH4所含分子数最多
D
D
物质的量单位
——摩尔
第二章 海水中的重要元素——钠和氯
1.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用
2.能基于物质的量认识物质组成及其化学变化,知道从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学的化学方法之一
如何计量碳粉和O2的多少?
一堆碳粉
一瓶O2
固体:称质量
气体:量体积
一、物质的计量方法
C + O2 = CO2
12 32 44
12g 32g 44g
C + O2 = CO2
1 1 1
质量可测量
宏观
微观
原子,分子这些微观粒子该如何计量呢?
粒子质量很小,不可直接称量,用数目计量更方便。
宏观称量,微观计数
如何准确快速的确定12 g 碳或1 mL 水中的微粒数目呢?
一滴水的讲述
定量微粒数目:
不能逐个去数,而只能按照一定的数目标准进行“打包” 或“分堆”来计量。
1盒鸡蛋:30个
1包A4纸:500张
同理:化学中用物质的量来表示“打包” 或“分堆” 后的微粒。
二、物质的量
1.概念:表示含有一定数目粒子的集合体。是一个物理量,符号:n 。
物理量 名称 符号 国际单位 单位符号 基准
时间 T 秒 s 1秒
长度 L 米 m 1米
物质的量 n 摩尔 mol ?
2.单位:mol(摩尔或摩)。类似于“打、箱、包”这样的集合单位。
交流讨论:如何准确获得1000张A4纸?
1打 12支
1箱 20瓶 12、20、500为各自集合单位的计量标准
1包 500张
思考:1 mol规定的数目是多少 需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
粒子数量大到能进入宏观可称量的程度
基于微粒太小,需很大的数目
3.物质的量的基准:阿伏加德罗常数
符号: NA 单位: mol-1,数值:约为6.02×1023
科学上规定为: 0.012 kg 12C 中所含的碳原子数
规定解释:如果某物质含有与 0.012 kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
阿伏加德罗常数: 1 mol 任何粒子的粒子数。
注意:不能认为 6.02×1023就是阿伏加德罗常数
感受阿伏加德罗常数
辨析:
1 mol 大米(鸡蛋)
2 mol O2
1 mol 氧原子
1 mol 氢气
1 mol H
1 mol 氢
微粒:
分子
原子
离子
质子
中子
电子
注意:n 只能用来描述
微观粒子且必须具体指
明粒子的种类。
4.计量对象:分子、原子、离子、电子、中子、质子等所有的微观粒子及它们的特定组合。
√
√
√
√
下面叙述是否正确
(1)摩尔是七个物理量之一。
(2)摩尔是物质的质量单位。
(3) 1摩尔大米含有 6.02×1023个米粒。
(4)1mol氢
错误。物质的量 是七个基本物理量之一
错误。摩尔是物质的量的单位
错误。物质的量只适用于微观粒子,不能用来说明宏观物质
错误。没有指出是分子、原子或离子
1、说出下列符号的意义:
①2H 、②2mol H 、 ③2mol H+ 、
④2mol H2 、⑤4mol Fe3+ 、⑥a mol SO3 、
2、用符号表示:
2摩尔水分子 、5摩尔硫酸根离子 、
n 摩尔氧原子 、1摩尔碳酸氢根离子 、
10摩尔亚铁离子 、3摩尔氯化氢分子 、
三、以n 为中心的转换关系
物质的量(n) 粒子数目(N)
①2 mol Al中含有多少个铝原子?
N(Al) = 2 mol × 6.02 × 1023 mol-1 = 1.204 × 1024
②3.01×1023个H2O的物质的量是多少?
6.02 × 1023 mol-1
3.01 × 1023
n(H2O) =
=
0.5 mol
N=n×NA
训练
3
4. 1.204×1024个NO 相当于 mol NO 。
3
1. 1 mol H2O中约含有 个水分子;
2. 0.5 mol NaOH中约含有 个Na+;
6.02×1023
3.01×1023
3. 6.02×1023个H2相当于 mol H2 ;
1
2
H2O ~ 2 H ~ O
1 mol 2 mol 1 mol
1×6.02×1023 2×6.02×1023 1×6.02×1023
粒子数之比 = 物质的量之比
=
N2
N1
n2
n1
知识迁移
微粒个数
1个
1个
1个
物质的量
1mol
1mol
1mol
C + O2 === CO2
△
结论:化学反应方程式中,系数之比即反应过中各物质的物质的量之比
1 mol不同物质中所含的粒子数是相同的,但由于不同微粒的质量不同,所以 1 mol不同物质的质量也不同。
阅读教材P50后计算填表:
计算1 mol H2O、1 mol 铝的质量 ,并回忆H2O、Al的相对分子(原子)质量。请思考二者之间的关系?
物质微粒 1个微粒的实际质量(g) 6.02×1023个微粒的质量(g) 相对分子(或原子)质量
H2O 2.990×10-23
Al 4.485×10-23
18
27
17.9998
26.9997
三、以n 为中心的转换关系
规律:1 mol任何粒子或物质的质量以克为单位时,
其数值都与其相对分子(原子)质量相等。
18g H2O
约6.02 ×1023个水分子
1 mol H2O
27g Al
约6.02 ×1023个铝原子
1 mol Al
摩尔质量
概念:单位物质的量的物质所具有的质量。
符号:M; 单位:g/mol;
数值:等于相对原子(分子)质量
例如:Na的摩尔质量是23 g/mol
CO2的摩尔质量是44 g/mol
三、以n 为中心的转换关系
物质的量(n) 物质质量(m)
①计算2 mol CO2的质量是多少?
②12 g 镁的物质的量是多少?
三、以n 为中心的转换关系
训练
m、M、n 转换
①3.01 × 1023 个CO2的质量是多少?
m = n×M 或 n=
m
M
解:CO2的相对分子质量为44,摩尔质量为44 g/mol
N(CO2)
NA
3.01 × 1023
6.02 × 1023 mol-1
n(CO2) =
=
= 0.5 mol
m(CO2) = n(CO2) M(CO2) = 0.5 mol × 44 g/mol = 22 g
训练
②含48 g氧元素的葡萄糖(C6H12O6),其分子数目是多少?
解:O的相对原子质量为16,摩尔质量为16 g/mol
m(O)
M(O)
48 g
16g mol-1
n(O) =
=
= 3 mol
N(C6H12O6) = n(C6H12O6) NA = 0.5 mol × 6.02 × 1023 mol-1
= 3.01 × 1023
C6H12O6 ~ 6 O
1 6
3 mol
0.5 mol
物质的量
概念:表示含有一定数目粒子的集合体,通常用字母“n”表示。
单位:摩尔,简称:摩,符号:mol
物质的量
阿伏加德罗常数
概念:1mol任何粒子的粒子数,符号NA。
通常用6.02×1023 mol-1表示。
重要公式
摩尔质量
概念:单位物质的量的物质所具有的质量,通常用字母“M”表示。
单位:g/mol
1.2018年11月13日至16日,第26届国际计量大会在巴黎召开。这次,对物质的量的单位——摩尔的定义进行了修改。下列对“摩尔”的理解正确的是( )
A.我们把含有6.02×1023个粒子的任何粒子集合体计量为1摩尔
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与所含微观粒子的数量联系起来
D.摩尔是用来描述物质所含微粒数目多少的基本物理量
B
2.下列对阿伏加德罗常数的理解,正确的是( )
A.阿伏加德罗常数是化学上常用的一个单位
B.8 mol NH3含有8NA个NH3分子
C.通常情况下,6.02×1023就是我们所说的阿伏加德罗常数
D.粒子的数目越多,所含该粒子的物质的量不一定越大
B
3.下列关于2 mol二氧化碳的叙述中,正确的是( )
A.质量为44 g B.有4 mol原子
C.分子数为6.02×1023 D.摩尔质量为44 g·mol-1
4.下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g·mol-1
C.1 g H2和1 g N2所含分子数相等
D.等质量的N2、CH4、CO、H2O中,CH4所含分子数最多
D
D
