2.3.3物质的量 课件(共21张ppt) 高中化学人教版(2019)必修一
文档属性
| 名称 | 2.3.3物质的量 课件(共21张ppt) 高中化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-08-08 10:25:24 | ||
图片预览







文档简介
(共21张PPT)
阿伏加德罗定律
第二章 海水中的重要元素——钠和氯
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1.气体摩尔体积
单位: L/mol
Vm=
V
n
公式:
符号: Vm
概念:单位物质的量气体所占的体积。
掌握气体摩尔体积时应注意以下几点:
1.气体摩尔体积仅仅是针对气体而言
2.气体在不同状况下的气体摩尔体积是不同的,任何气体在S.T.P下
Vm=22.4 L/mol
3.同温同压下,气体的体积只与气体的分子数目有关,而与气体的分子种类无关
4. 当气体摩尔体积Vm=22.4 L/mol时,气体不一定处于标准状态
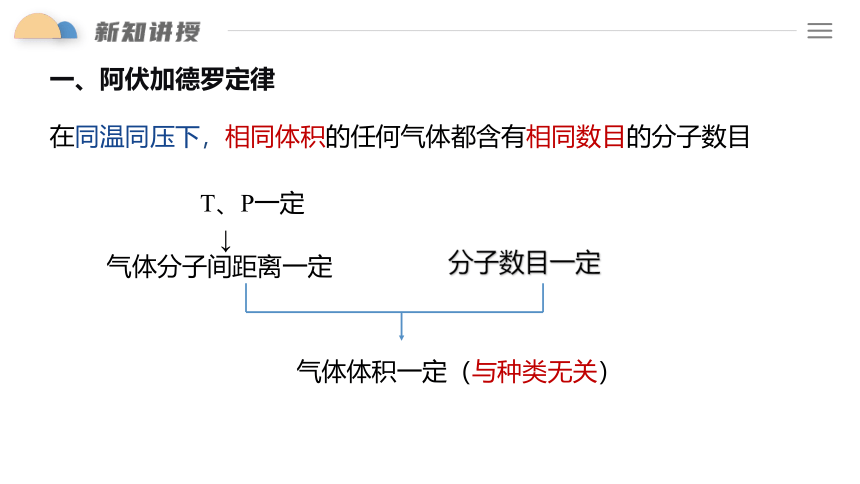
一、阿伏加德罗定律
在同温同压下,相同体积的任何气体都含有相同数目的分子数目
【特别注意】定律中有“四同”:
同温、同压、、同体积、同分子数目、三同定一同”
在同温同压下,不同气体所占的体积由什么因素决定?是什么关系?
[思考] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
在同温同压下,相同分子数的气体,其体积 ( );
在同温同压下,体积相同的气体,其分子数( ) ;
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
气体摩尔体积Vm的数值不是固定不变的,影响Vm因素是什么呢?
压强
分子数目一定
T、P一定
↓
气体分子间距离一定
气体体积一定(与种类无关)
一、阿伏加德罗定律
在同温同压下,相同体积的任何气体都含有相同数目的分子数目
阿伏加德罗定律的推论
推论一:同温同压下,气体的物质的量之比等于气体的体积比。
推论二:同温同压下,气体的密度之比等于气体的摩尔质量之比。
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于
其分子数目之比。
推论四:同温同压下,质量相等的气体,其体积之比等于其摩尔质量的反比。
PV=nRT(理想气体状态方程)
阿伏加德罗定律的推论
(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
(2) 同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
N1
-
N2
=
阿伏加德罗定律的推论
pV=nRT
ρ=
V
m
-
pM= ρRT
(3) 同温同压时(T 、P一定时)
=
ρ 1
-
ρ 2
M1
-
M2
(4) 同温同物质的量时(T 、n一定时)
=
P1
-
P 2
V2
-
V1
同温同压下,相同体积的下列气体中,质量最大的是( )
A 氯气 B 氢气 C 氧气 D 氮气
A
2.同温同体积同质量的下列气体,产生压强最大的( )
A、CO2 B、H2 C、O2 D、N2
B
3.在标准状况下,空气的平均式量为29,相同条件下的下列气体密度比空气密度大的是( )
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
①③④
4. 三个密闭容器中分别充入N2、H2、O2三种气体,下列说法正确的是( )。
A.当它们的体积、温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:p(H2)C.当它们的质量、温度和压强均相同时,三种气体的体积:V(O2)D.当它们的压强、体积和温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
C
描述 关系
三正比 同温同压下,气体的体积之比等于其物质的量之比
同温同体积下,气体的压强之比等于其物质的量之比
同温同压下,气体的密度之比等于其摩尔质量之比
二反比 同温同压下,相同质量的任何气体的体积与它们的摩尔质量成反比
同温同体积时,相同质量的任何气体的压强与它们的摩尔质量成反比
一连比 同温同压下,同体积的任何气体的质量之比等于它们的摩尔质量之比,也等于它们的密度之比
体积(V)
×Vm
÷ Vm
÷M
×M
(m)
质量
×NA
÷NA
微粒数
(N)
(n)
物质的量
宏观形式
微观形式
分子
离子
原子
电子等
=
m总
n总
(1) M
M= M1 a1% +M2 a2% + ......
a1、a2 ......为物质的量分数或体积分数
平均摩尔质量、相对密度的计算
(2)D相对 =
=
ρ1
-
ρ2
M1
-
M2
根据混合气体中各组分的物质的量分数或体积分数求混合气体的平均摩尔质量
在同温同压下,若A气体相对B气体的密度为D,则
1. 2molO2和1mol SO2组成的混合气体平均摩尔质量为多少?
M
—
=
m总
n总
=
32g/mol ×2mol +64g/mol× 1mol
2mol + 1mol
=
42.7g /mol
2. 设空气中O2和N2的体积比是1:4(忽略其他成分),计算空气的平均相对分子质量
M
—
= 32g /mol×1/5+ 28g /mol×4/5 =28.8g/mol
3. 某气体对H2的相对密度为16,则该气体的相对分子质量为 摩尔质量为 。
32
32 g/mol
4. 某气体在标准状况下的密度为1.25 g/L则该气体的摩尔质量为 ,该气体可能为 。
28 g/mol
CO或N2或C2H4
5. 已知CO和H2混合气体,其中CO的体积分数为20%,求混合气体的平均相对分子质量 ,该混合气体在标准状况下的密度为 相对于H2的密度为 。
7.2
0.32 g/L
3.6
十字交叉法:
32
28
28.8
0.8
3.2
6.若空气的平均分子量为28.8,请计算空气中N2与O2的体积比?
7.实验测定CO与O2的混合气体的密度是相同状况下H2 密度的14.5倍,则该气体的平均摩尔质量是_________, CO与O2的物质的量之比为_______
29g/mol
3 : 1
8. 某混合气体的密度是相同条件下氢气密度的12倍,该气体可能为( )
A、CO,CO2 B、 CH 4 ,CO 2
C、NO 2,Cl 2 D、 Cl 2 , O 2
B
气体摩尔体积
气体摩尔体积
物质体积大小的影响因素
① 物质的粒子数目
② 粒子的大小
③ 粒子之间的距离
概念:单位物质的量的气体所占的体积称为气体摩尔体积
符号:Vm
常用单位:L/mol(或 L·mol-1)、m3/mol(或 m3·mol-1)
阿伏伽德罗定律:相同温度和压力下,相同体积的任何气体均含有相同数目的分子
阿伏加德罗定律
第二章 海水中的重要元素——钠和氯
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1.气体摩尔体积
单位: L/mol
Vm=
V
n
公式:
符号: Vm
概念:单位物质的量气体所占的体积。
掌握气体摩尔体积时应注意以下几点:
1.气体摩尔体积仅仅是针对气体而言
2.气体在不同状况下的气体摩尔体积是不同的,任何气体在S.T.P下
Vm=22.4 L/mol
3.同温同压下,气体的体积只与气体的分子数目有关,而与气体的分子种类无关
4. 当气体摩尔体积Vm=22.4 L/mol时,气体不一定处于标准状态
一、阿伏加德罗定律
在同温同压下,相同体积的任何气体都含有相同数目的分子数目
【特别注意】定律中有“四同”:
同温、同压、、同体积、同分子数目、三同定一同”
在同温同压下,不同气体所占的体积由什么因素决定?是什么关系?
[思考] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
在同温同压下,相同分子数的气体,其体积 ( );
在同温同压下,体积相同的气体,其分子数( ) ;
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
气体摩尔体积Vm的数值不是固定不变的,影响Vm因素是什么呢?
压强
分子数目一定
T、P一定
↓
气体分子间距离一定
气体体积一定(与种类无关)
一、阿伏加德罗定律
在同温同压下,相同体积的任何气体都含有相同数目的分子数目
阿伏加德罗定律的推论
推论一:同温同压下,气体的物质的量之比等于气体的体积比。
推论二:同温同压下,气体的密度之比等于气体的摩尔质量之比。
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于
其分子数目之比。
推论四:同温同压下,质量相等的气体,其体积之比等于其摩尔质量的反比。
PV=nRT(理想气体状态方程)
阿伏加德罗定律的推论
(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
(2) 同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
N1
-
N2
=
阿伏加德罗定律的推论
pV=nRT
ρ=
V
m
-
pM= ρRT
(3) 同温同压时(T 、P一定时)
=
ρ 1
-
ρ 2
M1
-
M2
(4) 同温同物质的量时(T 、n一定时)
=
P1
-
P 2
V2
-
V1
同温同压下,相同体积的下列气体中,质量最大的是( )
A 氯气 B 氢气 C 氧气 D 氮气
A
2.同温同体积同质量的下列气体,产生压强最大的( )
A、CO2 B、H2 C、O2 D、N2
B
3.在标准状况下,空气的平均式量为29,相同条件下的下列气体密度比空气密度大的是( )
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
①③④
4. 三个密闭容器中分别充入N2、H2、O2三种气体,下列说法正确的是( )。
A.当它们的体积、温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:p(H2)
C
描述 关系
三正比 同温同压下,气体的体积之比等于其物质的量之比
同温同体积下,气体的压强之比等于其物质的量之比
同温同压下,气体的密度之比等于其摩尔质量之比
二反比 同温同压下,相同质量的任何气体的体积与它们的摩尔质量成反比
同温同体积时,相同质量的任何气体的压强与它们的摩尔质量成反比
一连比 同温同压下,同体积的任何气体的质量之比等于它们的摩尔质量之比,也等于它们的密度之比
体积(V)
×Vm
÷ Vm
÷M
×M
(m)
质量
×NA
÷NA
微粒数
(N)
(n)
物质的量
宏观形式
微观形式
分子
离子
原子
电子等
=
m总
n总
(1) M
M= M1 a1% +M2 a2% + ......
a1、a2 ......为物质的量分数或体积分数
平均摩尔质量、相对密度的计算
(2)D相对 =
=
ρ1
-
ρ2
M1
-
M2
根据混合气体中各组分的物质的量分数或体积分数求混合气体的平均摩尔质量
在同温同压下,若A气体相对B气体的密度为D,则
1. 2molO2和1mol SO2组成的混合气体平均摩尔质量为多少?
M
—
=
m总
n总
=
32g/mol ×2mol +64g/mol× 1mol
2mol + 1mol
=
42.7g /mol
2. 设空气中O2和N2的体积比是1:4(忽略其他成分),计算空气的平均相对分子质量
M
—
= 32g /mol×1/5+ 28g /mol×4/5 =28.8g/mol
3. 某气体对H2的相对密度为16,则该气体的相对分子质量为 摩尔质量为 。
32
32 g/mol
4. 某气体在标准状况下的密度为1.25 g/L则该气体的摩尔质量为 ,该气体可能为 。
28 g/mol
CO或N2或C2H4
5. 已知CO和H2混合气体,其中CO的体积分数为20%,求混合气体的平均相对分子质量 ,该混合气体在标准状况下的密度为 相对于H2的密度为 。
7.2
0.32 g/L
3.6
十字交叉法:
32
28
28.8
0.8
3.2
6.若空气的平均分子量为28.8,请计算空气中N2与O2的体积比?
7.实验测定CO与O2的混合气体的密度是相同状况下H2 密度的14.5倍,则该气体的平均摩尔质量是_________, CO与O2的物质的量之比为_______
29g/mol
3 : 1
8. 某混合气体的密度是相同条件下氢气密度的12倍,该气体可能为( )
A、CO,CO2 B、 CH 4 ,CO 2
C、NO 2,Cl 2 D、 Cl 2 , O 2
B
气体摩尔体积
气体摩尔体积
物质体积大小的影响因素
① 物质的粒子数目
② 粒子的大小
③ 粒子之间的距离
概念:单位物质的量的气体所占的体积称为气体摩尔体积
符号:Vm
常用单位:L/mol(或 L·mol-1)、m3/mol(或 m3·mol-1)
阿伏伽德罗定律:相同温度和压力下,相同体积的任何气体均含有相同数目的分子
